持续干旱及旱后复水对白榆叶片生理特性的影响
2015-08-01赵蓬晖张江涛王念王文君刘军
赵蓬晖,张江涛,王念,王文君,刘军
持续干旱及旱后复水对白榆叶片生理特性的影响
赵蓬晖1,张江涛1,王念1,王文君1,刘军2
(1.河南省林业科学研究院,河南 郑州 450008;2.焦作园林养护所,河南 焦作 454003)
利用自然控水法,研究持续水分胁迫下7个白榆优良杂交无性系1年生嫁接苗叶片的细胞膜透性、脯氨酸、丙二醛、可溶性糖含量等生理指标的变化,并进行抗旱性评价。结果表明:持续水分胁迫下,所测定7个无性系叶片的4项生理指标均呈升高趋势,复水后能逐渐回归至接近胁迫前的水平。经模糊隶属函数法进行抗旱性综合评价,抗旱性顺序为:225号>212号>34号>54号>55号>61号>43号,系号间差异不显著(P>0.05)。
白榆;无性系;水分胁迫;抗旱性
水分胁迫诱导植物体内发生各种生理生化反应,使植物细胞生理脱水,导致植株生长停止,光合作用受抑,呼吸紊乱,整个代谢异常,导致植物受害[1]。近年来,对植物水分关系的探讨已成为植物生理生态学研究领域的重要课题之一[2]。白榆因其极强的适应能力,被大量用于干旱等极端恶劣环境中,研究白榆杂交无性系在持续干旱条件下以及解除干旱胁迫后的生理变化,对指导白榆在干旱条件下的栽培和推广有着重要的意义。目前白榆研究主要集中在苗木培育、遗传多样性、栽培管理和组织培养等方面,而白榆逆境生理生化研究在白榆光合特性和耐盐性方面研究较多,有关白榆的抗旱生理研究较少。通过对白榆杂交无性系1年生苗的持续干旱处理,定期测定叶片生理指标的变化,并在植株上部叶片全部干枯脱落时重新恢复供水,观察测定复水后的变化情况,从而对白榆杂交无性系干旱胁迫下的适应性进行研究和评估,为白榆在干旱地区更好的推广利用提供理论依据。
1 材料与方法
1.1 试验材料
试验地点为河南省林业科学研究院院内,试验材料为优选出的225号、212号、34号、43号、54号、55号和61号7个白榆优良杂交无性系1年生嫁接苗,选择长势一致、生长状态良好的苗木,每系号9株,于4月下旬移植于普通塑料花盆内(350 mm×250 mm×350 mm),每盆1株,盆土为林地普通土壤,装盛土量一致,常规管理。待嫁接苗稳定成活、长势旺盛时(3个月后)进行控水试验。
1.2 试验处理
7月26日,将试验材料搬至排水条件良好的硬化地面上,随即浇自来水至饱和。试验采用完全随机区组设计,三次重复,每个重复每系号3盆。采用控水法自然干旱,自7月26日浇1次饱和水后停止浇水,阴雨天采用移动遮雨棚防风遮雨,8月9日,叶片枯黄、脱落,采样后,解除干旱胁迫浇复活水至饱和,随后正常养护。分别在干旱胁迫0 d(7月26日),4 d(7月30日),7 d(8月2日),10 d(8月5日),14 d(8月9日)及复水后第25天(9月3日,长出新叶,可以进行生理测定)的上午8:00,采集植株向阳面中上部的功能叶,每处理设3个重复,样叶袋封存置于冰桶,立即带回实验室进行生理指标测定。
1.3 测定方法
叶片质膜透性测定采用电导率法[3];丙二醛(MDA)含量的测定采用硫代巴比妥酸法[3];游离脯氨酸含量的测定采用酸性茚三酮法[3];可溶性糖含量测定采用苯酚法[4]。
1.4 统计分析
数据使用Excel,SPSS和DPS系统软件进行处理、统计并作图。采用隶属函数法对7个白榆无性系抗旱能力进行综合评定[5-6]。
指标与抗旱性正相关隶属函数公式:
(X)=(X-X)/(X-X)
指标与抗旱性负相关隶属函数公式:
(X)=1-(X-X)/(X-X)
式中X为i系号j指标抗旱系数,X、X为j指标抗旱系数的最大值和最小值,R(X)为i系号j指标的抗旱隶属值。再求取各抗旱指标隶属函数值的平均值,综合评定值越大说明该系号抗旱能力越强。
2 结果与分析
2.1 水分胁迫对叶片质膜相对透性的影响
植物细胞质膜维护细胞内微环境的相对稳定,并参与同外界环境进行物质交换、能量和信息传递。细胞质膜具有选择透性的独特功能,各种不良环境因素对细胞的影响往往首先作用于这层由类脂和蛋白质所构成的生物膜,使质膜受到一定的损伤。
由图1可知,在胁迫开始之前,7个无性系叶片相对电导率均处于较低的水平。水分胁迫条件下,叶片相对电导率变化趋势基本一致,均呈现持续升高的趋势,在胁迫7~10 d时有一个快速升高的趋势,随后上升幅度变缓。胁迫第14天时,7个无性系叶片相对电导率均处于较高的水平,范围在84.37%~98.51%之间,与胁迫前相比均为差异极显著(P<0.01)。此时43号叶片相对电导率最高,为98.51%,而54号变化幅度最大,为90.21%,较胁迫前升高了127%。复水后,叶片相对电导率迅速降低,复水后第25天测定结果表明,各无性系叶片相对电导率基本回复到胁迫前的水平,与胁迫前差异不显著(P>0.05)。

图1 质膜相对透性的变化
从整个水分胁迫过程中叶片相对电导率水平看,225、34、212号始终处于相对较低的水平,说明质膜透性增幅较小,受损程度较轻,抗旱能力相对较强;54号虽然叶片相对电导率水平较低,但变化幅度最大,而55、61和43号始终处于较高水平,这4个无性系质膜受损伤程度相对较高,抗旱能力较弱。复水后54、55号叶片相对电导率仍处于较高水平,说明这两个无性系在解除水分胁迫后细胞膜自我修复能力较差。
2.2 水分胁迫对杂交无性系叶片脯氨酸含量的影响
脯氨酸积累是植物为了应对干旱胁迫而采取的一种自我保护性措施。由图2可知,胁迫前至水分胁迫第4天这段时间,7个无性系叶片脯氨酸含量变化差异不显著(P>0.05),胁迫4 d后,7个无性系变化趋势呈三个类型,一类是54、55和43号无性系,这3个无性系在胁迫4~7 d时脯氨酸含量急剧升高,胁迫第7天时上升幅度最大,分别比第4天升高了2.6倍、5.0倍和4.1倍,7~10 d时增加幅度变缓,10~14 d时,54、55号含量略有下降,而43号略有上升,这3个无性系对水分胁迫比较敏感,轻度胁迫即开始积累大量的脯氨酸,并且在胁迫中期达到峰值,随后积累变缓甚至下降可能逆境伤害所致;一类是34和61号无性系,这两个无性系在胁迫4~10 d这段时间脯氨酸含量显著增加,胁迫第10天时分别比第4天升高了6.0倍和9.3倍,胁迫10 d后,含量又呈现明显的下降趋势。这两个无性系也是从轻度胁迫即开始积累大量的脯氨酸,并且持续时间更长,在后期脯氨酸积累骤减至较低水平,表现出明显受害症状;第3类是225、212号,胁迫4~7 d,脯氨酸含量变化不显著(P>0.05),胁迫第7天以后,含量才开始急剧升高,胁迫第10天时分别比第7天时升高了2.9倍和3.1倍,胁迫第10天后,225号略有升高,变化不显著(P>0.05),212号则有一定程度降低,两个无性系脯氨酸含量出现变化的时间明显滞后于其他无性系,说明能较长时间耐受轻度水分胁迫,且在胁迫中期能迅速积累脯氨酸,并长时间维持较高水平,以保护机体免受伤害,表现出较好的抗旱性状。

图2 脯氨酸含量的变化
复水后,7个无性系叶片脯氨酸含量均明显下降,但仍高于胁迫前的水平,以61号变化幅度最大,复水后是胁迫前的5倍,显著高于胁迫前(P<0.05),另外6个无性系复水后和胁迫前差异不显著(P>0.05)。除61号外,其他6个无性系均具有较强的旱后恢复能力,表现出优良的耐旱性。
2.3 干旱胁迫对杂交无性系叶片丙二醛含量的影响
丙二醛是细胞膜脂过氧化的产物,水分胁迫条件下,MDA含量上升的幅度与品种的耐旱特性有关[7]。由图3可知,干旱胁迫下,7个无性系叶片丙二醛含量持续升高,第14天时达到最高值,复水后又迅速回落。61号在胁迫10~14 d有一个明显的峰值,这段时间内丙二醛含量升高了1.4倍,第14天时丙二醛含量明显高于其他6个无性系,说明细胞膜受到明显伤害,耐旱性较差;而225号丙二醛含量则较长时间维持在较低水平,表现出较好的耐旱性。复水后7个无性系均基本回复至胁迫前的水平,说明旱后恢复能力较强。
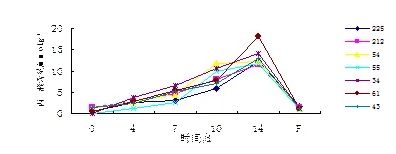
图3 丙二醛含量的变化
2.4干旱胁迫对杂交无性系叶片可溶性糖含量的影响
由图4可知,干旱胁迫下,7个无性系叶片可溶性糖含量呈增加趋势,复水后又迅速降低。在胁迫不同时期,7个无性系的可溶性糖含量变化趋势不尽相同。212号可溶性糖含量始终维持在较低水平,且复水后回复速度较慢;34、43和225号无性系在胁迫0~7 d时可溶性糖含量呈缓慢增加,胁迫7~10 d时含量急剧增加,10~14 d时增加速度趋于缓和;54、55和61号均在胁迫0~4 d时可溶性糖含量就出现急剧增加的趋势,随后增加幅度趋缓。至胁迫14 d时,7个无性系可溶性糖含量与胁迫前相比均为差异极显著(P<0.01)。复水后,7个无性系叶片可溶性糖含量较复水前(胁迫14 d)显著降低(P<0.01),但仍略高于胁迫前的水平(P>0.05)。

图4 可溶性糖含量的变化
2.5 抗旱性的综合评价
利用隶属函数法,对7个白榆无性系在干旱胁迫下的质膜透性、脯氨酸含量、丙二醛及可溶性糖含量4个抗旱指标分别进行隶属函数值计算,求出隶属函数值的平均值(见表1)。隶属函数值平均值越大,抗旱性越强。如表1所示,结果表明抗旱能力为:225号>212号>34号>54号>55号>61号>43号,对所得函数进行多重比较(LSD法),结果表明差异不显著(P>0.05)。

表1 7个白榆无性系生理指标的平均隶属函数值及排序
注:小写字母表示在=0.05水平上差异显著,大写字母表示在=0.01水平上差异极显著,字母相同表示差异不显著。
3 结论与讨论
植物在逆境下各种胁迫首先作用于细胞膜,细胞膜的破坏将加速整个细胞结构的伤害[8]。植物在遭受不良环境胁迫时,原生质膜的选择性透性受到影响,盐类或有机物从细胞中渗出,进入周围组织中,使周围环境电导率增加,通过测定外渗液电导率的变化,就可反映出质膜受损伤的程度[9]。白榆无性系水分胁迫下叶片相对电导率呈持续升高的趋势,说明在受到干旱胁迫时细胞质膜受到损伤,细胞膜透性增大,细胞内部分电解质外渗,导致外
液电导率增大。水分胁迫后期,所有参试苗木叶片已全部干枯,但复水后苗木复活率为100%,且复水后质膜透性可以基本回复到胁迫前的水平,说明白榆是个旱后恢复能力较强的树种。
脯氨酸积累是植物自身的一种保护性措施。Irigoyen(1992)发现,轻度水分胁迫使苜蓿根瘤组织积累较多的脯氨酸,并认为脯氨酸可保护蛋白质在水分胁迫下的不变性[10]。植物遭受水分胁迫出现游离脯氨酸大量累积的现象已在许多植物中获得证实。白榆无性系水分胁迫下叶片脯氨酸含量呈先升后降的趋势,复水后除61号无性系外基本回复至胁迫前水平。说明在水分胁迫初期,白榆叶片组织游离脯氨酸积累增加,但后期又减少,随着供水状况的改善,游离脯氨酸又恢复至正常水平。对于干旱条件下植物体内游离脯氨酸积累与作物抗旱性的关系至今存在着截然不同的意见[11]。脯氨酸含量对干旱胁迫的响应程度虽已广泛应用于植物抗旱性评价,但也有研究指出,对于耐旱性强的植物,脯氨酸积累并不明显;而对水分亏缺敏感的植物则表现出脯氨酸的大量积累[12]。因此,用该指标进行抗旱性评价时需要结合树种情况多角度考虑。
植物在受到干旱胁迫时,丙二醛含量是判断细胞遭受胁迫伤害和膜脂过氧化程度的常用指 标[5,13-15]。在水分胁迫条件下,往往发生膜脂过氧化作用,丙二醛是膜脂氧化降解的主要产物,具有很强的细胞毒性,对膜和细胞中的许多生物功能分子等均具有很强的破坏作用,并破坏生物膜的结构与功能[16]。干旱胁迫下,白榆7个无性系叶片丙二醛含量持续升高,膜脂过氧化程度变大。这与王启明等[17]对干旱胁迫下大豆苗期及花期生理生化指标研究、黄承玲等[5]对大白杜鹃()、惠竹梅[18]对2个葡萄欧亚种()的研究结果一致。白榆叶片丙二醛含量对土壤水分的变化非常敏感,甚至在植株还未表现出受害症状时,叶片丙二醛含量已发生明显变化,说明该指标是白榆抗旱能力评价的一个重要指标,对白榆干旱早期预测有一定的参考意义。复水后7个无性系均基本回复至胁迫前的水平,说明旱后恢复能力较强,这与白榆作为耐旱性树种的优良特性相一致。
在胁迫期间可溶性糖积累被认为主要是参与渗透调节作用。可溶性糖积累在细胞渗透调节中具有双重作用,一方面可以降低细胞渗透势以维持细胞膨压,防止细胞内大量的被动脱水;另一方面,可溶性糖过量积累会对光合作用产生反馈抑制[19]。可溶性糖在干旱胁迫时可作为渗透调节物质,因而多被用于评价植物抗旱的生理指标之一[20]。干旱胁迫下,白榆7个无性系叶片可溶性糖含量呈增加趋势,复水后又迅速降低,但仍略高于胁迫前的水平。说明可溶性糖含量的增加的确是水分亏缺时的保护性反应之一,对白榆抗旱性评价具有参考价值。
[1] 吴志华,曾富华,马生健,等. 水分胁迫下植物活性氧代谢研究进展[J]. 亚热带植物科学,2004,33(2):77-80.
[2] Li H j, Chai B F, Wang M B. Study on the water physio-ecological characteristics of Populus beijingensis[J]. acta ecologica sinica,2000,20(3):417-422.
[3]汤章城. 现代植物生理学实验指南[M]. 北京:科学出版社,1999:302-305.
[4]李合生. 植物生理生化试验原理和技术[M]. 北京:高等教育出版社,2000:134--200.
[5]黄承玲,陈训,高贵龙. 3种高山杜鹃对持续干旱的生理响应及抗旱性评价[J]. 林业科学,2011,47(6):48-55.
[6]周江,裴宗平,胡佳佳,等. 干旱胁迫下3种岩石边坡生态修复植物的抗旱性[J]. 干旱区研究 2012 29(3):440-444.
[7]李吉跃. 植物耐旱性及其机理[J]. 北京林业大学学报,1991(3):92-99.
[8]李朝周,梁恕坤,焦建,等. 逆境胁迫下多胺与乙烯代谢的相关性及其对细胞膜保护系统影响的研究进展[J].甘肃农业大学,2002,37(3):265-271.
[9]梅俊学. 逆温下发菜脯氨酸含量及膜透性的变化与含水量的关系[J]. 山东师范大学:自然科学版,2000,15(2):178-181.
[10]张彤,齐麟. 植物抗旱机理研究进展[J]. 湖北农业科学,2005(4):107-110.
[11]薛吉全,任建宏,马国胜,等. 玉米不同生育期水分胁迫条件下脯氨酸变化与抗旱性的关系[J]. 西安联合大学学报,2000,3(2):21-25.
[12]张建国,李吉跃,沈国舫,等. 树木耐旱特性及其机理研究[M]. 北京:中国林业出版社,2000.
[13]喻晓丽,邸雪颖,宋丽萍. 水分胁迫对火炬树幼苗生长和生理特性的影响[J]. 林业科学,,2007(11):56-61.
[14]孙景宽,夏江宝,田家怡,等. 干旱胁迫对沙枣幼苗根茎叶保护酶系统的影响[J]. 江西农业大学学报,2009,31(5):799-884.
[15]姜英淑,陈书明,王秋玉,等. 干旱胁迫对2个欧李种源生理特征的影响[J]. 林业科学,2009,45(6):6-10.
[16]吴永美,吕炯章,王书建,等. 植物抗旱生理生态特性研究进展[J]. 杂粮作物,2008,28(2):90-93.
[17]王启明,徐心诚,马原松,等. 干旱胁迫下大豆开花期的生理生化变化与抗旱性的关系[J]. 干旱地区农业研究,2005,23(4):98-102.
[18]惠竹梅,房玉林,郭玉枝,等. 水分胁迫对葡萄幼苗4种主要生理指标的影响[J]. 干旱地区农业研究,2007,25(3):146-149.
[19]蒲光兰,袁大刚,胡学华,等. 土壤干旱胁迫对3个杏树品种生理生化特性的影响[J]. 浙江林学院学报,2005,22(4):375-379.
[20]刘建锋,史胜青,江泽平. 几种引进柏树的抗旱性评价[J]. 西北林学院学报,2011,26(1):13-17.
(责任编辑:王文彬)
Effects of Progressive Drying and Re-watering on hysiological Indicators of Ulmus Pumila L. leaves
ZHAO Peng-hui1, ZHANG Jiang-tao1, WANG Nian1, WANG Wen-jun1, LIU Jun2
(1.Henan Forest Academy, Henan Zhengzhou 450008,China; 2. Jiaozuo Park Maintenance Station, Henan Jiaozuo 454003,China)
Under natural water control, studies were carried on the change of Membrane Permeability, Proline, Soluble sugar and MDA contents of seven one-year old Ulmus Pumila L. clones’ leaves. The results showed that under progressive drying stress, the tendency of physiological indicators was all went up and then went back to the previous level after re-watering. Through the average subordinative function method, we found the order of drought resistance ability was 225>212>34>54>55>61>43 clones.
Ulmus Pumila L.; clones; progressive drying stress; drought resistance ability
S728.2
A
1003-2630(2015)04-05-0001
2015-12-09
国家林业公益性行业科研专项“白榆种质资源收集保存及良种选育研究”(201204305)
赵蓬晖(1973-),女,硕士,高级工程师,主要从事林业遗传育种研究。E-mail:xiaop_73@163.com
