脐血多能干细胞对阿尔茨海默病患者外周血淋巴细胞的免疫调节作用
2015-07-31马海波唐小三李晓红
马海波,李 恒,唐小三,李晓红*
(1.山东大学医学院, 山东 济南 250012; 2.山东大学附属济南市中心医院 神经内科, 山东 济南 250013)
脐血多能干细胞对阿尔茨海默病患者外周血淋巴细胞的免疫调节作用
马海波1,2,李 恒2,唐小三2,李晓红2*
(1.山东大学医学院, 山东 济南 250012; 2.山东大学附属济南市中心医院 神经内科, 山东 济南 250013)
目的研究脐血多能干细胞(CB-SCs)对阿尔茨海默病(AD)患者外周血淋巴细胞(LCs)的调节作用,初步探讨其治疗AD的潜能。方法人脐血中分离并培养CB-SCs;AD患者外周血中分离淋巴细胞;将两者共培养3 d,其中植物凝集素P(PHA-P)刺激组刺激淋巴细胞增殖;ELISA法检测上清液中IL- 1、IL- 4和IL- 10的含量,流式细胞仪检测淋巴细胞亚群中CD4+/CD8+T细胞的比例、CD4+T细胞中调节性T细胞的比例及Treg细胞功能蛋白IL- 10和TGF-β1的阳性率。结果1)CB-SCs能抑制PHA-P诱导的LCs增殖及LCs聚集;2)CB-SCs共培养组的促炎因子IL- 1明显下降(P<0.05),抗炎因子IL- 4和IL- 10明显上升(P<0.01);3)CB-SCs可下调CD4+/CD8+T淋巴细胞比例(P<0.01);4)在无PHA-P作用时CB-SCs可以增加CD4+T淋巴细胞中Treg细胞的比例(P<0.01),PHA-P存在时CB-SCs主要增强Treg细胞功能蛋白的表达。结论CB-SCs在体外对AD患者外周血的淋巴细胞具有免疫调节作用,主要通过增加Treg细胞的比例及增强其抗炎功能来发挥作用。
干细胞;阿尔茨海默病;免疫调节;细胞因子;调节性T细胞
目前认为阿尔茨海默病(Alzheimer’s disease, AD)是一种系统炎性反应疾病,外周炎性反应能导致AD或加剧其进展,是AD的一个重要致病因素[1]。实验和临床研究证实,联合外周抗炎或单独进行外周抗炎能有效治疗AD[2- 3]。另有研究发现脐血多能干细胞(cord blood-stem cells, CB-SCs)可以通过调节外周血的免疫反应,有效治疗1型糖尿病[4],但CB-SCs是否同样可以通过免疫调节抑制AD过度的外周炎性反应,用于AD的治疗,至今未见研究报道。本实验通过CB-SCs与重度AD患者的外周血淋巴细胞共培养,探讨CB-SCs对AD的免疫调节作用。
1 材料与方法
1.1 材料
脐血样本取自山东大学附属济南市中心医院产科健康孕产妇,采集产后脐血10例样本,每例60~120 mL;选择近3个月内没有感染性疾病、没有应用任何具有免疫调节功能药物的临床确诊为重度AD的患者10例,每例采集约10 mL空腹静脉血。本研究经医院伦理委员会批准,采集前均告知孕产妇和AD患者及其家属并签订知情协议。Ficoll淋巴细胞分离液(Sigma公司);X-VIVO15无血清培养基(Lonza公司);细胞培养皿Petri Dish(Becton Dickinson公司);RPMI1640培养基、胎牛血清(Invitrogen公司);红细胞裂解液、Foxp3/转录因子染色液试剂盒和鼠抗人CD34-PE、CD45-PE、CD4-Alexa Fluor 700、CD8-FITC、CD4-FITC、CD25-PerCP-Cy5.5、Foxp3-Alexa Fluor 647、IL- 10-PE-Cy7和TGF-β1-PE(eBioscience公司);PBS缓冲液、0.25%胰蛋白酶-EDTA、PHA-P、青链霉素混合液(×100)(索莱宝公司);ELISA试剂盒(上海蓝基公司)。
1.2 方法
1.2.1 CB-SCs的分离、培养:依照Zhao等[5]分离培养CB-SCs的实验方法,采用Ficoll淋巴细胞分离液分离脐血中的单个核细胞,PBS洗1遍,随后用稀释9倍的红细胞裂解液作用8~12 min去除红细胞,PBS洗3遍。加入X-VIVO15无血清培养基,以(0.5~1)×106个/mL接种于培养皿,置于37 ℃、8% CO2培养箱中孵育10~14 d,待视野下细胞汇合度达到80%~90%后,用PBS洗3遍,除去上清液中的悬浮细胞。贴壁的干细胞分别进行以下鉴定及共培养实验。
1.2.2 流式细胞仪鉴定CB-SCs:0.25%胰蛋白酶-EDTA消化贴壁的干细胞后,10% FBS的X-VIVO15终止消化,PBS洗3遍后,用荧光抗体标记CD34和CD45,流式细胞仪检测细胞表面标志物CD34和CD45的表达。
1.2.3 AD患者外周血淋巴细胞的分离并与干细胞共培养:用肝素钠抗凝的一次性负压采血容器取约10 mL AD患者空腹静脉血,同样方法分离AD患者外周单个核细胞。单个核细胞接种于含20% FBS的RPMI1640培养基,置于37 ℃、5% CO2全湿条件下培养24 h,收集上清液中悬浮的淋巴细胞,分为4个组:1)LCs+PHA-P;2)CB-SCs+LCs+PHA-P;3)LCs;4)CB-SCs+LCs。两个共培养组中干细胞CB-SCs和AD患者外周血淋巴细胞比例为1∶3,其中作为淋巴细胞刺激剂的PHA-P浓度为4 mg/L。X-VIVO15无血清培养基培养3 d。
1.2.4 计数淋巴细胞并用ELISA法检测上清液中的炎性因子:分别收集各培养组细胞悬液,离心得到的淋巴细胞计数后用于下一步检测;上清液用于检测IL- 1、IL- 4和IL- 10的浓度,实验步骤按ELISA试剂盒说明书操作。
1.2.5 流式细胞仪检测细胞悬液中的CD4+/CD8+T淋巴细胞比例、调节性T细胞(regulatory T cells, Tregs)比例及其功能蛋白IL- 10及TGF-β1阳性率:各组悬液中的淋巴细胞做流式细胞检测。荧光抗体标记CD4和CD8分子,测各组CD4+/CD8+T淋巴细胞比例;用荧光抗体标记细胞表面分子CD4和CD25以及细胞内因子Foxp3、IL- 10和TGF-β1,测Treg细胞的比例及细胞内功能蛋白IL- 10和TGF-β1。用BD FACSAriaTMⅢ收集10 000个细胞分析。实验重复3次。
1.3 统计学分析

2 结果
2.1 CB-SCs表面抗原的鉴定及细胞形态
原代培养的CB-SCs贴壁生长,呈圆形或椭圆形(图1A)。CB-SCs标志物CD45表达率达100%,阴性标志物CD34表达率为2.5%(图1B)。
2.2 CB-SCs抑制PHA-P诱导的淋巴细胞增殖
3 d后CB-SCs+LCs+PHA-P组与LCs+PHA-P组相比细胞数量明显下降(P<0.01)。另外,LCs+PHA-P组与LCs组相比细胞数显著上升(P<0.01)(图2)。
2.3CB-SCs抑制PHA-P诱导的淋巴细胞聚集反应
培养3 d后,LCs组淋巴细胞无明显聚集反应(图3A);PHA-P刺激下的淋巴细胞出现大量团块状的聚集(图3B);CB-SCs+LCs组无明显聚集反应(图3C);CB-SCs+LCs+PHA-P组淋巴细胞偶尔出现聚集,但细胞凝集团小(图3D)。
2.4 CB-SCs对上清液中细胞因子的影响
经过3d的培养,CB-SCs+LCs+PHA-P组与LCs+PHA-P组相比,促炎因子IL- 1含量明显下降(P<0.05),抗炎因子IL- 4和IL- 10含量明显上升(P<0.01)(图4)。
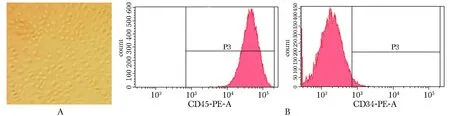
A.morphology of CB-SCs(×100); B.expression of surface marker CD45 and CD34 图1 CB-SCs表面标志物表达及CB-SCs细胞形态Fig 1 Surface marker expression and morphology of CB-SCs
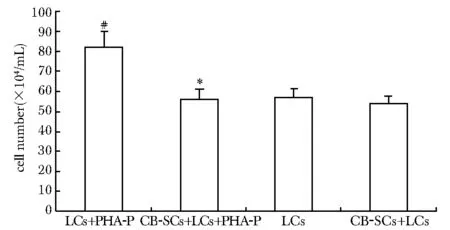
*P<0.01 compared with LCs+PHA-P; #P<0.01 compared with LCs图2 培养3 d后各组淋巴细胞数Fig 2 The number of lymphocytes in each group after cultured for 3 days (±s, n=3)
2.5CB-SCs对淋巴细胞中T淋巴细胞亚群的调节作用
LCs+PHA-P组CD4+/CD8+T淋巴细胞的比例为1.47±0.21,显著高于CB-SCs+LCs+PHA-P组的0.80±0.07(P<0.01,n=3);LCs组为1.31±0.15,显著高于CB-SCs+LCs组的0.65±0.10(P<0.01,n=3),与CB-SCs共培养能降低CD4+/CD8+T淋巴细胞比例。
CB-SCs+LCs组与LCs组相比,CB-SCs可以提高CD4+T细胞中CD4+CD25+Foxp3+细胞的比例(P<0.01)(图5A~D)和CD4+CD25+T细胞中Foxp3+的阳性率 (P<0.01)(图6A)。CB-SCs+LCs+PHA-P组与LCs+PHA-P组相比,CB-SCs上调CD4+CD25+T细胞中Foxp3、IL- 10(P<0.01)和TGF-β1的阳性率(P<0.05)(图6B),增强Treg细胞的抑制功能。另外,CB-SCs可使CD4+CD25+Foxp3-细胞的比例下降(图5E~H),降低激活态CD4+T细胞的比例。
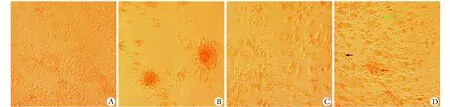
A.lymphocytes in the LCs group; B.4 mg/L PHA-P stimulated lymphocytes; C.lymphocytes co-cultured with CB-SCs; D.4 mg/L PHA-P stimulated lymphocytes co-cultured with CB-SCs; black arrow.CB-SCs; green arrow.lymphocytes; red arrow.small cell clump
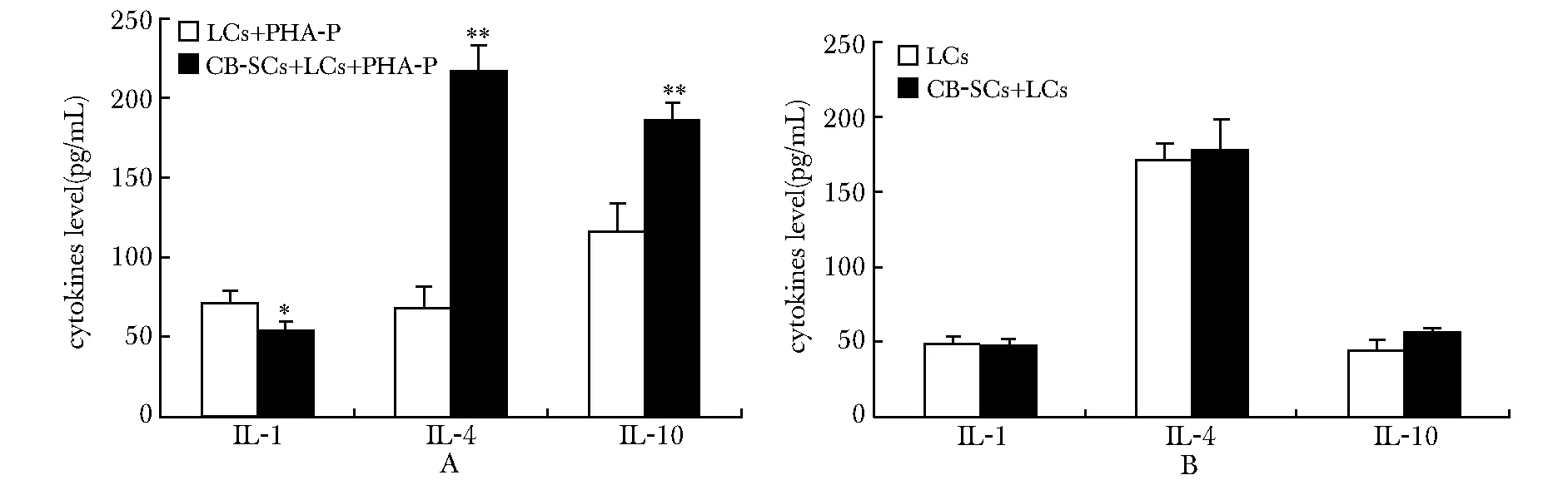
A.cytokines level in the groups of LCs+PHA-P and CB-SCs+LCs+PHA-P; B.cytokines level in the groups of LCs and CB-SCs+LCs; *P<0.05,**P<0.01 compared with the group of LCs+PHA-P
3 讨论
AD目前被认为是一种系统炎性反应疾病[1],患者外周血中促炎因子IL- 1浓度上升、抗炎因子IL- 4和IL- 10浓度下降[6- 7]。血液中升高的促炎因子能促进外周淋巴细胞及细胞因子透过血-脑脊液屏障,加速AD的发生和发展,并且血液中升高的IL- 1β是罹患AD的危险因素[6];研究表明IL- 4能够抑制Th1细胞分泌促炎因子,IL- 10能诱导Th0向Th2转化[8],抑制Th17细胞活性[9];另有文献报道外周血中存在的Th2细胞能明显改善AD病理变化及症状[10],而IL- 4和IL- 10是Th2细胞发挥免疫抑制功能的主要抗炎因子。本实验发现与CB-SCs共培养组上清液中IL- 1浓度下降,而IL- 4和IL- 10浓度升高。因此,CB-SCs对AD患者外周血淋巴细胞的炎性反应具有调节作用。
患者外周血中存在淋巴细胞过度激活的免疫反应[11]。本研究结果显示,CB-SCs明显抑制PHA-P刺激引起的淋巴细胞团块状凝集,共培养组的淋巴细胞数量下降;另外,CB-SCs下调CD4+/CD8+T淋巴细胞的比例,降低过度激活淋巴细胞中CD4+CD25+Foxp3-亚群的比例。CD4+/CD8+T淋巴细胞比值的下降是免疫抑制状态的敏感指标[12],而CD4+CD25+Foxp3-亚群是CD4+T淋巴细胞激活状态的标志[11]。据此,CB-SCs具有明显的免疫负向调节作用。

A,B.the LCs group; C,D.the CB-SCs+LCs group; E,F.the LCs+PHA-P group; G,H.the CB-SCs+LCs+PHA-P group; UL.the upper-left quadrant; UR.the upper-right quadrant; LL.the lower-left quadrant; LR.the lower-right quadrant
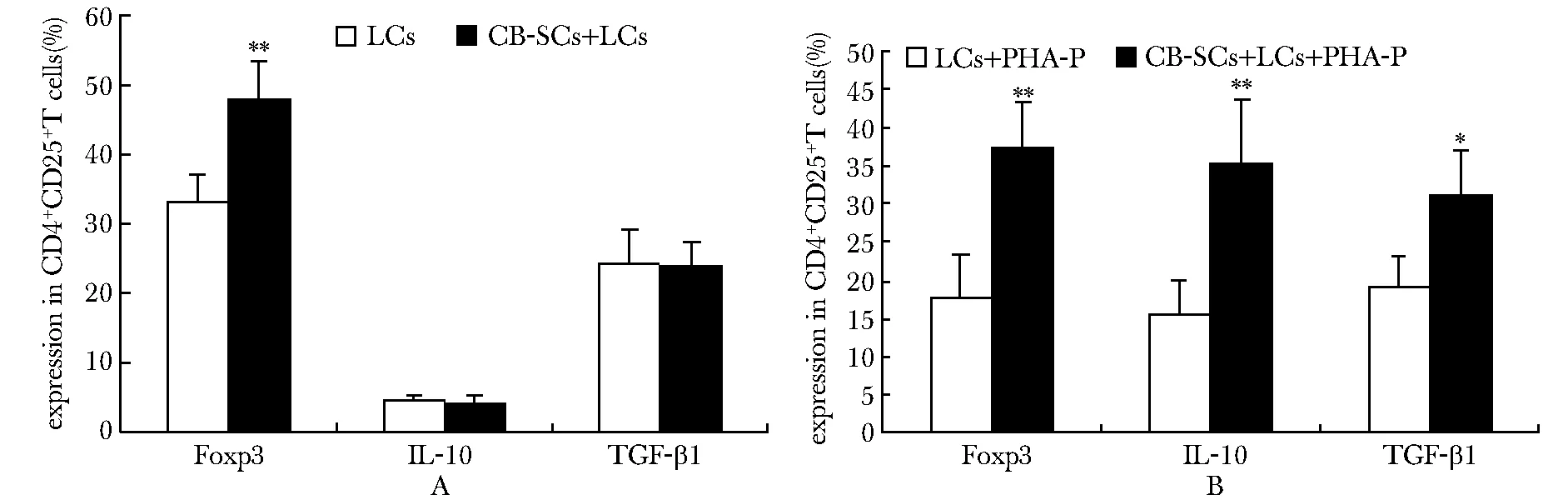
A.groups of LCs and CB-SCs+LCs; B.groups of LCs+PHA-P and CB-SCs+LCs+PHA-P; *P<0.05, **P<0.01 compared with the control group
外周血中发挥主要免疫抑制作用的细胞是Treg细胞。研究发现重度AD外周血中Treg细胞的数目和功能有一定程度的损伤[3]。目前向外周血中注射Treg细胞的治疗作用已经在AD[3]及脑卒中引起的神经炎性反应[13]中得到了验证。本实验发现,经过与CB-SCs共培养,AD外周血中CD4+CD25+Foxp3+细胞比例上升,而经过PHA-P处理的共培养组中虽未出现Treg细胞比例的变化,但是CD4+CD25+细胞中的TGF-β1+和IL- 10+细胞比例明显上升,提示Treg细胞的免疫抑制功能增强。文献显示,心内注射与干细胞共培养后分选的CD4+CD25+淋巴细胞可以改善中枢神经炎性反应[3],本结果与之相吻合。
本实验通过CB-SCs与淋巴细胞共培养,发现CB-SCs在体外环境下对AD患者外周血淋巴细胞有明显的免疫负向调节作用,可以调节AD患者外周血淋巴细胞的免疫和过度炎性反应,为临床应用提供了理论依据。CB-SCs的免疫调节作用对AD的治疗具有潜在的应用价值,临床应用还需更多系统性的比较研究和安全性评价。
[1] Zhang R, Miller RG, Madison C,etal. Systemic immune system alterations in early stages of Alzheimer’s disease[J]. J Neuroimmunol, 2013, 256: 38- 42.
[2] Holmes C. Review: Systemic inflammation and Alzheimer’s disease[J]. Neuropathol Appl Neurobiol, 2013, 39: 51- 68.
[3] Yang H, Yang H, Xie Z,etal. Systemic transplantation of human umbilical cord derived mesenchymal stem cells-educated T regulatory cells improved the impaired cognition in AbetaPPswe/PS1dE9 transgenic mice[J]. PLoS One, 2013, 8: e69129.doi:10.1371/journal.pone.0069129.
[4] Zhao Y, Jiang Z, Zhao T,etal. Reversal of type 1 diabetes via islet beta cell regeneration following immune modulation by cord blood-derived multipotent stem cells[J]. BMC Med, 2012, 10: 3.
[5] Zhao Y, Wang H, Mazzone T. Identification of stem cells from human umbilical cord blood with embryonic and hematopoietic characteristics[J]. Exp Cell Res, 2006, 312: 2454- 2464.
[6] 梁春荣,刘雨辉,王叶冉,等. 阿尔茨海默病患者外周血炎症因子水平与认知功能的相关性研究[J]. 解放军医学杂志, 2014,39: 133- 137.
[7] Saresella M, Calabrese E, Marventano I,etal. Increased activity of Th- 17 and Th- 9 lymphocytes and a skewing of the post-thymic differentiation pathway are seen in Alzheimer’s disease[J]. Brain Behav Immun,2011, 25: 539- 547.
[8] 蒋志琼,唐中,袁国华,等. 间充质干细胞在T细胞免疫反应中的调节作用[J]. 基础医学与临床, 2010,30: 547- 549.
[9] 闵锐,张饰,孙琦,等. 1型糖尿病患者外周血调节性T细胞及CD4+效应性T细胞相关细胞因子的表达[J]. 基础医学与临床, 2012, 32: 1461- 1464.
[10] Cao C, Arendash GW, Dickson A,etal. Abeta-specific Th2 cells provide cognitive and pathological benefits to Alzheimer’s mice without infiltrating the CNS[J]. Neurobiol Dis, 2009, 34: 63- 70.
[11] Pellicanò M, Larbi A, Goldeck D,etal. Immune profiling of Alzheimer patients[J]. J Neuroimmunol, 2012, 242: 52- 59.
[12] 陈璇,袁茵,邵红伟,等. 人脐带间充质干细胞培养上清对正常人淋巴细胞各亚群比例的影响[J]. 中国免疫学杂志, 2014, 30: 577- 581.
[13] Li P, Gan Y, Sun BL,etal. Adoptive regulatory T-cell therapy protects against cerebral ischemia[J]. Ann Neurol, 2013, 74: 458- 471.
Immune-modulation of cord blood-derived multipotent stem cells on lymphocytes of patients with Alzheimer’s disease
MA Hai-bo1,2, LI Heng2, TANG Xiao-san2, LI Xiao-hong2*
(1.Medical College, Shandong University, Ji’nan 250012; 2.Dept. of Neurology, Ji’nan Centre Hospital Affiliated to Shandong University, Ji’nan 250013, China)
ObjectiveTo investigate the regulatory effect of cord blood derived-multipotent stem cells (CB-SCs) on peripheral blood lymphocytes (LCs) of patients with Alzheimer’s disease (AD) and to explore the therapeutic potential of CB-SCs for AD.MethodsCB-SCs were isolated from human cord blood. Lymphocytes were isolated from the peripheral blood of patients with AD. Then, after the two cell populations co-cultured with or without phytohaemagglutinin-P (PHA-P) for 3 days, the levels of cytokines in the supernatant were detected with the ELISA test, the proportions of T-cell subsets were determined by the flow cytometric analysis.Results1)CB-SCs showed an inhibitory effect on lymphocyte proliferation and gathers induced by the PHA-P; 2)Compared with the control group, the level of the pro-inflammatory factor IL- 1 was dramatically decreased (P<0.05), while the release of the anti-inflammatory factors IL- 4 and IL- 10 were significantly increased (P<0.01) in the CB-SCs co-cultured
stem cells; Alzheimer’s disease (AD) ; immune modulation; cytokines; regulatory T cells
2014- 12- 08
:2015- 03- 13
国家自然科学基金(81373635);济南市科技发展国际合作项目(201212012)
*通信作者(correspondingauthor):lxh5231@126.com
1001-6325(2015)05-0654-07
研究论文
R741.05
:A
group. 3) The ratio of CD4+/CD8+T cells in the CB-SCs co-cultured group was significantly lower than that in the control group (P<0.01). 4) Compared with the control group, the proportion of regulatory T cells (Tregs) in the CD4+T cells was higher in the CB-SCs co-cultured group without the stimulation of PHA-P (P<0.01), while the anti-inflammatory proteins expressed in the Tregs was at a higher level with the stimulation of PHA-P.ConclusionsCB-SCs can regulate lymphocytes of patients with Alzheimer’s diseaseinvitro, which is mainly displayed with the increased proportion of Tregs subset and enhanced anti-inflammatoty function of Tregs.
