SPD1672蛋白对肺炎链球菌磷壁酸合成和细菌增殖的影响
2015-07-31张彦青黄美容吴凯峰胥文春
黄 健,张彦青,黄美容,吴凯峰,胥文春,王 虹*
研究论文
SPD1672蛋白对肺炎链球菌磷壁酸合成和细菌增殖的影响
黄 健1,张彦青1,黄美容2,吴凯峰1,胥文春1,王 虹1*
(1.重庆医科大学 检验医学院 临床检验诊断学教育部重点实验室, 重庆 400016;2.遵义医学院附属医院 输血科, 贵州 遵义 563003)
目的鉴定SPD1672基因在肺炎链球菌细胞壁多糖合成及增殖中的作用。方法通过生物信息学分析SPD1672蛋白可能的生物学功能,用替代失活法在肺炎链球菌D39菌株和R6菌株中敲除该基因,用电子显微镜观察基因缺失菌株与野生菌株荚膜厚度,Western blot检测磷壁酸合成量,最后以吸光度法测定肺炎链球菌体外增殖能力。结果成功构建SPD1672基因缺失菌;SPD1672基因缺失菌株与野生菌株相比,荚膜厚度无差异;而缺陷菌株的C反应蛋白结合量较野生菌显著减少(P<0.01),其磷壁酸含量也较野生菌显著下降。此外,SPD1672基因缺失菌体外增殖较野生菌缓慢(P<0.05)。结论SPD1672蛋白影响肺炎链球菌磷壁酸合成和体外增殖能力,是肺炎链球菌的一种新毒力因子。
肺炎链球菌;O抗原聚合酶;磷壁酸
肺炎链球菌(Streptococcuspneumoniae,S.pn)是引起细菌性肺炎、中耳炎、脑膜炎等疾病的一种重要致病菌,其在婴幼儿及老年人中具有很高的发病率与病死率,每年全球约有160万人死于S.pn感染[1]。近年来随着耐药菌株的出现及流行,给S.pn治疗带来严峻挑战[2]。因此,深入研究其致病的分子机制,筛选鉴定新的毒力因子,可为新蛋白质疫苗及抗菌药物的研制提供新的靶点。
本研究前期采用体内表达技术和差异荧光诱导技术共筛选出23个S.pn体内诱导基因,通常这类基因的表达增加可利于细菌的感染致病,是细菌感染过程中的一类重要的毒力因子[3]。SPD1672基因(NC_008533.1)为所筛基因之一。通过保守结构域分析,其编码产物SPD1672蛋白属于O抗原聚合酶家族蛋白,该家族蛋白在革兰阴性菌中主要参与细胞壁脂多糖的合成。因此,推测SPD1672蛋白可能参与S.pn细胞壁多糖合成。本研究拟通过分析该基因缺失后细胞壁多糖相关性状的变化来鉴定其可能的生物学功能,为进一步研究该基因对细菌毒力影响的机制打下基础。
1 材料与方法
1.1 材料
肺炎链球菌D39菌株,R6荚膜缺陷菌株,CPM8菌株(含红霉素抗性的erm基因)(重庆医科大学检验医学院临床检验诊断学教育部重点实验室保存)。抗磷壁酸抗体(丹麦国家血清研究院),辣根过氧化物酶标记的山羊抗兔二抗(北京中杉金桥生物技术有限公司),C-反应蛋白(C-reactive protein,CRP)标准品(Bio-Rad公司),Primer star高保真PCR试剂盒[宝生物工程(大连)有限公司],测序(南京金斯瑞生物科技有限公司)。
1.2 生物信息学分析
本研究以NCBI保守结构域分析软件、Blastp软件及ClustalX软件分别对SPD1672蛋白保守结构域、保守性及同源性进行分析。
1.3SPD1672基因缺失菌的构建
以D39菌株基因组DNA为模板,采用P1、P2引物扩增SPD1672上游基因片段; P3、P4引物扩增SPD1672下游基因片段;以CPM8菌株基因组DNA为模板,以erm-up、erm-down引物扩增红霉素抗性基因。然后将3段扩增产物等摩尔混合为模板,以P1、P4引物,扩增SPD1672up-erm-SPD1672down产物,将此连接产物转化D39菌株,利用红霉素抗性筛选出阳性克隆进行菌液PCR和测序鉴定,鉴定正确的阳性克隆即为D39SPD1672基因缺失菌(D39Δ1672)。为了排除荚膜的干扰,本研究同时构建了R6无荚膜菌株的SPD1672基因缺失菌(R6Δ1672)(表1)。
1.4 电镜观察荚膜
收集10 mL对数增殖中期D39与D39Δ1672菌液,以12 000×g离心10 min,弃去上清,收集细菌沉淀,加入1 mL戊二醛固定,送电镜室制片,用透射电子显微镜 Hitachi-7500(日立公司)观察荚膜厚度改变(放大倍数10万倍)。
1.5 C-反应蛋白与磷壁酸结合实验[4]
为了排除荚膜多糖的干扰,本研究选用了无荚膜的R6菌株进行实验研究。收集3 mLA600=0.6的R6及R6Δ1672菌液,12 000×g离心2 min,弃上清后用500 μL PBS重悬,56 ℃水浴中放置1 h灭活细菌。然后12 000×g离心2 min,弃上清,用200 μL的含有140 mg/L CRP标准品溶液重悬细菌,在37 ℃水浴中反应4 h,离心收集上清液即为未与细菌结合的CRP。沉淀用PBS洗涤3次,最后用200 μL含10 mmol/L EDTA 的PBS缓冲液重悬沉淀,37 ℃反应1 h,离心收集上清液即为与细菌结合的CRP, 每种细菌同时做5个平行管。然后将获得的样本送重庆医科大学附属第一院检验科对CRP含量进行检测,采用GraphPad Prism 5软件绘图及统计学处理,数据进行t检验分析。
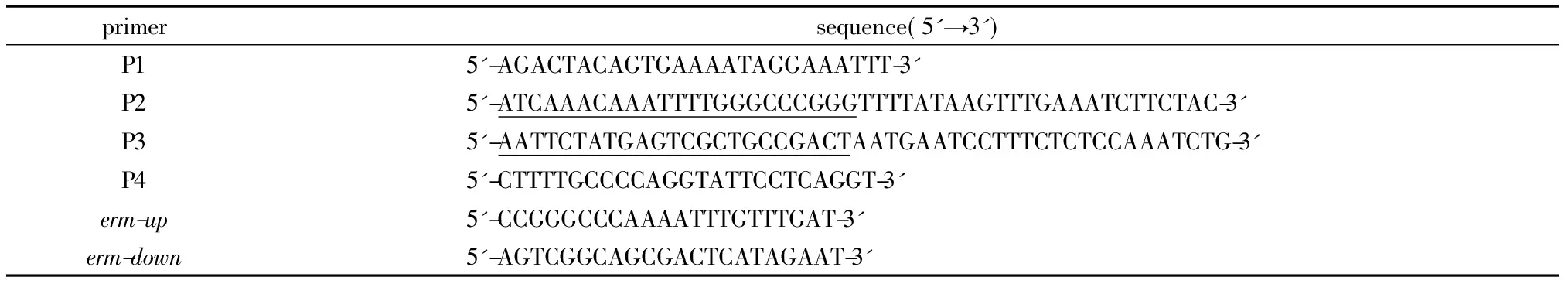
表1 构建SPD1672缺陷菌所用引物Table 1 Primer for construction SPD1672 deletion mutant
The underline section of P2 refers to a sequence complementary toerm-upand underline section of P4 refers to a terminus complementary toerm-down.
1.6 Western blot鉴定S.pn磷壁酸合成量
用文献方法[5]制备D39及D39Δ1672菌的原生质及细胞壁,取原生质和细胞壁样品液各20 μL,以抗磷壁酸抗体行Western blot分析壁磷壁酸(wall teichoic acid,WTA)和脂磷壁酸(lipoteichoic acid,LTA)含量,以S.pnCodY蛋白为内参。
1.7 吸光度法检测细菌生长速度
收集对数生长中期D39及D39Δ1672菌,用C+Y培养基调节菌液A600=0.1,然后分别取此菌液50 μL加至5 mL新的C+Y培养基中,平行做3个样品管,每1 h记录吸光度值A6001次,绘制增殖曲线,并采用配对t检验进行数据分析。
2 结果
2.1 生物信息学分析
SPD1672蛋白拥有O抗原聚合酶结构域,该结构域在革兰阴性菌中与O抗原(脂多糖)合成相关;且SPD1672蛋白的氨基酸序列在S.pn不同血清型间高度保守。此外,该蛋白还与链球菌属细菌如轻型链球菌或口腔链球菌等的O抗原聚合酶高度同源(图1)。

S.pn.StreptococcuspneumoniaeD39 andStreptococcuspneumoniaeJJA;S.mitis.StreptococcusmitisNCTC 12261;S.oralis.StreptococcusoralisATCC 35037;S.peroris.StreptococcusperorisATCC 700780;S.infantis.StreptococcusinfantisATCC 700779
图1 SPD1672与链球菌属细菌O抗原聚合酶序列比对结果
Fig 1 Sequence comparison between SPD1672 protein and O-antigen polymerase of streptococcus
2.2SPD1672缺失菌的构建及鉴定
用长臂同源技术成功获得spd1672up-erm-SPD1672down连接片段(图2),并成功构建D39菌及R6菌SPD1672基因缺失菌,PCR扩增缺失菌中的连接片段行测序鉴定,测序结果与预期相符(图3)。
2.3 电镜观察细菌荚膜
D39与D39Δ1672菌在荚膜厚度并无显著差别(图4)。
2.4 C-反应蛋白结合实验
R6Δ1672结合CRP的量较R6菌显著减少(P<0.01),同时与R6Δ1672反应后的血清中残留的CRP显著多于R6菌(P<0.001)(图5)。

M.marker;1.upstream Sequence of SPD1672; 2.downstream sequence of SPD1672; 3.erm gene; 4.junction fragment of SPD1672 up-erm-SPD1672down图2 构建SPD1672 up-erm-spd1672down连接片段Fig 2 Construct the link product of SPD1672 up-erm-SPD1672down

图3 基因缺失菌SPD1672 up-erm-SPD1672down连接片段测序图Fig 3 DNA Sequencing for the junction fragment of SPD1672 up-erm-SPD1672down

A.D39; B.D39Δ1672图4 透射电子显微镜观察D39和D39Δ1672荚膜厚度(色箭头表示荚膜多糖)Fig 4 Transmission electron microscope for observation capsule of S.pn D39 and D39Δ1672 strains (×10 0000)

*P<0.01, **P<0.001 compared with R6 group图5 C-反应蛋白与磷壁酸结合实验Fig 5 Binding experiment of C-reactive protein(n=5)
2.5 Western blot鉴定磷壁酸合成量
结果显示,D39Δ1672的WTA与LTA合成量均较D39菌株显著减少(图6),提示,SPD1672蛋白影响了S.pn磷壁酸的形成。

1.D39Δ1672 WTA; 2.D39Δ1672 LTA; 3.D39 WTA;4.D39 LTA图6 Western blot鉴定D39与D39Δ1672菌株磷壁酸合成量Fig 6 Teichioc acid synthesis quantity of S.pn D39 and D39Δ1672 strains
2.6 生长曲线
D39Δ1672菌增殖速度显著低于D39菌(P<0.05),其进入对数增殖期较D39延迟约4 h,且处于平台期的时间较短(图7)。

图7 D39与D39Δ1672菌体外增殖曲线Fig 7 Proliferation curve of S.pn D39 and D39Δ1672 strains
3 讨论
磷壁酸(teichoic acid,TA)是革兰阳性菌细胞表面的一种多糖聚合物,根据其锚定部位不同,可以分为WTA和LTA,它在细菌增殖繁殖和生理功能的维持及致病等过程中发挥着重要作用[6]。目前关于S.pn磷壁酸合成的机制尚不完全清楚。
SPD1672基因是本研究前期从S.pn中筛选出的一个体内诱导基因。生物信息学分析提示其可能参与细菌细胞壁多糖合成。由于S.pn表面主要的多糖结构是荚膜多糖和磷壁酸,因此本研究对这两种多糖成分进行了分析。通过对D39和D39Δ1672荚膜厚度进行分析,发现D39和D39Δ1672的荚膜厚度并无明显差别,提示SPD1672基因不影响荚膜多糖合成。
S.pn磷壁酸中的磷酸胆碱组分可以与CRP特异性的结合,因此,通过CRP结合实验发现D39Δ1672结合的CRP量较D39菌明显减少,提示该缺陷菌的磷壁酸含量可能较野生菌低。为了进一步确证这一结果,本研究对S.pn细胞壁(含WTA)及原生质体(含LTA)进行分离后通过抗S.pn磷壁酸抗体进行Western blot鉴定,发现D39Δ1672的WTA和LTA含量确实较D39显著减少,以上结果提示SPD1672基因是参与S.pn磷壁酸形成的重要基因。
本研究进一步分析了SPD1672基因对细菌基本性状的影响。体外增殖实验发现,SPD1672基因缺失后细菌进入对数增殖期时间较野生菌显著延迟,提示SPD1672基因可能在S.pn分裂繁殖的过程中发挥作用,这可能与S.pn磷壁酸参与细菌的增殖繁殖相关[7]。而增殖曲线还显示,缺失菌处于平台期时间较短,其自溶较野生菌加快,这可能与磷壁酸可影响自溶酶的功能发挥相关[8]。这些结果都提示SPD1672基因可能通过影响磷壁酸的形成而影响细菌的相关性状。
[1] Isaacman DJ, McIntosh ED, Reinert RR. Burden of invasive pneumococcal disease and serotype distribution amongStreptococcuspneumoniaeisolates in young children in Europe: impact of the 7-valent pneumococcal conjugate vaccine and considerations for future conjugate vaccines[J]. Int J Infect Dis, 2010, 14:197-209.
[2] Geng Q, Zhang T, Ding Y,etal. Molecular characterization and antimicrobial susceptibility ofStreptococcuspneumoniaeIsolated from Children Hospitalized with Respiratory Infections in Suzhou, China[J]. PLoS ONE, 2014,9: e93752.doi:10.1371/journal.pone.0093752.
[3] Meng JP, Yin YB, Zhang XM,etal. Identification of Streptococcus pneum-oniae genes specifically induced in mouse lung tissues[J]. Can J Microbiol, 2008, 54:58-65.
[4] Suresh MV, Singh SK, Ferguson DA,etal. Human C-reactive protein protects mice from Streptococcus pneumoniae infection without binding to pneumococcal C-polysaccharide[J]. J Immunol, 2007, 178: 1158-1163.
[5] Bender MH, Cartee RT, Yother J. Positive correlation between tyrosine phosph-orylation of CpsD and capsular polysaccharide production inStreptococcuspneumoniae[J]. J Bacteriol, 2003, 185: 6057-6066.
[6] Denapaite D, Brückner R, Hakenbeck R,etal. Biosynthesis of teichoic acids inStreptococcuspneumoniaeand closely related species: lessons from genomes [J]. Microb Drug Resist, 2012, 18: 344-358.
[7] Schirner K, Marles-Wright J, Lewis RJ,etal. Distinct and essential morphogenic functions for wall-and lipo-teichoic acids in Bacillus subtilis[J]. EMBO J, 2009, 28: 830-842.
[8] Schlag M, Biswas R, Krismer B,etal. Role of staphylococcal wall teichoic acid in tar-geting the major autolysin Atl[J]. Mol Microbiol, 2010, 75: 864-873.
SPD1672 protein influences teichoic acid synthesis and bacterial growth ofStreptococcuspneumoniae
HUANG Jian1, ZHANG Yan-qing1, HUANG Mei-rong2, WU Kai-feng1, XU Wen-chun1, WANG Hong1*
(1.Key Laboratory Medical Diagnostics, Ministry of Education, Dept. of Laboratory Medicine, Chongqing Medical University, Chongqing 400016;2.Zunyi Hospital Affiliated to Zunyi Medical College, Zunyi 563003, China)
Objective To identify the role ofSPD1672 gene inStreptococcuspneumoniaecell wall polysaccharide synthesis and proliferation. MethodsSPD1672-deletion strains were generated by the method of alternative inactivation inStreptococcuspneumoniaeD39 and R6 strains. The thickness of capsular polysaccharide was measured by electron microscope,and teichoic acid was detected by Western blot. Furthermore,the growth of wild strains and spd1672-deletion strainsinvitrowere observed by absorption spectrophotometry. Results No difference was found in the thickness of capsule between wild strains andSPD1672-deletion strains. However, the teichoic acid synthesis was significantly reduced in spd1672-deletion strains than that of wild strains. In addition, compared with wild strains,SPD1672-deletion strains grew more slowly. Conclusions SPD1672 is a new virulence factor ofStreptococcuspneumoniae, which may participate in the regulation of teichoic acid synthesis ofStreptococcuspneumoniaeand affect its growthinvivo.
Streptococcuspneumoniae;O-Antigen polymerase;teichoic acid
2014-12-11
2015-03-23
国家自然科学基金(81171532)
*通信作者(corresponding author):wanghongljf@163.com
1001-6325(2015)08-1031-06
Q933
A
