脂联素重组体对结肠癌细胞体外侵袭转移的影响
2015-07-31王福青赫欣
王福青 周 伟 赫欣
脂联素重组体对结肠癌细胞体外侵袭转移的影响
王福青 周 伟 赫欣
目的 探讨结肠癌细胞株SW-480中脂联素受体的表达情况以及人脂联素重组体对结肠癌体外增殖侵袭能力的影响。方法 通过RTPCR试验检测脂联素受体1和受体2在结肠癌细胞株中的表达,然后将SW-480细胞分设对照组和脂联素重组体作用(1、10、30、45、60μg/mL)组,作用后,分别以MTT法、划线迁移实验检测脂联素重组体对结肠癌细胞增殖、迁移能力的影响。结果 脂联素受体1、2在该细胞株中均有表达,脂联素重组体质量浓度高于10μg/mL时,对SW-480细胞生长具有明显的抑制作用(P<0.01),抑制作用随着浓度增高而增强;当脂联素重组体浓度大于30μg/ mL时,能明显地降低肿瘤细胞体外侵袭迁移能力(P<0.01),抑制率随脂联素重组体浓度的升高而增加,介于1.8%~42.0%之间。结论 脂联素重组体在大于10g/mL时,可能对结肠癌细胞的增殖迁移产生较为明显的影响。
脂联素;结肠癌细胞;脂联素受体;侵袭;转移
近年来研究表明,脂肪组织不仅是一个被动的储能器官,还可分泌多种具有重要生物活性的蛋白。其中脂联素(adiponectin)就是其中一种重要的细胞因子,在与肥胖相关的疾病中起着重要的调节作用[1]。脂联素的活性形式主要以球形结构域和全长形式存在,球形结构域比全长脂联素能更有效地改善胰岛素抵抗和增加脂肪酸氧化,具有更强的生物学活性。脂联素有2种受体:AdipoR1和AdipoR2,其中AdipoR1与gAd具有高度的亲和力,但与全长脂联素亲和力较低,AdipoR2对2种脂联素的亲和力相近,均为中等强度。脂联素通过脂联素受体使细胞产生相关应答反应并受脂联素受体的影响[2]。
脂联素生理作用的研究主要集中在与肥胖相关的一些疾病上,尤其是与Ⅱ型糖尿病胰岛素抵抗相关的研究。但随着研究的深入,发现脂联素与乳腺癌[3]、子宫内膜癌[4]、前列腺癌[5]以及消化道癌症等恶性肿瘤发生发展密切相关。众多研究证据显示脂联素水平的降低可能与结直肠癌症[6-7]的发生密切相关,但这些研究多集中于体内脂联素水平以及动物模型实验,在脂联素的体外作用方面的研究较少。本实验以体外培养的结肠癌细胞SW480为观察对象,检测细胞脂联素受体的表达情况,并观察不同浓度脂联素球形结构域对结肠癌细胞SW480的生长、迁移的抑制作用,为结肠癌的治疗提供新的思路及理论依据。
1 材料与方法
1.1 材料
1.1.1 试剂 L-15培养基购自GIBCO公司,血清购自四季青生物有限公司,脂联素球形结构域购自爱迪博生物科技有限公司,RNA提取试剂盒、RT-PCR、Trizal、Taq酶以及DNA Ladder均购自宝生物工程有限公司。
1.1.2 细胞培养 结肠癌SW480细胞从上海中科院细胞库购买,培养条件为含10%小牛血清的L-15培养液,于37℃、5%CO2的细胞培养箱中贴壁培养,传代采用0.25%胰蛋白酶消化。
1.2 方法
1.2.1 脂联素受体的表达检测 SW480细胞在37℃、5%CO2培养箱中孵育48h,待细胞处于对数生长期时,用Trizal试剂盒提取总RNA。随后,采用RT-PCR试剂盒合成cDNA,最后以此cDNA为模板对脂联素受体AdipoR1和AdipoR2进行扩增。目标基因的引物序列分别是:(1)AdipoR1:上游引物序列:5-AAACTGGCAACATCTGGACC-3,下游引物序列:5-GCTGTGGGGAGCAGTAGAAG-3,全长约 300bp;(2)AdipoR2:上游引物序列5-ACAGGCAACATTTGGACACA-3,下游引物序列5-CCAAGGAACAAAACTTCCCA-3,全长约407bp。扩增程序为95℃预变性10min,随后40个循环,每个循环为95℃变性20s,60℃复性15s,72℃延伸30s,循环结束后延伸10min。1%琼脂糖凝胶电泳并在成像系统中观察结果。
1.2.2 细胞增殖实验(MTT法) 选取对数生长期人结肠癌SW480细胞,调整细胞密度至5×103/mL,接种于96孔板,培养过夜。加入脂联素重组体,实验分为空白对照组和5个质量浓度梯度(1、10、30、45、60μg/mL),每组做3个平行孔,终体积为200μL,继续培养48h。培养结束前4h,每孔加入20μL质量浓度为5mg/mL的MTT,继续培养4h。弃上清,每孔加入100μL的DMSO,震荡10min,492nm测定光密度值。
细胞生长抑制率(%)=(1-实验组OD值/对照组OD值)× 100%。
1.2.3 细胞迁移检测 利用划线法进行细胞侵袭实验。参照Weis等方法进行划痕迁移实验。将结肠癌细胞以5×103浓度接种于24孔培养板上,待细胞铺满至80%,弃旧培养基,用20~200μL微量移液器枪头在孔中央划垂直痕,宽度为350μm,用PBS洗2次,在孔中分别加入3个质量浓度梯度的脂联素(10、30、45、60μg/mL)和PBS阴性对照,每个浓度设3个平行,加培养基至500μL/孔,继续培养24h,倒置显微镜观察,每个复孔随机选取3个视野进行拍照,计算迁移的细胞数,并测量划痕边缘的细胞向划痕区迁移的距离。计算脂联素对肿瘤细胞侵袭抑制率。
抑制率(%)=(对照组侵袭细胞数-给药组侵袭细胞数)/对照组侵袭细胞数×100%。
2 结果
2.1 RNA的提取及脂联素AdipoR1和AdipoR2在结肠癌细胞SW480中的表达 以结肠癌细胞RNA为模板,逆转录扩增出长度大约为300bp及430bp的2条片段,与预期的目的片段大小相符。见图1。说明脂联素受体AdipoR1和AdipoR2在结肠癌细胞SW-480中均有转录。

图1 脂联素受体表达情况
2.2 脂联素重组体对结肠癌细胞SW480增殖的影响 用质量浓度为1~60μg/mL的脂联素重组体处理SW-480细胞48h,MTT结果显示,随着脂联素浓度的提高,细胞悬液的吸光度逐步下降。见图2。通过计算测得脂联素重组体对结肠癌SW480细胞生长的抑制率介于2.9%~37.6%之间。见图3。各实验组与对照组比较,当浓度大于10μg/mL时,具有显著性差异,能够明显抑制肿瘤细胞生长作用(P<0.01)。
2.3 脂联素重组体对结肠癌细胞SW480侵袭迁移能力的影响 用质量浓度为1~60μg/mL的脂联素重组体处理SW-480细胞24h,观察细胞的侵袭划线迁移情况。见图4。并计算迁移率,结果显示,随脂联素重组体质量浓度的升高,其对细胞的侵袭抑制增加,抑制率介于1.8%~42.0%,当脂联素浓度大于30μg/mL时,均表现出较为明显的抑制肿瘤侵袭的作用。见图5。
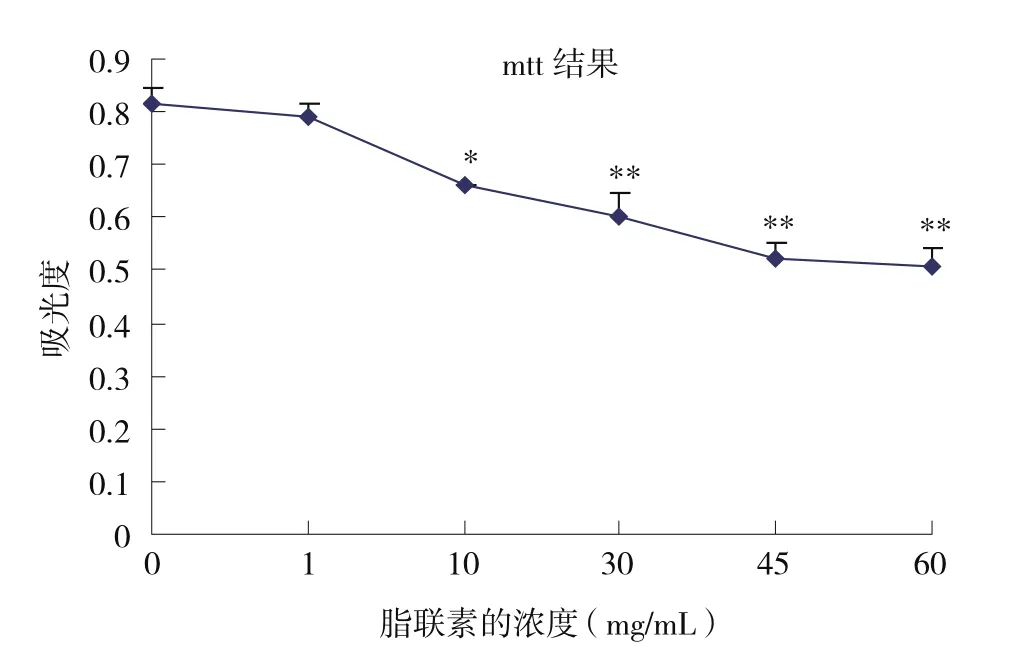
图2 不同浓度脂联素作用后的MTT结果
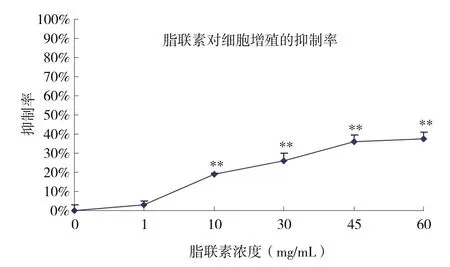
图3 不同浓度脂联素作用后对细胞增殖抑制率的影响

图4 不同浓度脂联素作用后结肠癌细胞SW480划线迁移结果
3 讨论
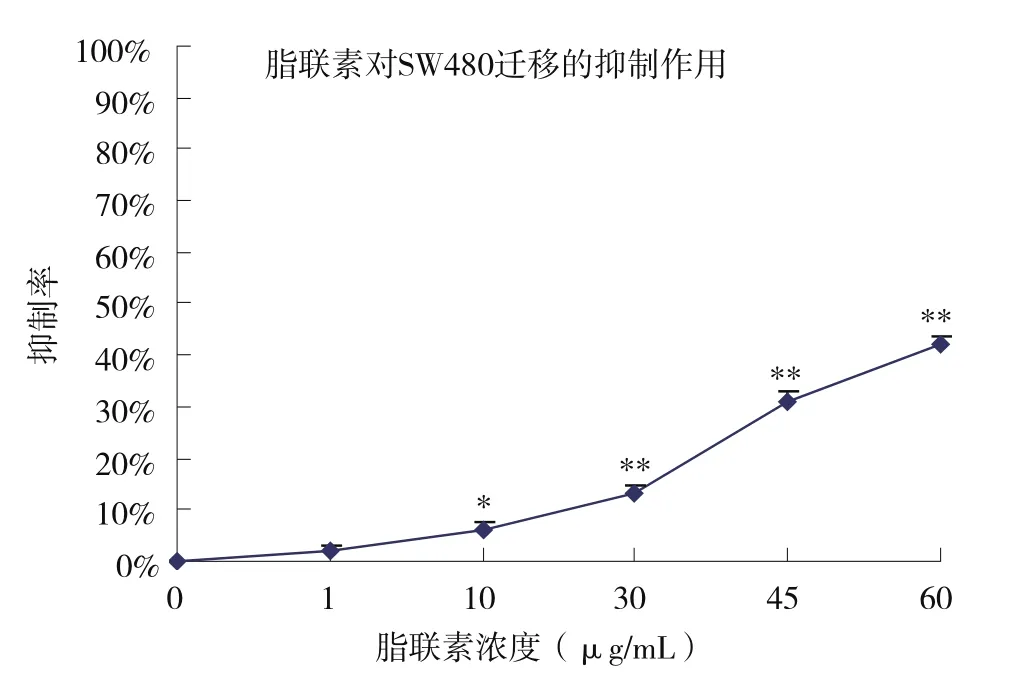
图5 不同浓度脂联素对结肠癌细胞SW480划线迁移结果
脂联素在糖类和脂类代谢中起着重要的作用,与肥胖、胰岛素抵抗等多种代谢性疾病相关,但随着研究的深入,有学者发现体内脂联素水平的改变与癌症的发生密切相关。关于脂联素与癌症之间的关系,目前的研究主要集中在临床病例分析方面,脂联素体外作用的研究相对较少。临床研究显示子宫肌瘤和子宫内膜癌患者血清脂联素水平明显低于对照组[4,8],也有研究显示脂联素可能与前列腺癌的侵袭性有关[9],一些学者还发现血清脂联素水平与乳腺癌高风险呈明显的负相关[10-11],在结直肠腺瘤和结直肠癌相关性研究中,也表现相同的趋势[6-7]。体外实验显示脂联素可以抑制一些癌症细胞的增殖,诱导凋亡,并对血管生成有抑制作用,从而阻断细胞的迁移。Bub等[12]发现长脂联素复合物明显抑制了前列腺癌细胞的生长。Kang等[13]验证生理浓度的脂联素可以明显抑制MDA-MB-231细胞系细胞的增殖,甚至引起细胞的凋亡。重组脂联素和及其基因的过表达明显地减少了MDA-MB-231细胞系雌性裸鼠的乳腺肿瘤形成[14]。Brakenhielm等[15]发现脂联素可明显抑制了鸡胚尿囊膜和小鼠角膜中的新生血管形成,在荷瘤小鼠模型中,脂联素通过减少瘤内新生血管形成造成肿瘤细胞凋亡,显著抑制了小鼠原发肿瘤的生长。由此可见,脂联素可能通过诱导新生血管生成及其他相关的基因的表达来影响肿瘤的生长与迁移。
结肠癌是常见的消化道恶性肿瘤,其发病率在世界上许多地区还呈逐年上升趋势。病例对照研究发现,循环系统中低水平的脂联素与男性结直肠癌发病风险呈负相关[16],脂联素缺乏的小鼠腹腔注射脂联素可以抑制结肠上皮细胞的增殖,而且球型脂联素比长链型的作用更加明显。另外结肠癌组织中adipoR1和adipoR2阳性表达率分别达95%和88%。
目前,有关脂联素对结肠癌细胞的增殖、凋亡、侵袭、转移及其分子机制的研究国内外报道较少。本实验检测了结肠癌细胞株SW-480中脂联素受体基因的表达情况,并研究了脂联素球形结构域对结肠癌细胞增殖、迁移以及凋亡的影响。通过RTPCR检测发现,2个受体基因AdipoR1和AdipoR2在该细胞株中均有所表达,脂联素球形结构能够有效地通过脂联素受体作用于细胞,从而对细胞的生长和迁移产生影响。在随后的MTT实验中,通过镜下观察,发现在高于10μg/mL的浓度下,SW-480细胞数量显著减少,细胞形态有所变化,出现收缩,结果显示脂联素球形结构域对细胞增殖具有明显的抑制作用。而迁移实验的结果显示,在低于30μg/mL浓度的情况下,脂联素对细胞增殖影响较小,而高于该浓度的条件下,随着脂联素浓度的增高,结肠癌迁移能力受到越来越大的影响。从实验结果可以看出,当脂联素球形结构域浓度达到一定程度时,能够抑制结肠癌的生长和迁移,但脂联素抑制肿瘤细胞的侵袭和转移的细胞内信号通路尚不清楚,有待进一步深入研究。
[1] Fruebis J,Tsao TS,Javorschi S,et al.Proteolytic cleavage product of 30kDa adipocyte complement related protein increases fatty acid oxidation in muscle and causes weight loss in mice[J].Proc Natl Acad Sci USA,2001,98(4):2005-2010.
[2] Yamauchi T,Kamon J,Ito Y,et al.Cloning of adiponectin receptors that mediate antidiabetie metabolic effects[J]. Nature,2003,423(6941):762-769.
[3] Chen DC,Chung YF,Yeh YT,et al.Serum adiponectin and leptin levels in Taiwanese breast cancer patients[J].Cancer Lett,2006,237(1):109-114.
[4] Soliman PT,Wu D,Tortolero-Luna G,et al.Association between adiponectin,insulin resistance,and endometrial cancer[J]. Cancer,2006,106(11):2376-2381.
[5] Burton A,Martin RM,Holly J,et al.Associations of adiponectin and leptin with stage and grade of PSA-detected prostate cancer:the Protect study[J].Cancer Causes Control,2013,24(2):323-334.
[6] Otake S,Takeda H,Suzuki Y,et al.Association of visceral fat accumulation and plasma adiponectin with colorectal adenoma:evidence for participation of insulin resistance[J].Clin Cancer Res,2005,11 (10):3642-3646.
[7] Ishikawa M,Kitayama J,Kazama S,et al.Plasma adiponectin and gastric cancer[J].Clin Cancer Res,2005,11(2Pt 1):466-472.
[8] Chen HS,Chan TF,Chung YF,et al.Aberrant serum adiponectin levels in women with uterine leiomyomas[J].Gynecol Obstet Invest,2004,58(3):160-163.
[9] Freedland SJ,Sokoll LJ,Platz EA,et al.Association between serum adiponectin,and pathological stage and grade in men undergoing radical prostatectomy[J]. Urology,2005,174:1266-1270.
[10] Duggan C,Irwin ML,Xiao L,et al.Associations of insulin resistance and adiponectin with mortality in women with breast cancer[J].J Clin Oncol,2011,29(1):32-39.
[11] Maskarinec G,Woolcott C,Steude JS,et al.The relation of leptin and adiponectin with breast density among premenopausal women[J].Eur J Cancer Prev,2010,19(1):55-60.
[12] Bub JD,Miyazaki T,Iwamoto Y.Adiponectin as a growth inhibitor in prostate cancer cells[J].Biochem Biophys Res Commun,2006,340(4):1158-1166.
[13] Kang JH,Lee YY,Yu BY,et al.Adiponectin induces growth arrest and apoptosis of MDA-MB-231 breast cancer cell[J]. Arch Pharm Res,2005,28(11):1263-1269.
[14] Wang Y,Lam JB,Lam KS,et al.Adiponectin modulates theglycogen synthase kinase-3beta/beta-catenin signaling pathway and attenuates mammary tumorigenesis of MDA-MB-231 cells in nude mice[J].Cancer Res,2006,66(23):11462-11470.
[15] Bråkenhielm E,Veitonmäki N,Cao R,et al.Adiponectin-induced antiangiogenesis and antitumor activity involve caspasemediated endothelial cell apoptosis[J].Proc Natl Acad Sci USA,2004,101(8):2476-2481.
Objective To investigate the expression of adiponection receptor(adipoR) and the effects of recombinant adiponectin (gAd) on the proliferation and migration of human colon cancer cell line SW-480. Methods SW-480 cells were divided into control group and gAd(1, 10, 30, 45and 60μg/mL) treatment groups, the effect of gAd on proliferation of SW-480 cells was measured by MMT assay, the invasive and migration abilities were assayed by scratch test. Results The proliferating ability of the cell was inhibitied in a concentration-dependent manner, with the ranging from 2.9%-37.6%, the cell proliferation was dramatically inhibited when the concentration of gAd was higher than 10μg/mL (P<0.01); the migration were also inhibitied in a concentration-dependent manner, with the ranging from 1.8% - 42.0%, the migration ability of SW-480 cells were dramatically inhibited when the concentration of gAd was higher than 30μg/mL (P<0.01). Conclusion These results indicate that the adiponectin dramatically inhibited the proliferation and migration of colon tumor cell when its concentration is >10μg/mL.
Adiponection; Colon cancer cells; Adiponection receptor; Migration; Metastasis
10.3969/j.issn.1009-4393.2015.24.001
河南 462002 漯河医学高等专科学校基础医学部 (王福青 周伟赫欣)
