紫菜多酚的超声波辅助提取工艺及其抗氧化作用
2015-07-22蔡建秀曾炜陈姗龙黄桂林泉州师范学院化学与生命科学学院福建泉州362000
蔡建秀,曾炜,陈姗龙,黄桂林(泉州师范学院化学与生命科学学院,福建泉州362000)
紫菜多酚的超声波辅助提取工艺及其抗氧化作用
蔡建秀,曾炜,陈姗龙,黄桂林
(泉州师范学院化学与生命科学学院,福建泉州362000)
摘要:研究超声波辅助提取紫菜多酚的工艺条件及其抗氧化活性。考察乙醇浓度、提取温度、提取时间、料液比对紫菜多酚提取得率的影响,并对紫菜多酚的抗氧化能力进行了测定。结果表明,超声波辅助提取最佳条件为乙醇体积分数为40%,超声波温度为35℃,超声波时间15min,料液比为1∶125(g/mL)。多酚在0.005mg/mL~0.5mg/mL范围内,对DPPH·的清除率不断升高,并且能够显著抑制小鼠肝肝组织匀浆MDA的生成和抑制H2O2诱导的小鼠红细胞溶血;腹腔注射紫菜多酚对小鼠体内肝组织MDA生成的抑制作用显著高于空白组。紫菜多酚有很好的抗氧化作用。关键词:多酚;自由基提取;抗氧化
紫菜是红藻门(Rhodophyta),红藻纲(Rhodophyceae),紫球藻科(Porphyridiaceae)紫菜属中叶状藻体可食用的种群。紫菜含有高达29%~35%的蛋白质以及碘、多种维生素和无机盐类,是一种重要的经济藻类。广泛分布于世界各地,但以温带为主。现已发现约70余种。
多酚(Polyphenols)又称单宁,是多羟基酚类化合物的总称,广泛存在与蔬菜、水果、谷物、豆类等植物中。研究证明,多酚具有抗动脉硬化,防治冠心病与中风等心脑血管疾病抗肿瘤抗氧化,以及具有抗菌消炎、抗过敏、防辐射、降血压等多种生理功能[1],在医药行业、食品、化妆品、日用化学品以及保健品等方面得到广泛的应用。紫菜多酚作为植物多酚的一种,同样具有以上多种生理功能,但是目前国内外对其研究尚少。因此,对紫菜多酚进行深入研究具有较大的意义,也是一个热点问题。
1 材料
1.1原料
紫菜:采集自福建崇武沿海,经粉粹并过60目筛得紫菜粗粉,密封备用。
1.2试验动物
昆明种小鼠,SPF级,雄性,体质量18 g~20 g,购自厦门大学实验动物中心,许可证号为scxk-(闽)2008-2001。
1.3主要仪器
KQ-300VDE型双频数控超声波清洗器:宁波新芝生物科技股份有限公司;3K-30高速冷冻离心机:上海安亭科技仪器厂;UV-1100型紫外可见分光光度计:北京普析通用仪器有限公司;SQ2119B多功能食品加工机:上海帅佳电子科技有限公司;TDL-40B飞鸽牌系列离心机、SH2-Ⅲ型循环水真空泵。
1.4试剂
焦性没食子酸:AR,国药上海化学试剂有限公司;丙二醛(MDA)测定试剂盒:南京建成生物工程研究所;福林酚试剂(福林酚试剂∶蒸馏水=1∶3)、磷酸二氢钠、磷酸氢二钠、碳酸钠、2-硫代巴比妥酸、三氯乙酸、硫酸亚铁、过氧化氢均为分析纯。
2 紫菜多酚的提取工艺
2.1紫菜多酚提取的单因素试验
2.1.1乙醇体积分数对多酚提取的影响
称取紫菜样品1 g(精确到0.000 1 g),加50mL乙醇溶液,超声时间20min,频率为80 kHz,料液比为1∶50(g/mL),在55℃条件下考虑时间对多酚提取的影响。考察的乙醇的体积分数分别为10%、25%、40%、55%、70%、85%。常压过滤,吸取滤液0.005m L在10mL的试管内,然后加入0.1mL福林酚试剂,2min~3min后加2%Na2CO32mL。后用蒸馏水定容到5mL,在25℃反应30min后,在760 nm测吸光度值。
2.1.2温度对多酚提取的影响
称取紫菜样品1g(精确到0.0001g),加50mL 40%乙醇,超声时间20min,频率为80kHz,料液比为1∶50 (g/mL),在此条件下考察提取温度对多酚提取的影响。考察的提取温度为25、35、45、55、65℃。处理方法同2.1.1。
2.1.3时间对多酚提取的影响
称取紫菜样品1g(精确到0.0001g),加50mL 40%乙醇,频率为80 kHz,料液比为1∶50(g/mL),在35℃条件下考察时间对多酚提取的影响。考察的时间分别为5、10、15、20、25min。处理方法同2.1.1。
2.1.4料液比对多酚提取的影响
称取紫菜样品1 g(精确到0.000 1 g),加入40%乙醇,频率为80 kHz,超声时间15min,在35℃考察时间对多酚提取的影响。考察的料液比分别为1∶25、1∶50、1∶75、1∶100、1∶125(g/mL)。处理方法同2.1.1[2]。
2.2紫菜多酚提取的正交试验
根据单因素试验结果,选择乙醇体积分数、料液比、超声频率及提取时间作为考察因素,采用L9(34)进行正交方案设计。正交试验的因素和水平见表1。

表1 优化提取条件正交试验因素水平Table 1 Factorsand levelsof orthogonal testof optim ization of extraction conditions
2.3标准曲线的制备
精密称取焦性没食子酸50mg,用甲醇定容在50mL的容量瓶中,制成1mg/mL的焦性没食子酸标准溶液。取浓度为1mg/mL的焦性没食子酸溶液0.001、0.002、0.003、0.004、0.005mL在10mL的试管内,然后加入0.1mL福林酚试剂,等2min~3min后加2%Na2CO32mL。后用蒸馏水定容5mL,在25℃反应30min后,在760 nm测吸光值[3]。以焦性没食子酸的浓度X(mg/ m L)对吸光度Y进行回归,得出回归曲线的方程为Y=28.467X-0.022 1,R2=0.999 1,焦性没食子酸在0.001mg/m L~0.005mg/m L的范围内呈良好线性关系。
3 紫菜多酚的体外抗氧化试验
3.1紫菜多酚对脂肪氧合酶(Lox)的影响
3.1.1脂肪氧合酶的制备
称取40 g青豆浸泡于100 mL磷酸缓冲液(0.01 mol/L,pH=7.0)中,浸泡7 h后将青豆破碎。取10 mL破碎后的混合液溶于100 mL的磷酸缓冲液,浸泡1 h,后离心(4 000 r/min,15min),取得的上清液即为酶液。
3.1.2脂肪氧合酶活性的测定
取0.2mL酶液与0.05mL不同浓度的紫菜多酚溶液混合均匀,在25℃下保温4min,加入0.8mL底物(含亚油酸1.32×10-3mL/L,0.5mL/L吐温-20的0.2mL/L pH9.0的硼酸缓冲液),混匀后再保温4min,后加入2 mL无水乙醇以终止反应。后再加入1.95mL蒸馏水,混匀,在234 nm处比色,测得吸光度值(A234)[4]。多酚对脂肪氧合酶的抑制率,可由以下公式求得:
式中:A0为空白管的吸光度值;A1为样品管的吸光度值。
3.2DPPH·清除能力的测定
3.2.1DPPH·(二苯基苦基苯肼)溶液配制
准确称取7.9mg DPPH·,用无水乙醇溶解并定容于100mL棕色容量瓶中,摇匀,放置于冰箱中备用。
3.2.2DPPH·清除率的测定
取2m LDPPH·溶液及2m L不同浓度的紫菜多酚溶液于同一支具塞比色管中,充分的混合,静置40min,在517 nm测定其吸光度。添加5mg/mL的VC作为阳性对照。每个样品平行做3次[5]。自由基清除率可由以下公式计算:
清除率/%=[(Ac+Aj-Ai)/Ac]×100
式中:Ac为2mL无水乙醇加2mLDPPH·溶液的吸光度;Ai为2mL待测液与2mLDPPH·溶液反应后的吸光度;Aj为2mL待测液加2mL乙醇的吸光度。
3.3紫菜多酚对体外H2O2诱导小鼠红细胞氧化溶血的影响
3.3.10.5%红细胞悬浮液的制备
小鼠眼眶取血,用柠檬酸制成抗凝血,于3 000 r/ min离心后得红细胞,用预冷的生理盐水洗3次,每次5min。除去上清液,将所得的红细胞制备成0.5%小鼠红细胞悬浮液[6]。
3.3.2紫菜多酚对体外H2O2诱导小鼠红细胞氧化溶血的测定
取0.5%红细胞悬液1mL,加到各试管,分为空白管、对照管、加药管,加药管分别加入不同浓度多酚0.5mL,混匀,37℃水浴10min。对照管、加药管加入50mmol/LH2O20.5mL,空白管、对照管加生理盐水补足到同一体积,摇匀37℃再水浴1 h,用生理盐水稀释5倍,3 000 r/min离心10min,取上清液在415 nm处测得吸光值A415[7]。其抑制率和溶血率的测定如下:
抑制率/%=[(A对管照-A加药管)/(A对照管-A空白管)]×100
溶血度/%=[(A加药管-A空白管)/(A对照管-A空白管)]×100
3.4紫菜多酚对小鼠肝匀浆自发性脂质氧化产生MDA的抑制率的测定
3.4.1制备10%的肝匀浆
将小鼠颈椎脱臼处死。迅速分离出小鼠肝组织,用0.4℃的冷生理盐水洗去残血,滤纸吸干水分,称重,减碎、冰浴下制得匀浆,用生理盐水制成10%的悬浮液,3 000 r/min离心20min,取上清液备用。
3.4.2多酚样液对小鼠肝匀浆自发性脂质氧化产生MDA的抑制率的测定
取10%的小鼠肝匀浆悬浮液1mL,加入不同浓度的紫菜多酚样品液0.2mL,在37℃温育1 h后,加入15%的TCA(三氯乙酸)1mL终止反应,再添加0.67% TBA(2-硫代巴比妥酸)1mL在沸水浴中显色15min,冷却后3 000 r/min离心10min,于532 nm处测得上清液吸光度值A[8],以吸光度表示MDA的含量,吸光度越大,表明MDA的含量越多。试验中取VC作为阳性对照。抑制率按下列公式计算:
抑制率/%=[(A0-A)/A0]×100
式中:A0为空白对照即不加样品的吸光度;A样品某浓度时的吸光度。
3.5紫菜多酚对小鼠肝匀浆Fe2+-H2O2诱导脂质氧化产生MDA的抑制率的测定
采用杨小兰等的方法略有改动。试验设定4组,1-自发氧化组:10%小鼠肝匀浆。2-诱导氧化组:10%小鼠肝匀浆加Fe2+-H2O2。3-紫菜多酚组:10%小鼠肝匀浆加Fe2+-H2O2和不同浓度的紫菜多酚样液。4-紫菜总黄酮组:10%小鼠肝匀浆加Fe2+-H2O2和不同浓度的紫菜总黄酮样液。在37℃温浴1 h后,加入15%TCA 1mL以终止反应,再加入0.67%TBA 1mL,于沸水浴中显色15min,静置。冷却后离心,于532 nm测其上清液吸光值A[9]。以吸光度表示MDA含量的多少。试验中6 mmol/L FeSO4溶液的用量是0.1 m L,60 mmol/L H2O2溶液用量为0.1mL,小鼠肝匀浆为1mL,多酚体积为0.2mL,清除率的计算,以下列方程:
样液的清除率/%=[(A1-An)/A1]×100
式中:A1为对照组的吸光度值;An为某浓度时的吸光值。
4 紫菜多酚的体内抗氧化试验
雄性小白鼠,体质量18 g~20 g,随机分成3组,每组10只。多酚作用组:0.05、0.5mg/m L紫菜多酚样液溶在0.2mL生理盐水中向鼠腹腔注射,紫菜多酚注射量为400mg/(kgbw·d),对照组注射等体积生理盐水。动物自由饮水取食,动物喂养条件按常规[10]。给药7 d后,取小鼠肝组织按3.4.2的方法测定A532。
5 结果与分析
5.1紫菜多酚的单因素提取试验
5.1.1乙醇体积分数对紫菜多酚提取率的影响
乙醇体积分数对紫菜多酚提取率的影响见图1。可知,随着乙醇的体积增加,多酚的提取率呈现先上升后下降的趋势,当乙醇的体积为40%时,多酚的提取率最高。这可能是因为当有机溶剂的体积分数较低时,不能破坏多酚与多糖、蛋白质等有机物质之间的氢键和疏水作用力[11],所以有机溶剂的体积分数增大,可以使紫菜多酚的提取率增大。当体积分数高于40%,多酚的提取率下降,这是由于紫菜中的色素,醇溶性物质等成分的溶出量增加,这些成分与多酚类化合物竞争同乙醇-水分子结合,同时紫菜组织中的通透性下降,从而导致多酚的提取率下降[12]。
5.1.2超声温度对紫菜多酚提取率的影响
不同的温度对紫菜多酚的提取效果影响见图2。

图1 乙醇体积分数对紫菜多酚提取的影响Fig.1 In fluence ofethanolconcentration on yield of laver total polyphenols
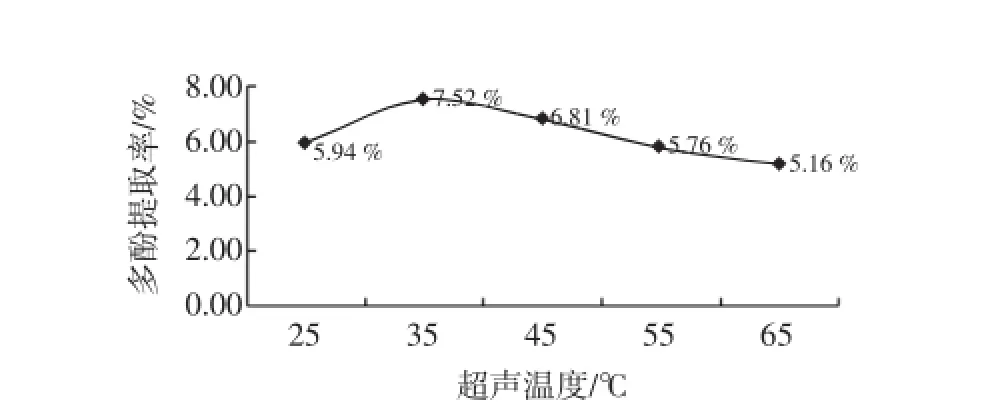
图2 温度对紫菜多酚提取的影响Fig.2 Influenceof tem peratureon yield of laver totalpolyphenols
由图2可知,随着温度的升高,紫菜多酚的提取率是呈先上升后下降的趋势,当温度为35℃时,多酚的提取率最高。当提取温度在25℃~35℃之间时,多酚的提取率不断的升高。当提取温度大于35℃时,由于多酚类物质本身的稳定性不强,结构遭到破坏,受热分解而导致多酚的提取率下降。
5.1.3时间对紫菜多酚提取率的影响
不同时间对多酚提取效果的影响见图3。

图3 提取时间对得率影响Fig.3 Influence of timeon yield of laver totalpolyphenols
由图3可知,随着时间的不断升高,紫菜多酚的提取率呈先升高后下降的趋势,当时间为15min时,紫菜多酚的提取率最高。当时间5min~15min时,由于时间过短,多酚类化合物同乙醇-水分子结合不够充分,导致提取率不高。当时间过长时,由于萃取的时间过长,多酚类物质受温度的影响,结构遭到破坏,多酚被氧化或者降解,而导致多酚的提取率下降。
5.1.4料液比对紫菜多酚提取的影响
不同的料液比对多酚提取效果的影响见图4。

图4 料液比对得率影响Fig.4 Influenceof liquid to solid ratio on yield of laver total polyphenols
由图4可知,随着料液比的不断增大,多酚的提取率呈现不断上升的趋势,当料液比为1∶125(g/mL)时,多酚的提取率最高。当料液比在1∶25(g/mL)~1∶100(g/mL)之间时,溶剂对多酚未达到饱和状态,继续添加溶剂是,能够显著的提高多酚的提取率。
5.2紫菜多酚提取的正交试验
由于影响紫菜多酚的提取率的因素很多,诸如提取溶剂的种类,浸提的时间,超声波的功率等,在确定以乙醇为提取剂的基础上,选取乙醇体积分数,时间,温度,料液比为考察因素,采用四因素三水平的L9(34)以寻求最优的工艺条件。试验结果见表2。

表2 紫菜多酚的正交试验表方案及结果Table2 Result of theorthogonalexperim entofextraction totalpolyphenols for laver
由表2、表3可知,在选定的试验条件下,料液比影响的因素最大,其次是温度,时间,乙醇的体积分数。料液比越低,越不利于紫菜中多酚的提取,说明了料液比较大有利于溶质与溶液的接触。乙醇的体积分数影响最小,25%与55%的乙醇体积分数对提取率的影响相差不大,反应温度的影响恰好相反,温度从25℃升高到45℃,紫菜多酚的的提取率有明显的升高,这表明升高温度,有利于溶质的扩散。同时,通过紫菜多酚的正交试验得出较优的试验组合为A2B3C2D2。即乙醇的体积分数为40%,料液比为1∶125(g/mL),提取温度为35℃,时间为15min。提取得率为11.32%。
5.3紫菜多酚的体外抗氧化试验
5.3.1紫菜多酚对脂肪氧合酶(Lox)的影响
紫菜多酚对脂肪氧合酶(Lox)的影响见图5。

表3 正交试验方差分析表Table3 Varianceanalysisofexperimental result

图5 多酚对脂肪氧合酶影响Fig.5 Effectof polyhenolextracts from laver on lipoxidase(Lox)activity
由图5可知,4个不同浓度的紫菜多酚对脂肪氧合酶都有显著的抑制作用,且随着多酚的浓度不断升高,抑制率呈现上升的趋势。但4个浓度之间,显示不出量—效关系。
5.3.2DPPH·清除能力的测定
DPPH·是一种很稳定的氮中心的自由基,它的稳定性主要来自共振稳定作用的3个苯环的空间障碍,使夹在中间的氮原子上不成对的电子不能发挥其应有的电子成对作用,可作为阻聚剂,也常用于抗氧化的体外抗氧化性评价。
见图6可知多酚和VC对DPPH·的具有显著的清除作用,且随着浓度不断增大,而体现更大的清除作用。在浓度为0.005mg/mL~0.05mg/mL之间,紫菜多酚对DPPH·的清除作用高于VC。而当浓度大于0.05mg/mL时,VC对DPPH·的清除作用高于紫菜多酚。当溶液中添加多酚时,由于与其单电子配对而使溶液颜色变浅,吸光度变小程度与自由基清除程度成线性关系,说明紫菜多酚有较强的抗氧化作用,但是不显示量效关系。
5.3.3紫菜多酚对体外H2O2诱导小鼠红细胞氧化溶血的影响
H2O2氧化红细胞膜或红细胞膜自主氧化,导致红细胞中的血红蛋白逸出,从而使溶液变红。

图6多酚对DPPH·清除作用Fig.6 Scavening effect of polyhenolextracts from laver on DPPH· freedom radical

表4 紫菜多酚对体外H2O2诱导小鼠红细胞氧化溶血影响(x±S,n=3)Table 4 Effectof polyphenols from laver on RBCHemolysis Induced by H2O2(x±S,n=3)
由表4可见,4种浓度的紫菜多酚都能够明显的抑制小鼠红细胞的溶血,当紫菜多酚的浓吸光度值升高,表明溶液中血红蛋白的含量增大,当浓度为0.5mg/mL时,对红细胞的溶血抑制率最高。
5.3.4紫菜多酚对小鼠肝匀浆自发性脂质氧化产生MDA的抑制率的测定
MDA是自由基攻击生物膜中的多不饱和脂肪酸而引发脂质过氧化作用的最终分解产物,其含量的多少可以反映组织中的脂质过氧化速率或强度。MDA含量异常增高会引起细胞损伤。因此通过测定MDA值可以评价机体抗氧化能力。而反应机制中,所测得的吸光度越大,MDA的含量越多。
由表5可知,紫菜多酚的4个不同浓度对肝组织匀浆自发性产生MDA都有抑制作用,但无量效关系。紫菜多酚试验组,相对于空白组P<0.05,各组之间存在着显著性的差异。说明在肝组织水平上,紫菜多酚的抗氧化保护性能好。
5.3.5紫菜多酚对小鼠肝匀浆Fe2+-H2O2诱导脂质氧化产生MDA的抑制率的测定
紫菜多酚对小鼠肝匀浆Fe2+-H2O2诱导脂质氧化产生MDA的抑制率见表6。
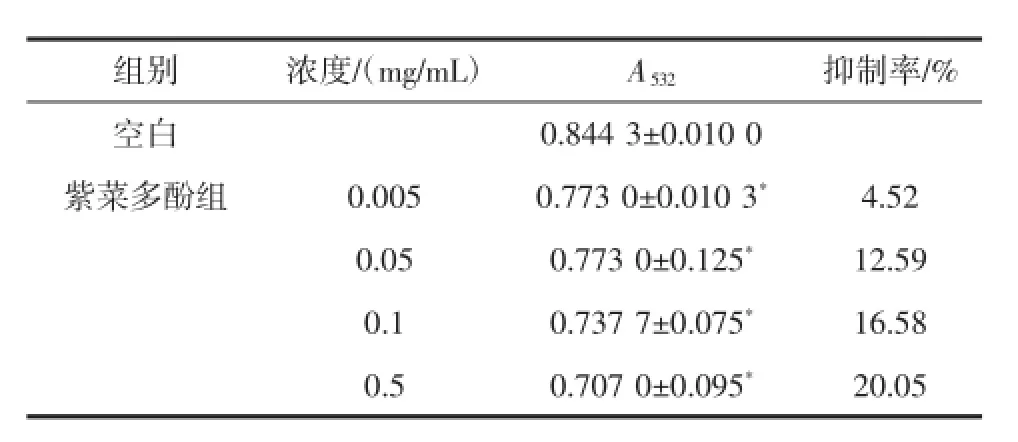
表5 紫菜多酚对小鼠肝匀浆自发性脂质氧化产生MDA的抑制率(x±S,n=3)Table 5 Effectof polyphenols from laver on MDA production inliver homogenateInduced by anti-oxidation(x±S,n=3)

表6 紫菜多酚对小鼠肝匀浆Fe2+-H2O2诱导脂质氧化产生M DA的抑制率的测定(x±S,n=3)Table6 Effectof polyphenols from laver on MDA production inliver hom ogenate Induced by Fe2+-H2O2(x±S,n=3)
由表6可知,紫菜多酚样液对小鼠肝匀浆液Fe2+-H2O2诱导脂质氧化产生MDA的抑制率随样液浓度的增加而增大。试样在0.005mg/mL~0.1mg/mL的浓度范围内时,随试样浓度增大对MDA抑制率的增加很显著。当样液浓度大于0.1mg/mL后,随试样浓度增大对MDA抑制率的增加比较缓慢。由表6可得,当浓度等于0.005mg/mL,紫菜多酚对MDA的抑制率达35.77%显著的高于紫菜总黄酮(抑制率为7.07%)。在0.05mg/mL~0.5mg/mL的浓度范围内时,紫菜多酚对MDA的抑制率高于紫菜总黄酮。
5.4紫菜多酚的体内抗氧化试验
紫菜多酚对小鼠体内肝组织匀浆MDA的影响见表7。

图7 不同成分对小鼠肝匀浆Fe2+-H2O2诱导脂质氧化产生MDA的抑制率的测定Fig.7 Differentelementson MDA production in liver homogenate Induced by Fe2+-H2O2
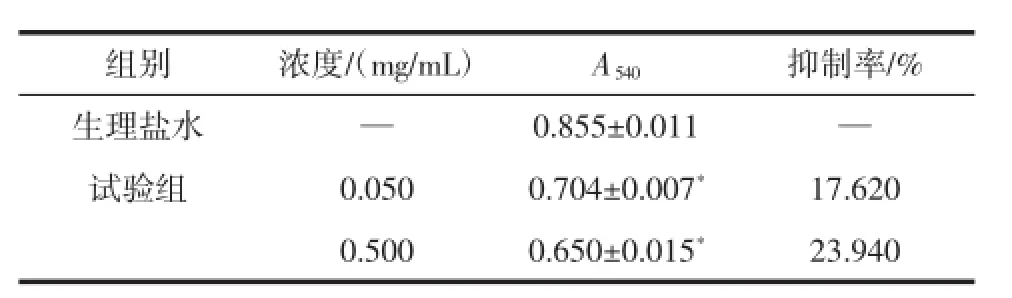
表7 紫菜多酚对小鼠体内肝组织匀浆M DA的影响(x±S,n=5)Table7 Effectofpolyphenols from laver inm ice liver invivo on MDA(x±S,n=5)
由于MDA是自由基攻击生物膜中的多不饱和脂肪酸而引发脂质过氧化作用的最终分解产物,其含量的多少可以反映组织中的脂质过氧化速率或强度。所测得的吸光度越大,MDA的含量越多。由表7可得,生理盐水组的吸光度值显著的大于紫菜多酚试验组,说明紫菜多酚组的MDA与对照组相比,有明显的下降,差异程度达到显著(P<0.05)。因而,在动物个体水平上,紫菜多酚的抗氧化作用很明显。
6 结果与讨论
本文着重讨论了紫菜多酚的超声波提取工艺和体内外的抗氧化作用。提取工艺实验表明,最佳的提取工艺为乙醇的体积分数为40%,料液比为1∶125(g/mL),提取温度为35℃,时间为15min。超声波提取紫菜多酚的提取率最高为11.97%。
通过对紫菜多酚的抗氧化研究得出,紫菜多酚具有较强的清除DPPH·的能力,在0.005mg/m L~0.5mg/m L质量浓度范围内,随质量浓度升高其清除DPPH·能力逐渐增强,当0.5mg/mL时,DPPH·抑制率达89.07%,与VC的抑制作用相当。
紫菜多酚具有较强的抗氧化能力,是一种天然的抗氧化成分,它有可能成为延缓人体衰老,抵抗疾病,增强人体抵抗能力的保健物质。MDA可以激发引起细胞多方面的损伤,是脂质氧化程度的重要指。该试验在紫菜多酚的浓度为0.5mg/mL时,对产生MDA的抑
DO I:10.3969/j.issn.1005-6521.2015.21.014
基金项目:近海资源生物技术福建省高校重点实验室(泉州师范学院);泉州市科技局科技重点项目(2013Z126);泉州师范学院海洋功能食品工程中心;福建省生物学重点学科专项经费资助
作者简介:蔡建秀(1957—),女(汉),教授,本科,研究方向:功能食品与药用食品及天然产物提取与分析。自然生长的紫菜数量有限,产量主要来自人工养殖。
Study on Ultrasonic-assisted Extraction Technology of Polyphenols in Laver and the Oxidation Effect of Flavonoids
CAIJian-xiu,ZENGWei,CHENShan-long,HUANGGui-lin
(CollegeofChemistry and Life Science,Quanzhou NormalUniversity,Quanzhou 362000,Fujian,China)
Abstract:To investigate the process condition of ultrasonicwave-assisted extraction ofpolyphenols from laver and antioxidant effects in vitro and in vivo.We investigated the volume fraction of ethanol,ultrasonic temperature,ultrasonic time,the ratio of solid to liquid seaweed polyphenol extraction rate influence,and the laver food polyphenols antioxidant capacity were determined in experiment.The results showed that the optimuml conditions of Ultrasonic wave-assisted extraction as following:40%ethanol as extract solvent,ultrasonic temperature was 35℃,ultrasonic time was 15 min,solid-liquid ratio was 1∶125(g/m L).The concentration of polyphenols ranges from 0.005 mg/mL to 0.5 mg/mL,the rate of removal was rising,and inhibited significantly themouse liver homogenate MDA generating and inhibited significantly of the hemolysis of red blood cells inducing by H2O2;Intraperitoneal injection of seaweed polyphenol onmice liver tissue MDA formation inhibition wassignificantly higher than thatof the blank group.
Keywords:polyphenols;free radical;extraction;antioxidantactivity
