高产类胡萝卜素酵母菌的诱变选育
2015-07-22王盼亮蒿洪欣杨清香河南师范大学生命科学学院河南新乡453007河南省高校资源微生物与功能分子重点实验室河南新乡453007
刘 冬,王盼亮,蒿洪欣,杨清香,2,*(.河南师范大学生命科学学院,河南新乡453007;2.河南省高校资源微生物与功能分子重点实验室,河南新乡453007)
生物工程
高产类胡萝卜素酵母菌的诱变选育
刘冬1,王盼亮1,蒿洪欣1,杨清香1,2,*
(1.河南师范大学生命科学学院,河南新乡453007;2.河南省高校资源微生物与功能分子重点实验室,河南新乡453007)
摘要:从12株红酵母菌中筛选得到一株生物量和类胡萝卜素产量较高的菌株KC 8,以KC 8为出发菌株,依次经ARTP诱变、亚硝酸钠诱变、紫外诱变、紫外-亚硝酸钠复合诱变,再进行一轮ARTP诱变。测得KC 8类胡萝卜素产量为8.67 mg/L,26 S rDNA测序表明,该菌株与胶红酵母(Rhodotorula mucilaginosa)100%相似性;最终从1 000株诱变存活菌株中筛选得到高产类胡萝卜素突变菌株K 4,产量为15.14 mg/L,为出发菌株的1.75倍,经高效液相色谱(HPLC)分析表明该菌株所产类胡萝卜素的主要成分为β-胡萝卜素。
关键词:红酵母;类胡萝卜素;鉴定;诱变
类胡萝卜素是一类具有抗氧化性功能的脂溶性色素的总称,属于多烯化合物,主要呈橙色、黄色或者红色,广泛地存在于植物、动物和部分微生物中[1-2]。工业生产中类胡萝卜素常被用来作为天然的食品着色剂或者在水产养殖中作为饲料添加剂。近年来研究调查表明,类胡萝卜素能够抑制肿瘤的发生和生长,预防眼病和心血管病,增强人体的抗氧化能力,已被WHO、欧共体及FAO等国际组织认定为A类营养色素[3-5]。
目前,国内外工业生产类胡萝卜素的方法主要包括3种:植物天然提取法,化学合成法以及微生物发酵法。其中微生物发酵法由于其成本低、工艺简单、质量稳定等优势最具发展前途,目前微生物发酵研究主要集中在三孢不拉式霉菌和红酵母两方面[6-8]。三孢布拉霉菌生产类胡萝卜素色素产量高,但其技术工艺复杂,发酵周期长。与三孢布拉霉菌相比,红酵母类胡萝卜素产量虽然低,但其生长周期短,营养要求简单,易培养,发酵过程控制容易,因此对红酵母生产胡萝卜素的研究具有巨大潜在应用价值和广阔开发前景,选育高产类胡萝卜素的红酵母菌株更具有实际意义[9-10]。本研究从实验室保藏的红酵母菌中筛选得到一株类胡萝卜素产量较高的菌株作为诱变出发菌株,通过采用新型的常压室温等离子体(ARTP)诱变技术与传统诱变技术相结合的方式进行诱变选育,以获得高产类胡萝卜素的红酵母菌株。
1 材料与方法
1.1菌株与培养基
红酵母:由河南师范大学资源微生物与功能分子河南省高校重点实验室保存,共优选12株,编号依次为KC 1、KC 2、KC 3、KC 4、KC 5、KC 6、KC 7、KC 8、KC 9、KC 10、KC 11、KC 12。
斜面活化培养基:葡萄糖20(g/L),蛋白胨10(g/L),酵母膏5(g/L),琼脂20(g/L),pH自然。
种子液培养基:葡萄糖20(g/L),蛋白胨10(g/L),酵母膏5(g/L),pH自然。
发酵培养基:葡萄糖31.8(g/L),酵母膏1,(NH4)2SO42(g/L),KH2PO41(g/L),MgSO4·7H2O 0.5(g/L),无水CaCl20.1(g/L),NaCl 0.3(g/L),pH 7.0。
以上培养基均用灭菌锅在0.1 MPa灭菌30 min。
1.2出发菌株的筛选[11]
取一环保藏菌种接种至斜面培养基,28℃恒温培养48 h活化菌种。用5 mL无菌水将斜面菌种洗下,转接入装液量为20 mL/100 mL的种子培养基中,28℃,180 r/min恒温震荡培养36 h,获得种子液。按10%接种量接入装液量50 mL/250 mL的发酵培养基中,28℃,180r/min恒温震荡培养96 h。8000r/min离心10min,收集菌体测定酵母生物量和类胡萝卜素产量,选用类胡萝卜素产量最高的红酵母做为出发菌株进行诱变育种,并对该菌株进行菌落形态观察和分子生物学鉴定[12]。
1.3仪器
ARTP II常压室温等离子体诱变仪:无锡思清源生物科技有限公司;安捷伦1200高效液相色谱仪:美国安捷伦公司。
1.4生物量的测定菌体生物量的测定采用菌体干质量法[13]。

1.5类胡萝卜素的提取和产量测定[3]
取3 mL发酵液于5 mL离心管中,8 000 r/min离心10 min,蒸馏水洗涤3次,收集菌体,加入3 mol/L的盐酸3 mL,混匀后室温下浸泡40 min,沸水浴4 min后迅速冷却,8 000 r/min离心10 min,去除HCl,向离心管中加入4 mL丙酮,室温下震荡以浸提类胡萝卜素。
将浸提液适当稀释后,利用分光光度计在487 nm处测定其吸光度值,然后按下式计算类胡萝卜素的产量:
类胡萝卜素产量/(mg/L)=Aλmax×D×V/0.16×V0
式中:Aλmax为类胡萝卜素在最大吸收波长(487nm)下的吸光度值;V为提取色素所用溶剂量,L;D为测定试样时的稀释倍数;V0为所用的发酵液总体积,L;0.16为类胡萝卜素的分子消光系数。
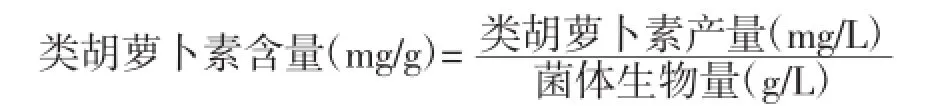
1.6酵母菌生长曲线的测定[14]
菌株在斜面培养基上活化后,取一环接种至种子培养基中,28℃,180 r/min恒温震荡培养,培养过程中从4 h后开始,每隔2小时取样测菌液在600 nm处的OD值,培养时间为横坐标,OD值为纵坐标,绘制菌株的生长曲线。
1.7诱变处理及正向突变菌株的筛选
菌悬液的制备:从斜面活化培养基上挑取适量菌体接种到种子培养基中,28℃,180 r/min恒温震荡培养至对数期,6 000 r/min离心10 min收集菌体,用无菌水洗涤3遍,重悬浮,制成菌体细胞浓度为108cfu/mL的菌悬液。
常压室温等离子体(ARTP)诱变:采用ARTP II常压室温等离子体诱变仪对菌悬液进行诱变处理。固定仪器的电源功率、气流量、等离子体发射源与菌悬液之间的距离等条件,将处理时间作为诱变的可变参数[15]。在本研究中ARTP的设定条件为:处理距离2 mm,处理功率120 W,气流量10 SLM,处理时间分别为0、30、60、90、120、150、180 s,处理后菌悬液进行适当稀释涂布到固体培养基上,28℃恒温培养2 d~3 d,计算致死率并绘制致死曲线,筛选出类胡萝卜素产量最高的突变菌株作为亚硝酸钠诱变的出发菌株。
亚硝酸钠诱变(NaNO2)诱变:取菌悬液1 mL于无菌锥形瓶,加入1 mol/L的醋酸缓冲液(pH 4.5)2 mL,0.1 mol/L的亚硝酸钠1 mL(对照组不加入亚硝酸钠),在26℃下分别保温10、15、20、25、30 min后每个样中快速加入20 mL 0.07 mol/L的磷酸氢二钠溶液(pH 8.6)终止反应后,适当稀释涂布到固体培养基上,28℃恒温培养2 d~3 d,统计平板上的菌落数,计算致死率,绘制致死曲线图,筛选出类胡萝卜素产量最高的突变菌株作为紫外诱变的出发菌株。
紫外(UV)诱变:取10 mL菌悬液于9 cm的无菌培养皿中,将培养皿置于稳定发光20 min后的15 w紫外灯下25 cm处,搅拌状态下照射,照射时间分别为0、20、40、60、80、100、120、140 s。此过程都必须在黑暗或红光中进行,防止光复活。紫外处理后的菌液适当稀释涂布到固体培养基上,28℃恒温培养2 d~3 d,统计平板上的菌落数,计算致死率,绘制致死曲线图,筛选出类胡萝卜素产量最高的突变菌株作UV-NaNO2复合诱变的出发菌株。
UV-NaNO2复合诱变:选取亚硝酸钠诱变致死率为85%左右的诱变剂量对菌悬液进行诱变,将诱变处理后的菌悬液用紫外诱变致死率为85%左右的诱变剂量进行诱变,筛选出类胡萝卜素产量最高的突变菌株作再一次ARTP诱变的出发菌株。
正向突变菌株的筛选:从突变株中挑选红色或橙红色,生长良好的单菌落,取一环接种至装液量为20 mL/100 mL的种子培养基中,28℃,180 r/min恒温震荡培养24 h,获得种子液。按照前述酵母生物量和类胡萝卜素产量测定的方法进行高产菌株的筛选。
1.8遗传稳定性实验
将筛选获得的高产类胡萝卜素红酵母菌株接种至斜面固体培养基上传代培养,共传10代,取第0、2、4、6、8、10次传代的菌进行摇瓶发酵培养,测其生物量和类胡萝卜素产量,检测筛选得到的高产菌株的遗传稳定性。
1.9类胡萝卜素成分分析[16]
按1.5方法提取红酵母的类胡萝卜素后,浸提液用0.45 μm滤膜过滤后制得类胡萝卜素样品,利用高效液相色谱仪分析类胡萝卜素样品中的组分。
液相条件:流动相A为乙腈∶甲醇(95∶5,体积比);流动相B为乙腈∶甲醇∶乙酸乙酯(60∶20∶20,体积比)。
色谱条件:100%A保持5 min,13 min时100% B,保持100%B至完成,流速1 mL/min,柱温28℃,进样量20 μL,检测波长487 nm。
2 结果及分析
2.1出发菌株的筛选及鉴定
按照材料与方法所述对红酵母进行初筛,从12株红酵母中获得一株生物量,类胡萝卜素含量及类胡萝卜素产量均较高的菌株KC 8,其生物量为(10.02± 0.12)g/L,类胡萝卜素含量为(0.87±0.01)mg/g,类胡萝卜素产量为(8.67±0.07)mg/L。
菌株KC 8在固体培养基上菌落呈橙红色,圆形,表面光滑,较湿润,边缘无缺刻;经番红染色后在显微镜下观察结果见图1。

图1 菌株KC8的显微形态(×1 000)Fig.1 Micrographic observation of strain KC 8(×1 000)
图1表明,细胞呈圆形或椭圆形,细胞长约3μm~5μm,宽约2μm~3μm,无成簇、成链现象。对其26SrDNA片段进行测序(GenBank登录号:KP760069)并在NCBI进行Blast同源性检索,结果表明与Rhodotorula mucilaginosa有100%的相似性,构建系统发育树见图2。
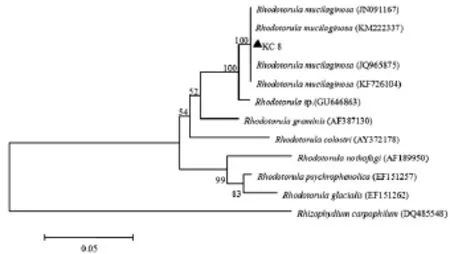
图2 基于26 S rDNA基因序列的系统进化树Fig.2 Phylogenetic tree based on 26 S rDNA sequences
图2表明,KC 8与Rhodotorula mucilaginosa聚为一簇,因此该红酵母菌株KC 8的鉴定结果为胶红酵母(R.mucilaginosa)。
2.2菌株生长曲线的测定
诱变处理一般选取对数期的菌株,此时菌体生长状况比较同步,代谢活性高而稳定,生活力强,易变异且重复性好。对出发菌株的生长曲线测定结果如图3所示。

图3 菌株KC 8的生长曲线Fig.3 The growth curve of initial strain KC 8
由图3可以看出,菌株KC8在培养12h~24h期间处于对数期,因此选取培养20h后的菌液进行诱变处理。
2.3诱变剂量的选择
ARTP诱变的致死结果如图4 A所示。随着照射时间的延长,致死率逐渐升高,当照射时间为120 s时,致死率接近100%,当致死率在85%左右时,有较高的正突变率[17],因此选择照射时间为120 s。NaNO2诱变的致死率结果如图4 B所示,一经NaNO2诱变处理,菌体细胞就开始死亡,致死率随诱变处理时间的延长逐渐升高,处理时间为20 min时菌体细胞死亡率达到98.4%。当致死率在85%左右时,有较高的正突变率,因此选择NaNO2诱变处理时间为15 min。紫外诱变的致死率结果如图4 C所示,菌体细胞受到紫外照射便开始死亡,并且随照射时间的延长死亡率平缓上升。紫外照射时间为100 s时,菌体细胞死亡率达到97.8%,照射时间为80 s时,菌体细胞死亡率为83.2%,因此,为了获得高的正突变率,紫外照射时间应为80 s。2.4高产类胡萝卜素菌株的筛选
按照方法1.7对红酵母菌株KC 8进行诱变处理,从每次诱变后获得的突变株中各挑选出200株生长良好的菌株,测其生物量,类胡萝卜素含量及类胡萝卜素产量,并计算各诱变方法的正突变率,各诱变方法筛选获得的最高类胡萝卜素产量及类胡萝卜素产量正突变率结果如表1。
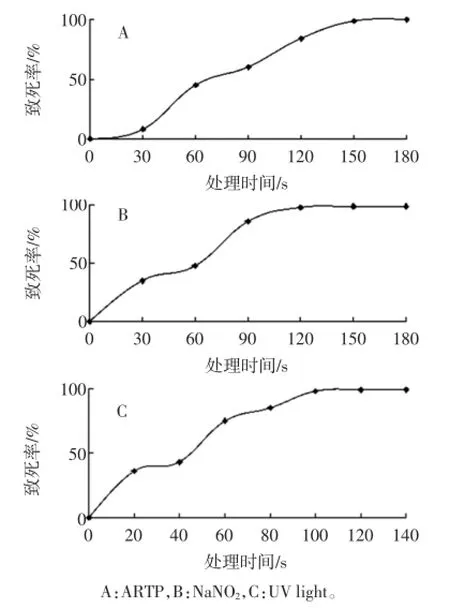
图4 不同诱变条件下的致死曲线Fig.4 Lethal curves of starting strains under different mutation conditions

表1 不同诱变条件下获得的最高类胡萝卜素产量及正突变率Table 1 The highest carotenoid yields and positive mutation rates obtained by using different mutation methods
ARTP诱变是一种新型诱变技术,和传统诱变方法相比,ARTP诱变对遗传物质的损伤机制多样,获得突变型多样性的可能性较大,研究结果表明,ARTP技术可以快速有效地突变细菌、放线菌、霉菌、酵母等微生物[18-20]。从表1可以看出,ARTP诱变的正突变率明显高于其他诱变手段,但对类胡萝卜素产量的提高则与其他方法相近。
从表1结果可以看出,酵母菌经过ARTP、NaNO2、紫外线、以及NaNO2-紫外线联合诱变之后,再一次利用ARTP诱变仍然能够得到17%的正突变率,因此具有进一步提升产量的可能和空间,但是产量提高的幅度很小,需要进一步研究诱变和筛选的条件。通过诱变选育,最终筛选获得的突变株编号K4,其生物量为(14.42±0.04)g/L,类胡萝卜素含量为(1.05±0.01)mg/g,类胡萝卜素产量为(15.14±0.12)mg/L。近年来,很多文献报道利用红酵母发酵生产类胡萝卜素,但是利用ARTP与传统诱变方法相结合诱变酵母菌选育高产类胡萝卜素菌株的研究却没有报道。Cutzu R等[16]通过对粘红酵母(Rhodotorula glutinis)菌株进行紫外诱变,突变株在优化后的培养基中类胡萝卜素产量最高为(14.07±1.45)mg/L;郑晓吉等[21]对天山红酵母BC-1的发酵培养条件进行优化后,类胡萝卜素产量最高为10.08 mg/L;Frengova GI等[22]报道的斯鲁菲亚红酵母(Rhodotorula slooffiae)的类胡萝卜素产量最高为2.67 mg/L。本实验通过诱变选育获得的突变株K 4的类胡萝卜素产量均高于上述报道,有很大的开发价值。与出发菌株KC 8相比,突变株K 4的生物量、类胡萝卜素含量及类胡萝卜素产量分别是出发菌株KC 8的1.44倍,1.21倍和1.75倍。
2.5遗传稳定性实验
为了考察菌株K 4的遗传稳定性,将其传代10次,取第0、2、4、6、8、10次传代的菌进行摇瓶发酵培养,测得其生物量、类胡萝卜素含量及类胡萝卜素产量,实验结果见表2。

表2 突变株K 4的遗传稳定性Table 2 The hereditary stability of mutant strain K 4
表2结果表明菌株K4传代10次,其生物量、类胡萝卜素含量及类胡萝卜素产量基本稳定,说明突变菌株K 4有良好的遗传稳定性。
2.6类胡萝卜素成分分析
利用β-胡萝卜素标准品作为对照,将制得的类胡萝卜素样品按照方法1.9中的色谱条件进行HPLC上样分析,色谱图结果如图5中A和B所示。

图7 菌株K 4产生的类胡萝卜素的高效液相色谱图Fig.7 The liquid chromatogram of β-carotene standard(A)and carotenoid of strain K 4(B)
由图7可知,β-胡萝卜素标准品的出峰时间和菌株K 4所产类胡萝卜素样品的主峰出峰时间基本一致,因此,从峰面积大小可以认定菌株所产类胡萝卜素主要成分为β-胡萝卜素。样品图谱中还有其它的峰,说明该类胡萝卜素样品还有其他组分,有待进一步对其成分进行分析。
3 结论
本试验通过对实验室保藏的红酵母进行初筛,得到一株类胡萝卜素产量较高的红酵母菌株KC 8,经鉴定为胶红酵母(R.Mucilaginosa),其类胡萝卜素产量为(8.67±0.07)mg/L,对菌株KC 8进行诱变选育,筛选获得一株高产类胡萝卜素的突变菌株K 4,类胡萝卜素产量为(15.14±0.12)mg/L,所产类胡萝卜素经HPLC检测表明主要成分为β-胡萝卜素。该菌株生长性能良好,遗传性状稳定,产类胡萝卜素能力较强,是一株具有开发前景的优良高产类胡萝卜素菌株。
今后的研究重点应放在进一步优化菌株K 4发酵培养条件以及类胡萝卜素的提取方法,寻找廉价的碳源替代葡萄糖,构建基因工程菌等方面,以提高菌株的类胡萝卜素产量,降低发酵成本,推进利用红酵母生产类胡萝卜素的工业化进程。
参考文献:
[1]Phadwal K.Carotenoid biosynthetic pathway:molecular phylogenies and evolutionary behavior of crt genes in eubacteria[J].Gene,2005, 345(1):35-43
[2]蒿洪欣,许园园,刘冬,等.降解类胡萝卜素产香细菌的筛选及鉴定[J].食品科学,2014(9):031
[3]丁东红,徐文静,牛春华,等.利用玉米浆发酵生产类胡萝卜素红酵母的诱变选育[J].食品研究与开发,2010,31(9):159-162
[4]张卉,李健,李波,等.高产类胡萝卜素酵母菌株LRY-01发酵条件的优化研究[J].工业微生物,2006,36(1):47-50
[5]Aksu Z,Eren AT.Production of carotenoids by the isolated yeast of Rhodotorula glutinis[J].Biochemical engineering journal,2007,35 (2):107-113
[6]Frengova GI,Beshkova DM.Carotenoids from Rhodotorula and Phaffia:yeasts of biotechnological importance[J].Journal of industrial microbiology&biotechnology,2009,36(2):163-180
[7]Nanou K,Roukas T,Kotzekidou P.Role of hydrolytic enzymes and oxidative stress in autolysis and morphology of Blakeslea trispora during β-carotene production in submerged fermentation[J].Applied microbiology and biotechnology,2007,74(2):447-453
[8]Chen B,Liu Z.Study on biosynthesis of carotenoid using Rhodotorula sp.8[J].Journal of Tsinghua University(Science and Technology), 1998,39(10):101-103
[9]王克明,王秋宇.流加发酵提高产胡萝卜素红酵母产量的研究[J].生物技术,1998,8(2):35-37
[10]梁晓华,杨莺莺,杨铿,等.海洋红酵母Y2发酵产类胡萝卜素条件的研究[J].中国微生态学杂志,2012,23(12):1068-1073
[11]何海燕,覃拥灵.粘红酵母胡萝卜素高产菌株的诱变选育[J].广西轻工业,2008,24(7):1-2
[12]蔡柏岩,接伟光,葛菁萍,等.黄檗根围丛枝菌根(AM)真菌的分离与分子鉴定[J].菌物学报,2008,27(6):884-893
[13]张杰,张晓东,许海朋,等.Cryptococcus curvatus O 3酵母菌培养及产油脂特性[J].微生物学通报,2009,36(1):41-45
[14]汪福源,许激扬,唐宁.诱变红酵母RY-17生物合成番茄红素的研究[J].药物生物技术,2006,12(6):375-378
[15]金丽华,方明月,张翀,等.常压室温等离子体快速诱变产油酵母的条件及其突变株的特性[J].生物工程学报,2011,27(3):461-467
[16]Cutzu R,Coi A,Rosso F,et al.From crude glycerol to carotenoids by using a Rhodotorula glutinis mutant[J].World Journal of Microbiology and Biotechnology,2013,29(6):1009-1017
[17]康富帅,颜兵,吕南拳,等.低嘌呤酿酒酵母的ARTP法诱变育种[J].现代食品科技,2014,30(2):188-191
[18]徐振杰,胡容,李珍,等.高产油脂红酵母的选育及培养条件优化[J].食品科学,2011,32(11):209-215
[19]何建华,蒋玮,吕贝贝,等.ARTP诱变筛选草菇优良菌株及RAPD分析[J].核农学报,2014,28(11):1950-1955.
[20]Zhang X,Zhang XF,Li HP,et al.Atmospheric and room temperature plasma(ARTP)as a new powerful mutagenesis tool[J].Applied microbiology and biotechnology,2014,98(12):5387-5396
[21]郑晓吉,陈周林,董娟,等.天山一号冰川红酵母BC-1发酵产类胡萝卜素培养条件优化[J].中国酿造,2013,32(2):89-91
[22]Frengova GI,Simova ED,Beshkova DM.Improvement of carotenoidsynthesizing yeast Rhodotorula slooffiae by chemical mutagenesis [J].Zeitschrift fur Naturforschung C,2004,59(1/2):99-103
DOI:10.3969/j.issn.1005-6521.2015.20.042
收稿日期:2015-02-13
基金项目:国家自然科学基金资助(NSFC 21277041);河南省高校科技创新团队资助(13IRTSTHN009)
作者简介:刘冬(1988—),男(汉),硕士研究生,研究方向:环境微生物。
*通信作者:杨清香(1966—),女(汉),博士,教授,研究方向:环境微生物。
Mutation Breeding of Yeast with High Carotenoids Production
LIU Dong1,WANG Pan-liang1,HAO Hong-xin1,YANG Qing-xiang1,2,*
(1.College of Life Sciences,Henan Normal University,Xinxiang 453007,Henan,China;2.Key Laboratory for Microorganisms and Functional Molecules,Henan Normal University,Xinxiang 453007,Henan,China)
Abstract:One yeast strain(KC 8)from 12 was selected and identified due to relatively high biomass and high production of carotenoids(8.67 mg/L).Sequence of 26 S rDNA indicated that KC 8 had 100%identity with Rhodotorula mucilaginosa.Using KC 8 as a starting strain,a series of mutation methods,ARTP,NaNO2,UV light,combination of NaNO2and UV light were applied to increase the carotenoids production.Finally,K 4 was obtained from 1 000 strains of screening.The yield of carotenoids by K 4 was 15.14 mg/L,which was 1.75 times of the starting strain,KC 8.High performance liquid chromatography(HPLC)analysis indicated that the main component of carotenoids was β-carotene.
Key words:Rhodotorula;carotenoids;identification;mutation
