微生物培养基中U(Ⅵ)和U(Ⅳ)测定方法的建立及稳定性研究
2015-07-17刘小玲陈晓明阮晨许燕王超廖祥
刘小玲+陈晓明+阮晨+许燕+王+超+廖祥兵+宋收+罗学刚

摘 要 为了消除微生物培养基对U(Ⅵ)和U(Ⅳ)质量浓度测定的影响,建立微生物培养基中测定U(Ⅵ)和U(Ⅳ)质量浓度ρ的方法,优化了在稀盐酸体系中利用U(Ⅵ)制备U(Ⅳ)的条件:10 mg/L U(Ⅵ),锌粒用量12 g/L,反应时间180 min.通过测定ρ总U减去ρU(Ⅵ),计算出ρU(Ⅳ),建立了同时测量微生物培养基中ρU(Ⅵ)和ρU(Ⅳ)的分光光度法.微生物培养基对U(Ⅵ)和U(Ⅳ)有明显影响:LB和NA培养基对U(Ⅵ)的影响率分别为37.3%和47.9%;单组分中蛋白胨和牛肉膏对U(Ⅵ)的影响率较大,分别达到33.5%和19.7%;而U(Ⅵ)和U(Ⅳ)在TGY培养基中较稳定.采用该方法测量微生物培养基中ρU(Ⅵ)和ρU(Ⅳ),能消除微生物培养基对U的影响,且具有精密度高、操作简单等优点,能实现生物样品中ρU(Ⅵ)和ρU(Ⅳ)的快速测量.
关键词 U(Ⅳ)的制备;分光光度法;微生物培养基;U稳定性
中图分类号 O614.62 文献标识码 A 文章编号 1000-2537(2015)03-0022-07
随着核工业的发展,含U放射性废物不断进入环境中,对人类健康和生态环境造成威胁.地壳表层平均铀含量为3 μg/g[1].铀矿冶、核电站、核武器实验等含铀废水中,铀的质量浓度约为5 mg/L,远高于国家排放标准(0.05 mg/L),也远高于世界卫生组织(WHO)规定饮用水标准最高铀质量浓度50 μg/L [2-3].高浓度铀的放射性和化学毒性影响动物和人体肾脏和骨骼的正常功能[4],因此,U污染的环境修复问题已成为当前的研究热点.据报道微生物修复U污染比物理化学修复更具有显著优势[5].自然环境中,U有Ⅲ,Ⅳ,Ⅴ和Ⅵ 4种价态,U(Ⅲ)和U(V)不稳定,极易歧化,因此U(Ⅵ)和 U(Ⅳ)是两种最主要的价态[6].
因U易受环境中pH值、有机物、氧化还原条件等的影响,其化学形态在实际环境体系中可互相转化,增加了U价态分析的难度.
目前,微生物培养基中U(Ⅵ)和 U(Ⅳ)的测量方法为偶氮胂(Ⅲ)分光光度法[7-8].其原理是U(Ⅵ)和 U(Ⅳ)在酸性条件下与偶氮胂(Ⅲ)形成1∶1络合物,在特定波长处测其吸光度[9-10].但偶氮胂(Ⅲ)分光光度法在U(Ⅵ)和U(Ⅳ)质量浓度的测量过程中,忽略了微生物培养基对U的影响及U(Ⅳ)的不稳定性,而不能同时准确测量其中U(Ⅳ)的质量浓度.因此,为了深入研究微生物对U的氧化还原作用,有必要在微生物培养基中建立一种能同时测量U(Ⅵ)和U(Ⅳ)质量浓度的方法.
通过将U的多形态分析转为单一形态分析,即运用分光光度法,通过U的氧化还原,测量体系中U(Ⅵ)和总U的质量浓度ρ,ρ总U减去ρU(Ⅵ)得出ρU(Ⅳ),可消除培养基中U(Ⅳ)不稳定性及微生物培养基对其影响问题.U(Ⅳ)作为U(Ⅵ)的还原产物,也是氧化还原过程中的反应试剂,其制备方法包括还原剂还原法(金属还原剂、汞齐及合金还原剂、低价金属化合物)、电化学法、光催化法等[11].其中部分还原方法操作复杂、易受还原剂、催化剂及反应条件等的限制.因此需寻找一种操作过程简单、不易引入干扰物质,避免在HCl、HF、稀H2SO4、低浓度HClO4中U(Ⅵ)还原产物U(Ⅳ)的再氧化作用的U(Ⅳ)制备方法;再运用U的氧化还原过程建立U(Ⅵ)和U(Ⅳ)的分光光度法;通过该方法研究U(Ⅵ)和U(Ⅳ)在微生物培养基中的稳定性,为微生物固定U(Ⅵ)选用适合的培养基提供理论依据.
1 材料与方法
1.1 材料和试剂
TGY培养基(胰蛋白胨酵母葡萄糖培养基):胰蛋白胨5 g,酵母粉3 g,葡萄糖1 g,定容至1 000 mL,pH 7.0~7.2.
LB培养基(溶菌肉汤培养基):酵母粉5 g,蛋白胨10 g,氯化钠10 g,定容至1 000 mL,pH 7.2~7.4.
NA培养基(牛肉膏蛋白胨培养基):蛋白胨10 g,牛肉膏3 g,氯化钠5 g,定容至1 000 mL,pH 7.0.
1 000 mg/L U(Ⅵ)标准储备液:1.782 2 g醋酸双氧U(UO2(CH3COO)2·H2O上海谱振生物科技有限公司),溶解并定容至1 000 mL,摇匀,避光保存,其他各浓度U(Ⅵ)由此溶液稀释获得.
0.05%偶氮胂(Ⅲ)显色液(上海阿拉丁):偶氮胂(Ⅲ)0.05 g,定容至100 mL.
无砷锌粒(成都市科龙化工试剂厂).其他试剂均为国产分析纯.
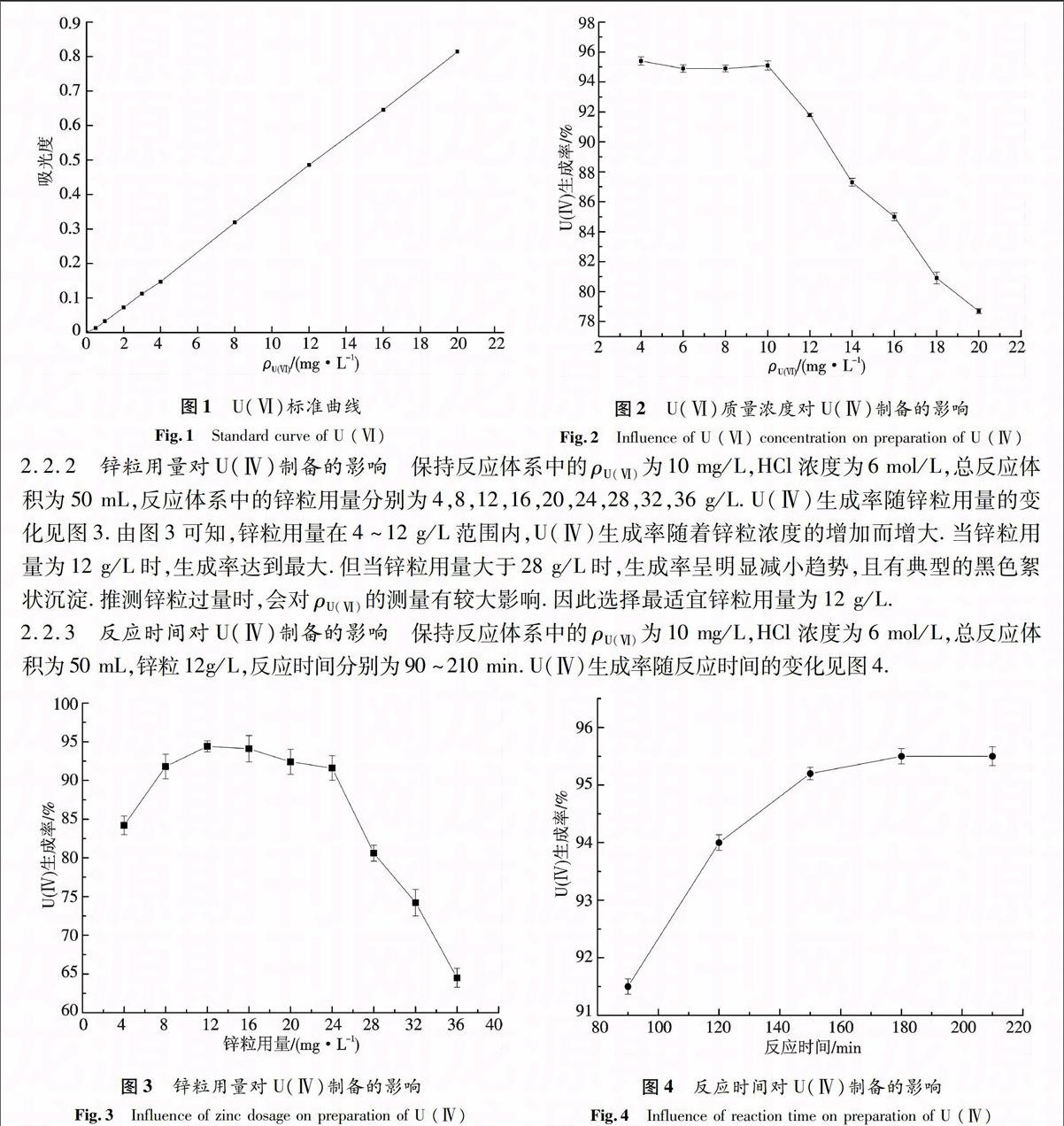
1.2 U(Ⅵ)标准曲线的制作
取1 000 mg/L U(Ⅵ) 2 mL,去离子水定容至50 mL,配制成40 mg/L U(Ⅵ),8支10 mL比色管,分别加入40 mg/L U(Ⅵ)0,0.2,0.4,0.6,0.8,1.0,1.5,2 mL,0.05%偶氮胂Ⅲ1 mL,缓冲液定容至10 mL,充分摇匀,静置30 min,于652 nm处测其吸光度.
1.3 U(Ⅳ)的制备方法优化
在6 mol/L HCl介质中,以锌粒为还原剂,考察U(Ⅵ)初始浓度、锌粒用量、反应时间等对U(Ⅳ)制备的影响,得出优化条件[12].最后测量溶液残留U(Ⅵ),考察U(Ⅳ)的生成率.
U(Ⅵ)的生成率(%)=ρ1-ρ2ρ1×100%,(1)
式中ρ1为U(Ⅵ)起点质量浓度,mg/L;ρ2为U(Ⅵ)残留质量浓度,mg/L.
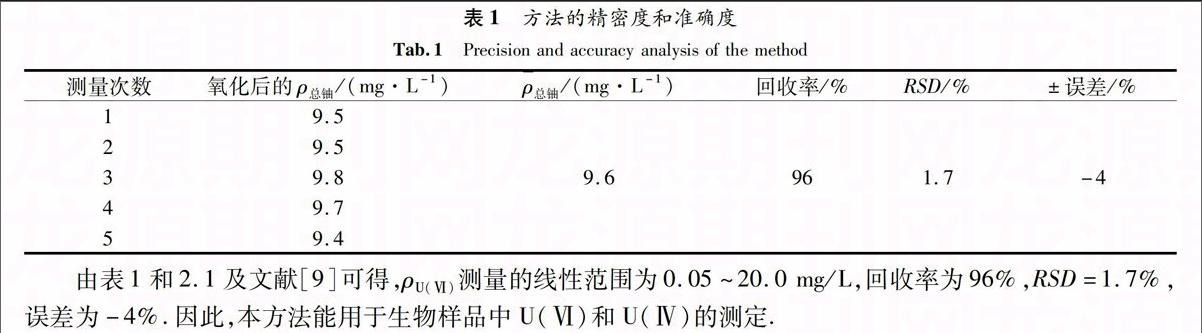
1.3.1 初始U(Ⅵ)质量浓度对U(Ⅳ)制备的影响 分别取1 000 mg/L U(Ⅵ) 0.2,0.3,0.4,0.5,0.6,0.7,0.8,0.9,1.0 mL于50 mL容量瓶中,加入6 mol/L HCl 45 mL,加入锌粒0.6 g,使其用量为12 g/L,定容.U(Ⅵ)最终分别为4,6,8,10,12,14,16,18,20 mg/L.
1.3.2 锌粒用量对U(Ⅳ)制备的影响 取1 000 mg/L U(Ⅵ) 0.5 mL于50 mL容量瓶中,加入6 mol/L HCl 45 mL,加入锌粒分别为0.2,0.4,0.6,0.8,1.0,1.2,1.4,1.6,1.8,2.0 g,定容.使锌粒用量分别为4,8,12,16,20,24,28,32,36 g/L.
1.3.3 反应时间对U(Ⅳ)制备的影响 取1 000 mg/L U(Ⅵ) 0.5 mL于50 mL容量瓶中,加入6 mol/L HCl 45 mL,加入锌粒使其用量为12 g/L,反应时间分别为90,120,150,180,210 min,定容.
1.4 微生物培养基中ρU(Ⅵ)和ρU(Ⅳ)测试方法的建立
1.4.1 微生物培养基中ρU(Ⅵ)和ρU(Ⅳ)分光光度法的建立 微生物培养基中U(Ⅳ)由于易受温度、空气中气体、体系中酸性介质等影响发生氧化,造成形态发生变化.在U(Ⅵ)和U(Ⅳ)的微生物培养基混合体系中,运用偶氮胂(Ⅲ)分光光度法先测量样品中ρU(Ⅵ),另取样品将U(Ⅳ)氧化成总U,利用ρ总U减去ρU(Ⅵ)得出ρU(Ⅳ),即整个研究过程中通过ρU(Ⅵ)和ρ总U定量ρU(Ⅳ),使多组分分析转换成单组分分析.该方法解决了微生物培养基对U的影响及U(Ⅳ)的不稳定性问题,能同时测量微生物培养基中ρU(Ⅵ)和ρU(Ⅳ).
偶氮胂(Ⅲ)分光光度法测试ρU(Ⅵ):取2 mL样品,1 mL 0.05%偶氮胂(Ⅲ)显色液,0.4 mol/L氯乙酸-0.4 mol/L氯乙酸钠缓冲液定容至10 mL,静置30 min,波长652 nm处测量其吸光度;偶氮胂(Ⅲ)分光光度法测试ρU(Ⅳ)则先测试样品中ρU(Ⅵ),另取2 mL样品采用1 mL浓硝酸加热赶酸,保持微沸状态,直到出现白色残渣为止,溶解并定容至5 mL.用偶氮胂(Ⅲ)分光光度法测试ρU(Ⅵ),此为ρ总U.含U混合体系中ρU(Ⅳ)由两者的差值得出.ρU(Ⅳ)按式(2)计算:
ρU(Ⅳ)=ρ总U-ρU(Ⅵ).(2)
式中 ρU(Ⅳ)为U(Ⅳ)质量浓度,mg/L;ρ总U为总U质量浓度,mg/L;ρU(Ⅵ) 为U(Ⅵ)质量浓度,mg/L.
1.4.2 浓硝酸用量对U(Ⅳ)氧化率的影响 取10 mg/L U(Ⅳ)25 mL于容量瓶中,TGY培养基定容至50 mL.分别加入0,0.5,1.0,1.5,2.0,2.5,3.0 mL浓硝酸对2 mL培养基中的U(Ⅳ)进行氧化,反应完成后偶氮胂(Ⅲ)分光光度法测量ρU(Ⅵ),即ρ总U.考察浓硝酸用量对U(Ⅳ)氧化率的影响,U(Ⅳ)的氧化率按式(3)计算:
氧化率(%)U(Ⅳ)=ρU(Ⅵ)ρ总U×100%.(3)
式中ρU(Ⅵ)为U(Ⅵ)质量浓度,mg/L;ρ总U为总U质量浓度,mg/L.
1.5 U在培养基中的稳定性研究
1.5.1 U(Ⅵ)在TGY,LB,NA培养基中的稳定性研究 取过滤除菌1 000 mg/L U(Ⅵ) 1 mL,分别加入至已灭菌的99 mL NA,LB,TGY的液体培养基中,得到最终10 mg/L U(Ⅵ).30 ℃,120 r/min,震荡60 h,间隔12 h 取样,测量微生物培养基对U(Ⅵ)的影响率.微生物培养基对U(Ⅵ)的影响率按式(4)计算:
影响率(%)=ρ1-ρ2ρ1×100%.(4)
式中ρ1为U(Ⅵ)起点质量浓度,mg/L;ρ2为U(Ⅵ)残留质量浓度,mg/L.
1.5.2 培养基单组分对U(Ⅵ)稳定性的影响 按单组分在微生物培养基中的比例,即3 g/L酵母粉,10 g/L 蛋白胨,3 g/L牛肉膏,5 g/L胰蛋白胨,1 g/L葡萄糖,10 g/L氯化钠的液体培养基中加入过滤除菌的1 000 mg/L U(Ⅵ) 1 mL,得到最终10 mg/L U(Ⅵ).30 ℃,120 r/min,震荡60 h,间隔12 h取样,考察培养基单组分对U(Ⅵ)的影响.
1.5.3 U(Ⅳ)在TGY培养基中的稳定性研究 等体积混合过滤除菌的10 mg/L U(Ⅳ)与灭菌TGY培养基, 30 ℃,120 r/min,震荡60 h,间隔12 h取样.含U混合体系中,测量2 mL样品中ρU(Ⅵ),另取2 mL样品加入1 mL浓硝酸将其中U(Ⅳ)硝化为总U,测ρ总U,ρU(Ⅵ),计算出ρU(Ⅳ),考察TGY培养基中U(Ⅳ)的稳定性.
2 结果与讨论
2.1 U(Ⅵ)标准曲线的制作
以U(Ⅵ)质量浓度为横坐标,吸光度为纵坐标,拟合后得到U(Ⅵ)标准曲线,结果如图1所示.可知标准曲线方程y=0.040x-0.007,R2=0.999,在ρU=0.0~20.0 mg/L范围内,吸光度-ρU关系符合比尔定律.
2.2 U(Ⅳ)的制备方法优化
2.2.1 ρU(Ⅵ)对U(Ⅳ)制备的影响 保持反应体系中的ρU(Ⅵ)分别为4,6,8,10,12,14,16,18,20 mg/L,HCl浓度6 mol/L,锌粒12 g/L,总反应体积为50 mL.U(Ⅳ)生成率随U(Ⅵ)初始浓度的变化见图2.由图2可知,在4~10 mg/L U(Ⅵ)终浓度范围内,U(Ⅳ)生成率随着ρU(Ⅵ)的增大保持稳定状态,达到95%左右.但ρU(Ⅵ)为10~20 mg/L时,U(Ⅳ)生成率随着ρU(Ⅵ)的增加,生成率急剧下降.因此,选择最适ρU(Ⅵ)为10 mg/L.
2.2.2 锌粒用量对U(Ⅳ)制备的影响 保持反应体系中的ρU(Ⅵ)为10 mg/L,HCl浓度为6 mol/L,总反应体积为50 mL,反应体系中的锌粒用量分别为4,8,12,16,20,24,28,32,36 g/L.U(Ⅳ)生成率随锌粒用量的变化见图3.由图3可知,锌粒用量在4~12 g/L范围内,U(Ⅳ)生成率随着锌粒浓度的增加而增大.当锌粒用量为12 g/L时,生成率达到最大.但当锌粒用量大于28 g/L时,生成率呈明显减小趋势,且有典型的黑色絮状沉淀.推测锌粒过量时,会对ρU(Ⅵ)的测量有较大影响.因此选择最适宜锌粒用量为12 g/L.
