例谈中考化学新型计算题
2015-07-13王廷虎
王廷虎


新的课程标准,对化学计算的要求虽降低了,但对学生的综合计算能力却提出了更高的要求,与此相适应的是在近几年来的全国各地中考中,频频出现了一类能够体现新课程理念的新型计算题,这些计算题较好考查了学生的知识迁移能力、科学探究能力、实验能力和创新精神等,着力体现中考化学的命题由知识立意向能力立意的转变。
一、图像型计算题
例1(2014·烟台)某兴趣小组在实验室发现一瓶敞口久置的氢氧化钠和一瓶未标浓度的稀盐酸。为测定氢氧化钠的变质情况和稀盐酸的浓度,他们取9.3g变质的氢氧化钠样品于锥形瓶中,加入50g水,充分溶解,再向锥形瓶中滴加未知浓度的稀盐酸。实验测得加入稀盐酸的质量与锥形瓶中物质的质量关系如图1所示。
图1求:(1)9.3g样品中碳酸钠的质量。
(2)未知浓度的稀盐酸的溶质质量分数。
解析这是一道图像型综合计算题。氢氧化钠会吸收空气中的二氧化碳而生成碳酸钠,碳酸钠与盐酸反应生成CO2气体会造成物质的总质量减少。由图中的质量关系图可知:产生CO2的质量是(9.3g+50g+50g)-107.1g=2.2g。设9.3g样品中Na2CO3的质量为x,与Na2CO3反应的HCl的质量为y,与NaOH反应的HCl的质量为z。
Na2CO3+2HCl2NaCl+H2O+CO2 ↑
106 73 44
x y 2.2g
106∶44=x∶2.2g 解得,x=5.3g
73∶44=y∶2.2g 解得,y=3.65g
NaOH+HClNaCl+H2O
40 36.5
(9.3g-5.3g) z
40∶36.5=(9.3g-5.3g)∶z
解得,z=3.65 g
稀盐酸中溶质的质量分数为:
(3.65g+3.65g)/50g×100%=14.6%
答案:(1)5.3 g(2)14.6%
点评本题作为一道图像计算题,关键是根据图像中的数据确定反应产生二氧化碳的质量,并以此作为解题的突破口。
二、表格型计算题
例2(2014·娄底)硅钢是变压器、充电器中的核心材料,其主要成份是Fe和Si。某学生用硅钢样品做了如下实验:取4.2g硅钢样品,将60g稀硫酸分6次加入样品中(其中稀硫酸与硅及其它杂质不反应),充分反应后过滤、洗涤、干燥、称重,得到的实验数据如下:
稀硫酸的用量剩余固体的质量
第一次加入10g m g
第二次加入10g 2.8g
第三次加入10g 2.1g
第四次加入10g 1.4g
第五次加入10g 0.7g
第六次加入10g 0.7g
(1)从以上数据可知,稀硫酸加入第次充分反应后,铁恰好完全反应。
(2)表格中m=。
(3)计算所用稀硫酸中溶质的质量分数。
解析本题是一道将化学实验数据与计算结合在一起的计算题,着重考查学生对表格中数据的处理能力。
(1)分析表格中的数据,当第五次加入10g稀硫酸后剩余固体的质量不再改变,即铁已完全反应。
(2)对比第二、三、四次数据可知,10g稀硫酸要完全反应需要的固体(铁的质量)为0.7g,因此m=4.2g-0.7g=3.5g。
(3)设10g稀硫酸中所含H2SO4的质量为x。
Fe+H2SO4FeSO4+H2↑
56 98
0.7g x
x=1.225 g
稀硫酸中溶质的质量分数为:w=1.225g/10g×100%=12.25%
答案:(1)5 (2)3.5g (3)12.25%
点评在解表格型计算题时,要注意观察分析表格中数据的变化,运用对比归纳法来发现规律,寻找到计算的突破口,从而顺利解决问题。
三、杂质型计算题
例3(2014·内江)赤铁矿的主要成分为Fe2O3,可用于冶炼铁。我市某地出产一种赤铁矿,其中Fe2O3的质量分数为64%,试回答下列问题:
(1)Fe2O3中铁元素的质量分数为。
(2)100吨该赤铁矿中含铁元素的质量为吨,经过充分冶炼,最多可生产含铁96%的生铁吨(最后一空保留两位小数)。
解析本题以一道含有杂质的物质根据化学方程式的计算。
(1)Fe2O3中铁元素的质量分数为:
w=56×256×2+16×3×100%=70%
(2)100吨该赤铁矿中含铁元素的质量m=100t×64%×70%=44.8t;设生产含铁96%的生铁的质量为x。
Fe2O3+3CO高温2Fe+3CO2
160 112
100t×64% x×96%
160100t×64%=112x×96%
解得,x=46.67t
答案:(1)70% (2)44.8 46.67
点评代入化学方程式计算的量必须是纯净物质的质量,因此含有杂质的物质根据化学方程式计算时,一定要将不纯物质的质量换算成纯净物质的质量。
四、图片型计算题
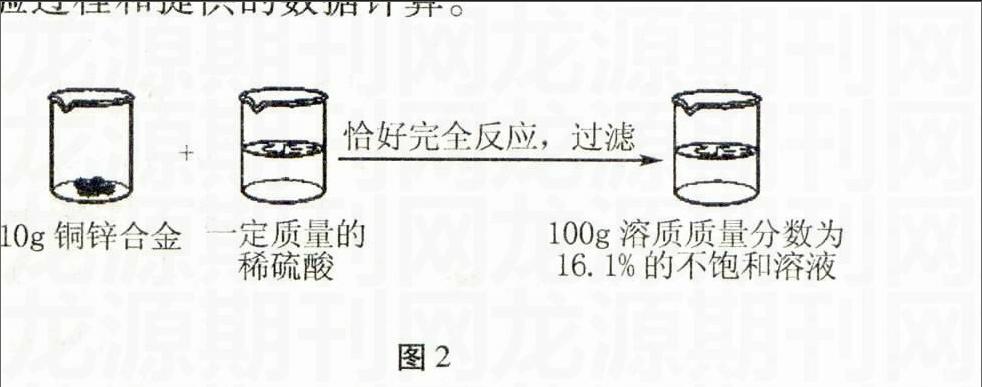
例4(2014·达州)请根据如图2所示的实验过程和提供的数据计算。
图2
(1)生成氢气g;
(2)合金中铜的质量分数是;
(3)所用稀硫酸的溶质质量分数是多少?(计算结果保留到0.1%)
解析本题主要根据图片中所提供的信息来考查根据化学方程式的计算。
(1)设反应生成氢气的质量为x,锌的质量为y,硫酸的质量为z。
Zn+H2SO4ZnSO4+H2↑
65 98 161 2
y z100g×16.1% x
65y=98z=161100g×16.1%=2x
解得,x=0.2g,y=6.5g,z=9.8g
(2)合金中铜的质量分数为:10g-6.5g10g×100%=35%
(3)设稀硫酸的质量为m。
6.5g+m-0.2g=100g
解得,m=93.7g
所用稀硫酸的溶质质量分数:w=9.8g93.7g×100%=10.5%
答案:(1)0.2 (2)35% (3)10.5%
本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性
点评根据图片中的信息,利用质量守恒定律,可确定反应前稀硫酸的质量。
五、标签型计算题
图3
例5(2014·宿迁)某补钙药剂的标签主要内容如图3所示,现测定该钙片含量是否符合标注,做如下实验:取10片该钙片,放入干燥、洁净的烧杯中,再向烧杯中加入50g某浓度稀盐酸,恰好完全反应(钙片中其他成分不溶于水,也不和稀盐酸反应,反应中产生的气体全部放出),反应后称量烧杯内剩余物质的质量为64.5g.
(1)反应中生成g二氧化碳,此反应的基本反应类型为;
(2)通过计算说明实际钙含量是否与标注相符;
(3)试计算所用稀盐酸的溶质质量分数。
解析本题是一道根据商品标签中所提供的信息来考查根据化学方程式的计算题。(1)因为碳酸钙和稀盐酸反应放出二氧化碳,根据质量守恒定律可知,烧杯中的物质减少的质量就是反应生成的二氧化碳的质量,所以反应生成二氧化碳的质量为:2g×10+50g-64.5g=5.5g,该反应为复分解反应。
(2)设10片片剂中碳酸钙的质量为x,消耗盐酸中的氯化氢质量为y。
CaCO3+2HClCaCl2+H2O+CO2↑
100 73 44
x y 5.5g
100x=445.5 g解得,x=12.5 g
73y=445.5 g解得,y=9.125 g
每片中钙含量是12.5g×40100÷10片=0.5g<0.6g,实际钙含量与标注不相符。
(3)所用稀盐酸的溶质质量分数:
w=9.125 g50 g×100%=18.25%
答案:(1)5.5 复分解反应 (2)不相符 (3)18.25%
点评根据标签中的信息,确定反应前后物质的质量差,求出产生二氧化碳气体的质量是解答本题的关键。
六、实验型计算题
图4
例6(2014·雅安)某化学小组为测定一瓶失去标签的盐酸的溶质质量分数,分成甲、乙两组,分别用不同的方法进行测定。
【实验设计】
甲组取纯净碳酸钙粉末5g于烧杯中,加入20g该盐酸溶液,充分反应后,过滤、洗涤、干燥,称量得剩余固体3g。
乙组取纯净碳酸钙粉末5g于锥形瓶中,将20g该盐酸溶液加入分液漏斗,利用测定产生二氧化碳的体积(20℃、标准大气压)计算盐酸浓度。装置如图4所示。
【数据处理】
(1)请利用甲组数据计算该盐酸的溶质质量分数。(写出计算过程)
(2)乙组计算结果略小于甲组。经过多次实验仍得到相同结果(忽略量筒引起的误差),可能的原因是。
解析本题是一道实验型计算题,主要考查学生对实验数据的分析能力、化学计算能力和科学探究能力。(1)设参加反应的HCl质量为x,消耗碳酸钙质量为5g-3g=2g。
CaCO3+2HClCaCl2+H2O+CO2↑
100 73
2g x
109∶73=2g∶x解得,x=1.46g
盐酸中溶质的质量分数:
w=1.46g/20g×100%=7.3%
(2)甲组根据碳酸钙的质量求盐酸中的质量,误差较小,而乙组实验生成的二氧化碳无法将同体积的水压入量筒中,导致测量结果偏低。
答案:(1)7.3%(2)测量的水的体积小于生成气体的体积;B、C之间的导管内实验前无水,实验后有水;内外气压相同时,二氧化碳无法将相应体积的水压入量筒;二氧化碳可能溶解在A反应后的溶液中(其他合理答案均可)
点评乙组实验中量筒中收集到水的体积要比反应实际生成的二氧化碳气体的体积小,从而导致计算结果偏低。
(收稿日期:2014-07-15)
