耐盐Bacillus sp.9BS 的筛选及其对染料的脱色效果
2015-07-13汪春蕾田菲张月颖孙鹤敏李启育张凯鑫
汪春蕾,田菲,张月颖,孙鹤敏,李启育,张凯鑫
(东北林业大学生命科学学院,黑龙江 哈尔滨 150040)
染料的分子结构稳定,不易被降解,成分复杂,酸碱性强,大多数具有芳环,已成为当前最难处理的水体污染源之一。中国每年生产染料15万t 左右,其中有10%~15%排放到环境中,染料废水已严重危害着人们的健康[1]。对废水进行物理和化学处理因费用较高、耗时较长、容易产生二次污染而受到限制[2]。对废水进行生物处理的环境相容性好,所以,生物处理废水已成为了研究的热点。漆酶(EC 1.10.3.2 p–diphenol: dioxygen oxidoreductases)是一种含铜的多酚氧化酶,可对氧化酚类和芳香族化合物进行催化,并将分子氧还原成水[3–4]。漆酶的底物种类十分广泛,在工业生产、生物技术领域及废水治理方面都有着很好的应用前景。漆酶在自然界中广泛分布于植物、真菌和细菌中,但目前只有真菌漆酶被广泛应用于工业生产中[5]。自然界中的白腐菌是高效的产漆酶真菌,许多真菌漆酶已经被分离和鉴定[6]。关于细菌漆酶的研究较少。尽管细菌漆酶的产率和氧化还原电势均比真菌漆酶的低[7–8],但与真菌漆酶相比,细菌漆酶在工业应用中具有很多优点。大多数细菌漆酶都有很好的耐热性和耐碱性[9],而真菌漆酶在高温或极端条件下会迅速失去活性[6]。笔者从东北林业大学实验林场白桦林下的土壤中筛选出1 株耐盐高产漆酶的芽孢杆菌属细菌,并对其生长特性及其对常用纺织染料的脱色效果进行了研究,现将结果报道如下。
1 材料与方法
1.1 材料
1.1.1 土壤样品
土壤样品采自东北林业大学实验林场白桦林下。
1.1.2 主要试剂与培养基
主要试剂Taq DNA polymerase、B 型小量DNA片段快速胶回收试剂盒、溶菌酶和E.coli JM109 为北京TIANGEN 公司产品;DNA Marker DL2 000、dNTP(2.5 mmol/L)、pMD18–T 载体为TaKaRa 公司产品;Tryptone、Yeast extract 为Oxoid 公司产品;琼脂糖、EDTA、Tris–base 和SDS 是Amresco 公司产品;氨苄青霉素、丁香醛连氮(Syringaldazine)、结晶紫(CV)、靛红(IC)、活性黑(RB5)和活性亮蓝(RBBR)为Sigma 公司产品;其他常规试剂均为国产,分析纯。
LB 培养基中Tryptone、Yeast extract 、NaCl、Agar 的质量分数分别为 10、5、10、17g/L,pH 为7.0。富集培养基中葡萄糖、Na2HPO4·7H2O、KH2PO4、NaCl、NH4Cl 的质量分数分别为4、12.8、3、0.5、1g/L。
1.2 方法
1.2.1 产漆酶菌株的筛选与纯化
菌株筛选与定性检测方法参照文献[10]。通过定性检测得到对丁香醛连氮显红色的单个菌落。将所得到的菌落划线接种于含0.4 mmol/L Cu2+的LB培养基上,37℃培养3 d,并用1 mmol/L 丁香醛连氮溶液检测单个菌落是否具有漆酶活性。重复上述操作2 ~3次。选取显色较深红的1 株进行后续研究。
1.2.2 所选取菌株的形态学及生理生化特性测定
对菌株进行革兰氏染色,并测定其糖类发酵和明胶分解等方面的生理生化特性,测定方法参照文献[11]。
1.2.3 所选取菌株的16S rDNA 序列测定及系统发育树构建
用SDS 法提取菌株的总DNA。以提取的菌株总DNA 为模板,利用16S rDNA 通用引物27F(5′–G AGTTTGATCMTGGCTCAG–3′,M=A+C)和1492R (5′–TACGGYTACCTTGTTACGACTT–3′,Y=C+T)[12]扩增菌株的16S rDNA 序列。引物由华大基因公司合成。
PCR 反应体系:2 μL10×Taq Buffer,1.6 μL dNTP,4 μL 上游引物(5 μmol/L),4 μL 下游引物(5 μmol/L),0.2 μL Taq DNA polymerase(3 U/μL),0.5 μL DNA 模板,以ddH2O 补至20 μL。反应条件为:93℃预变性5min,94℃变性18 s,56℃复性15 s,72℃延伸78 s,30次循环,72℃延伸7min,扩增产物经1.0%琼脂糖凝胶电泳检测。
以小量琼脂糖凝胶DNA 回收试剂盒回收PCR产物,将胶回收产物与pMD18–T 连接,将连接产物转化到E. coli JM109 感受态细胞中,37℃培养过夜。将用菌落PCR 鉴定为阳性的转化子送到华大基因公司进行测序。
将测定结果在NCBI 的BLAST 上搜索比对,利用Bioedit 软件进行多序列比对,用Phylip–3.69软件中的遗传距离法、Bootstrap 方法自展1 000次,构建该菌株的系统发育树。
1.2.4 所选菌株的生物学特性研究
研究温度、pH 值、盐浓度以及Cu2+对菌株生长特性的影响,取适量菌液接种于30mL LB 培养基中,分别让菌株在不同条件下生长,140 r/min 振荡培养14 h,在分光光度计下测量其OD600nm,重复测量3次,结果取平均值。
1.2.5 所选菌株的芽孢漆酶对染料脱色效果的研究
将菌株接种于含0.2 mmol/L Cu2+的LB 固体培养基中,37℃培养5 d,芽孢粗酶液的制备方法参照文献[13]。
以丁香醛连氮作为底物检测菌株芽孢漆酶的活性。反应条件:反应温度30℃,芽孢漆酶液10 μL, 0.2 mol/L 磷酸氢二钠–0.1 mol/L 柠檬酸缓冲液(pH 6.9) 2.9mL,1 mmol/L 的丁香醛连氮溶液0.3mL。以不加芽孢漆酶液的体系为空白对照。测定反应3min 时的OD525nm。重复测定3次。丁香醛连氮的摩尔吸光常数为65 000 L/(mol·cm)。一个酶活单位定义为1min 内氧化1 μmol 底物所需的酶量。
染料脱色体系:染料,芽孢漆酶液(终浓度为1mg/mL),0.2 mol/L Na2HPO4–0.1 mol/L 柠檬酸缓冲液(pH 7.0)。活性亮蓝、活性黑、靛红和结晶紫的终质量浓度分别为100、40、25、5mg/mL,最大吸收波长分别为591、597、610、583 nm。以不加芽孢漆酶液的体系为空白对照。脱色反应温度为40℃,160 r/min 脱色,定时取样,14 000 r/min 离心1min 后,用分光度计测定各种染料在其最大吸收波长处的吸光值,重复测定3次。染料脱色率的计算公式如下:染料的脱色率=(A0–A) /A0。A0为初始染料吸光值,A 为定期取样时测定的染料吸光值。
2 结果与分析
2.1 产漆酶菌株的筛选与纯化结果
将所采集的土壤样品用富集培养基培养,以漆酶的特异性底物丁香醛连氮对菌株进行初步鉴定,并利用Cu2+对菌株进行进一步的分离和纯化,逐步提高Cu2+的浓度,最终得到产漆酶的纯培养物,选取对丁香醛连氮显红色较深的1 株为研究菌株。
2.2 所选菌株的形态和生理生化特性
所选菌株经革兰氏染色后呈蓝紫色,为革兰氏阳性细菌,短杆状,有芽孢;使用LB 固体培养基,于 37℃培养24 h,观察到菌落呈扁平状,乳白色,表面干燥,菌落不透明,且正反面颜色一致。
所选菌株的生理生化特性见表1。该菌株能利用葡萄糖、蔗糖、果糖、甘露糖、阿拉伯糖和木糖作为碳源,且具有氧化酶的活性。

表1 所选菌株的生理生化特性 Table 1 Physiological-biochemical characteristics of the selected strain
2.3 所选菌株的16S rDNA 序列分析结果及系统发育树
所选菌株的16S rDNA PCR 结果见图1。由图1可见,16S rDNA 扩增条带清晰,测序得到的结果为1 452 bp。在NCBI 中使用Blast 软件进行同源性分析,结果表明,该菌株与多种芽孢杆菌的同源性达99%。参照此菌株形态学、生理生化特性以及16S rDNA 同源性比对结果,鉴定该菌株为芽孢杆菌属细菌,命名为Bacillus sp. 9BS。利用Bioedit 软件对菌株9BS 的16S rDNA 序列进行多序列比对,用Phyilp 软件中的遗传距离法构建该菌株的系统发育树(图2)。
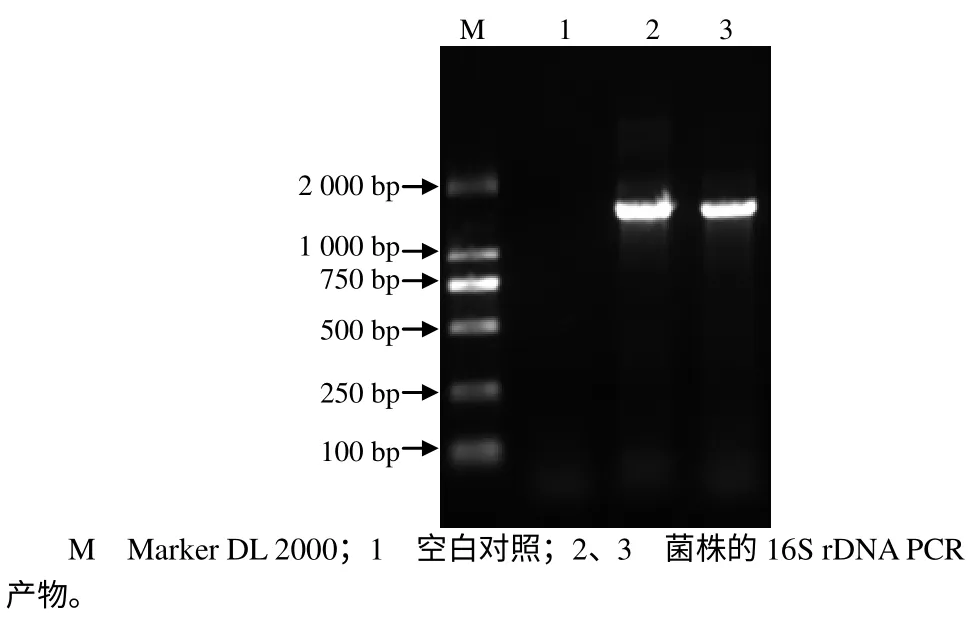
图1 所选菌株的16S rDNA PCR 结果 Fig.1 PCR result for 16S rDNA of the selected strain
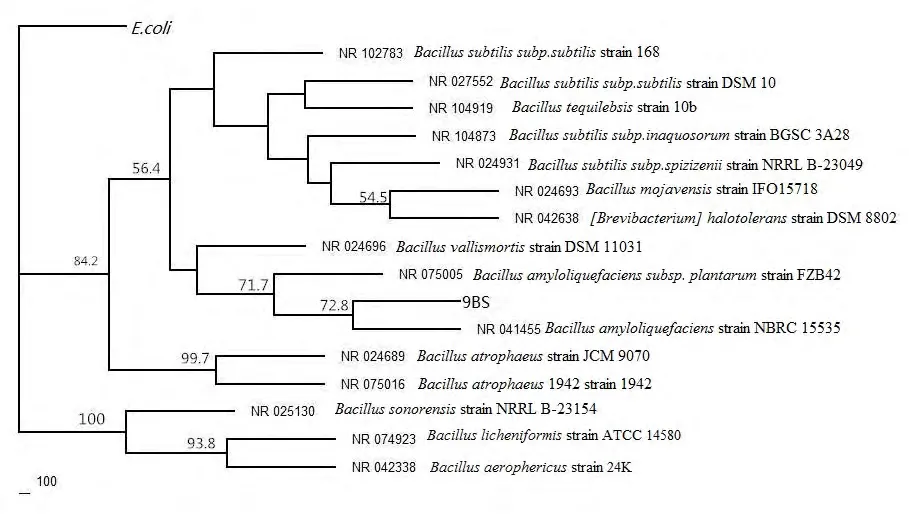
图2 根据16S rDNA 序列分析构建的菌株系统发育树 Fig.2 Phylogenetic analysis of 16S rDNA sequence of the selected strain
2.4 菌株9BS 的生长特性
菌株9BS 在25~42℃均能生长,其最适生长温度为37℃(图3)。菌株9BS 在pH 5.0~9.0 时生长良好,其最适生长pH 值为7.0(图4)。菌株9BS在7%NaCl 溶液中生长良好,NaCl 浓度高于9 %时菌株生长缓慢(图5),可见,菌株的耐盐性比较好。Cu2+浓度对菌株9BS 的生长影响较大,当培养基中含有0.2 mmol/L Cu2+时,菌株9BS 能够生长,随着Cu2+浓度的升高,其生长逐渐减慢(图6)。
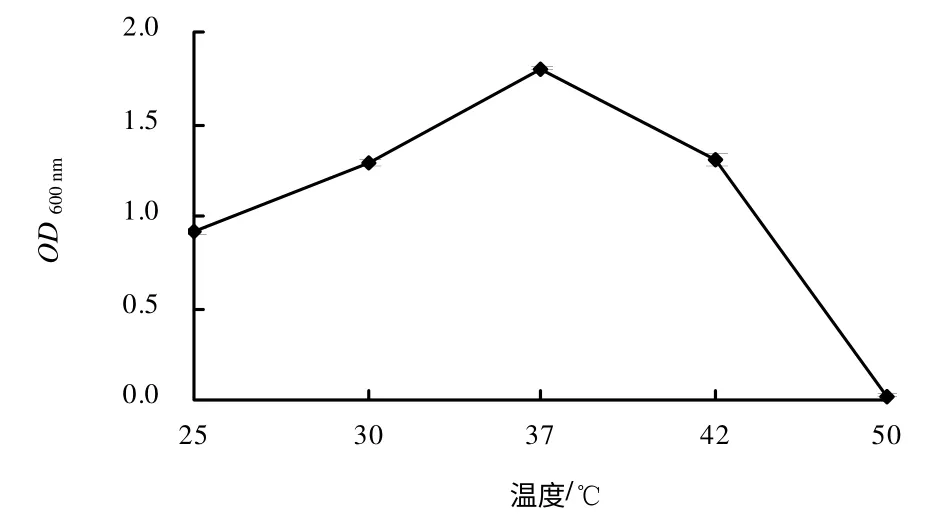
图3 不同温度下生长菌株的OD600 nm Fig.3 OD600 nm of strain 9BSgrown under different temperatures

图4 不同pH 下生长菌株的OD600 nm Fig.4 OD600 nm of strain 9BSgrown under different pH values
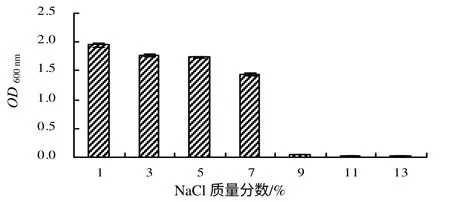
图5 不同浓度NaCl 下生长菌株的OD600 nm Fig.5 OD600 nm of strain 9BSgrown under different concentrations of NaCl
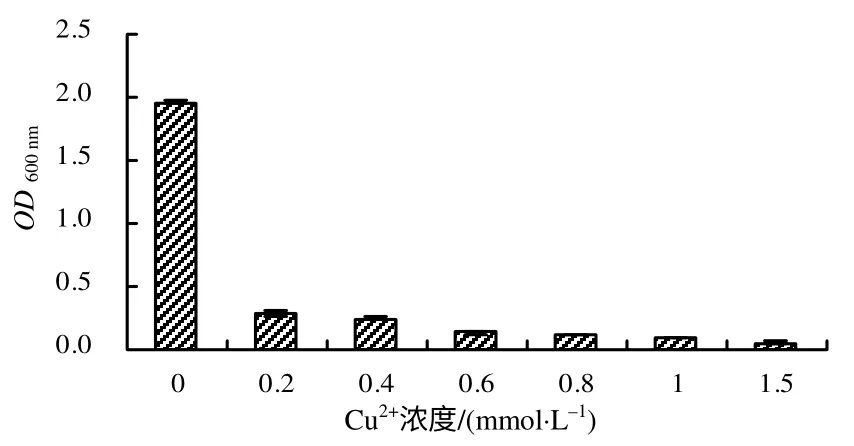
图6 不同浓度Cu2+下生长菌株的OD600 nm Fig.6 OD600 nm of strain 9BSgrown under different concentrations of Cu2+
2.5 菌株9BS 芽孢漆酶对染料脱色的效果
以丁香醛连氮为底物,以芽孢干重计算,菌株9BS 芽孢漆酶的活性为47.1 U/g。在pH6.9,不加介体的条件下,菌株9BS 芽孢漆酶6 h 对活性亮蓝、活性黑、靛红和结晶紫的脱色率分别为35.1%、47.6%、73.3%和82.2%,对靛红和结晶紫的脱色率较高(图7)。
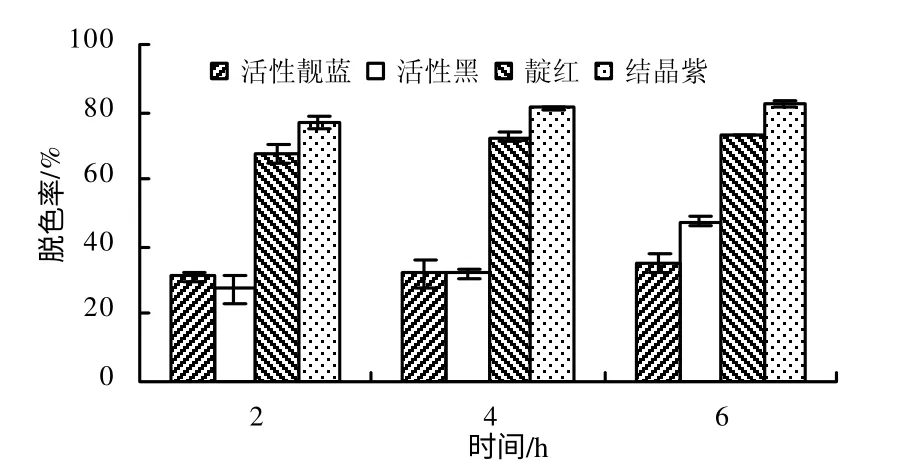
图7 菌株9BS 芽孢漆酶在不同时间对4 种染料的脱色率 Fig.7 Decolorizations of 4 dyes at different times with spore laccase from strain 9BS
3 结论与讨论
漆酶的活性中心由Cu2+组成,并且依赖Cu2+传递电子进行氧化还原反应。培养基中加入Cu2+可诱导漆酶的表达和提高漆酶活性[14–15]。本研究中利用含Cu2+的富集培养基从白桦林土壤中分离筛选出1 株具有漆酶活性的菌株9BS,并鉴定其为芽孢杆菌属的细菌。菌株9BS 可以在pH 5.0~9.0 的环境下生长,其芽孢漆酶的最适pH 值为7.0(真菌漆酶一般在pH 3.0~6.0 显示活性[6])。
芽孢杆菌属细菌的漆酶活性来源于芽孢外衣蛋白,芽孢产量对漆酶活性具有重要影响。在含Cu2+的LB 固体培养基上培养菌株9BS,5 d 芽孢产量达到最高,以芽孢干重计,芽孢漆酶的酶活性达47.1 U/g,比Bacillus sp. CLb 芽孢漆酶活性高1 U/g[10]。由于芽孢需要制成悬液来测定其漆酶的活性,所以,以芽孢干重为基础计算芽孢漆酶的活性,可以使不同细菌的芽孢漆酶之间具有可比性。
人工合成的染料已达到数千种[16],它们一旦进入自然环境中就很难被分解,并且许多染料对生物有毒害作用[17]。纺织业常用的染料依据其结构可分为漆酶底物类染料和非酶底物类染料。蒽醌类染料(如活性亮蓝)作为漆酶的底物可直接被氧化[18]。偶氮类(如活性黑)、靛青类(如靛红)和三苯甲烷类染料(如结晶紫)不是漆酶底物,不能被漆酶催化,但在还原介体,如乙酰丁香酮(ACE)和1–羟基苯并三唑(HBT)等存在下,可介导漆酶与非酶底物染料之间的氧化作用[19],增加对染料的脱色效果,菌株Bacillus sp. CLb 的芽孢漆酶在无介体参与下只能使活性亮蓝和结晶紫脱色,在介体乙酰丁香酮(ACE)的作用下,其芽孢漆酶对活性亮蓝、结晶紫、活性黑及靛红4 种染料的脱色率均超过了70%[10];云芝漆酶不能单独作用于靛蓝染料,需加入HBT 介体后才可以使靛蓝染料脱色[20]。虽然漆酶–介体体系中的介体可提高染料脱色率,但价格昂贵,有毒性,稳定性差,受pH 的影响大。菌株9BS 在不加介体的情况下能够使染料靛红(IC)和结晶紫(CV)在6 h 内的脱色率分别达到73.3%和82.2%,可见菌株9BS 的漆酶具有与经典漆酶(指真菌漆酶)不同的性质,能够在不加介体的情况下对靛蓝和三苯甲烷类染料脱色。菌株9BS 在含7%NaCl 的环境下能正常生长,表明其对盐具有很强的耐受性(印染工业的废水具有很高的盐浓度),所以,菌株9BS 的芽孢漆酶具有处理印染废水的潜力。
综合分析本研究结果,认为在东北林业大学实验林场白桦林土壤中分离出的菌株9BS 具有很好的耐盐特性,其芽孢漆酶具有较高的活性,在不加介体的情况下能够使靛红和结晶紫脱色,在印染废水的生物处理中具有一定的潜力。
[1] Pandey A,Singh P,Iyengar L.Bacterial decolorization and degradation of azo dyes[J].International Biode- terioration and Biodegradation,2007,59(2):73–84.
[2] 杨曦,余刚,孔令仁,等.酸性红3B 的杂多酸光催化降解动力学[J].环境科学,2002,23(3):40–43.
[3] Giardina P,Faraco V,Pezzella C,et al.Laccases:A never-ending story[J].Cell Mol Life Sci,2010,67:369–385.
[4] Thurston C F.The structure and function of fungal laccases[J].Microbiology,1994,140(1):19–26.
[5] Rodriguez C S,Toca H J L.Industrial and biotech- nological applications of laccases : A review[J]. Biotechnol,2006,24:500–513.
[6] Baldrian P F.Laccases-occurrence and Properties[J]. FEMS Microbiol,2006,30:215–242.
[7] Dube E,Shereck F,Hurtubise Y,et al.Decolourization of recalcitrant dyes with a laccase from Streptomyces coelicolor under alkaline conditions[J].Ind Microbiol Biotechnol,2008,35:1123–1129.
[8] Brissos V,Pereira L,Munteanu F D,et al.Expression system of CotA-laccase for directed evolution and high-throughput screening for the oxidation of high- redox potential dyes[J].Biotechnol,2009(4):558–563.
[9] Sharma P,Goel R,Capalash N.Bacterial laccases[J]. World Journal Microbiology and Biotechnology,2007,23(6):823–832.
[10] 李凡姝,刘海洋,戴绍军,等.高产漆酶菌株Bacillus sp.CLb 的筛选及其对染料脱色效果的研究[J].安徽农业科学,2014,42(6):1614–1616,1654.
[11] 东秀珠,蔡妙英.常见细菌系统鉴定手册[K].北京:科学出版社,2001:364–399.
[12] 王远亮,杨瑞红,毛爱军,等.采用未培养技术对荷斯坦奶牛瘤胃细菌多样性进行初步分析[J].微生物学报,2005,45(6):915–919.
[13] Goldman R C,Tipper D J.Bacillus subtilis spore coats:Complexity and purification of an unique polypeptide component[J].Biotechnology,1978,135(3):1091–1106.
[14] Malhotra K,Sharma P,Capalash N.Copper and dyes enhance laccase production in γ-proteobacterium JB[J].Biotechnology Letters,2004,26(13):1047–1050.
[15] Niladevi K N,Prema P.Effect of inducer and process parameters on laccase production by Streptomyce psammoticus and its application in dye decolourization [J].Bioresources Technology,2008,99(11):4538–4589.
[16] Kudanga T,Nyanhongo G S,Guebitz G M,et al. Potential applications of laccase-mediated coupling andgrafting reactions:A review[J].Enzyme and Microbial Technology,2011,48:195–208.
[17] Chequer F M D,Angeli J P F,Ferraz E R A,et al.The azo dyes disperse red 1 and disperse orange 1 increase the micronuclei frequencies in human lymphocytes and in HepG2 cells[J].Mutation Research-Genetic Toxicology and Environmental Mutagenesis,2009,676(1):83–86.
[18] Wong Y,Yu J.Laccase-catalyzed decolorization of synthetic dyes[J].Water Res,1999,33:3512–3520.
[19] Campos R,Kandelbauer A,Robra K H,et al.Indigo degradation with purified laccases from Trametes hirsute and Sclerotium rolfsii[J].Journal of Biotechnology,2001,89:131–139.
[20] 高恩丽,仲伟佳,付小兰,等.云芝漆酶对靛蓝废水脱色降解研究[J].安徽农业科学,2012,40(33):16322–16323.
