针刺“头四关穴”对脑缺血再灌注家兔Bcl-2、c-fos 和Caspase-3 蛋白表达的影响*
2015-07-11刘睿菲
赵 军,刘睿菲
(1.黑龙江中医药大学附属第一医院,黑龙江 哈尔滨150040;2.黑龙江中医药大学,黑龙江 哈尔滨150040)
近年来实验研究表明针刺对脑缺血再灌注损伤具有显著的保护作用,其机制与抗氧自由基、调节血管内皮损伤修复网络功能有关[1-3]。“头四关穴”是双侧太阳穴和风池穴的总称,是临床上针刺治疗脑血管疾病的常用穴位。前期的实验结果显示,电针“头四关穴”能够增加脑中HSP70 蛋白的表达,减少神经细胞凋亡,从而对脑缺血再灌注损伤家兔起到神经保护作用。为进一步探讨其对神经细胞的保护机制,笔者进行如下研究。
1 材料和方法
1.1 实验动物及分组
健康雄性新西兰白兔,清洁级,4 ~5 月龄,体重2.5 ~3.0 kg,由黑龙江中医药大学实验动物中心提供。随机分为3 组: 为假手术组、模型组和针刺组,每组又随机分为1 天、3 天和7 天3 个时间点。所有动物自由进食和水,12 h 昼夜节律喂养。
1.2 主要试剂及仪器
Bcl-2、c-fos 和Caspase-3 免疫组化一抗,购自武汉博士德生物工程有限公司; PV 二步法试剂和DAB 显色剂,购自北京中杉金桥生物公司; 其它为国产分析纯。
德国菜卡2135 型组织切片机; 美国motic 公司moticam3000 显微摄影成像系统; Image- pro plus6.0病理图像分析系统;上海安亭台式离心机。
1.3 动物模型的制备
参考相关文献[4],采用线栓法建立家兔局灶脑缺血再灌注损伤模型。先将直径0.285 mm 的3 号尼龙线剪成10 cm 长,在距一端0.5 ~1.0 cm 处,均匀涂上硅橡胶,控制线栓头端直径在0.51 ~0.55 mm 左右,并在距离线栓头端6.0 cm 处做标记。
家兔术前禁食12 h,称重后自耳缘静脉缓慢注射20 g/L 的乌拉坦(5 ml/kg) 麻醉,常规消毒后颈部正中切口,暴露出左侧颈总动脉( CCA) 及分叉,并分离出近段颈外动脉( ECA) 和颈内动脉( ICA) 。暂时夹闭CCA 和ICA,结扎ECA 并于近端将其剪断,将线栓经ECA 残端向ICA 内缓缓送入,松开ICA 动脉夹。当线栓进入大脑中动脉( MCA) 起始部遇阻力时停止,记录造成大脑中动脉闭塞( MCAO) 时间。记算线栓插入深度,并将ECA 残端及线栓一同结扎固定。再灌注时,用镊子夹住线栓外露残端轻轻向外拉出,遇到明显阻力感停止牵拉,记录时间作为再灌注开始时间。结扎颈内动脉,彻底止血后缝合切口。
假手术组家兔除不栓塞大脑中动脉外,余处理同模型组和针刺组。参照文献[5]中的评分法,0 分:无神经缺损症状;1 分: 右前肢屈曲;2 分: 向右旋转;3 分:向右倾倒;4 分: 不能行走或昏迷。1 ~4 分为有效模型,纳入实验分组。
1.4 干预方法
参考实验针灸学[6],选取家兔“头四关穴”: 双侧太阳穴和风池穴。用1.5 寸毫针,太阳穴水平向后斜刺,进针深度5 mm,风池穴向后下方斜刺,深度5 mm。双侧太阳及双侧风池穴连接电针仪,频率2 Hz,连续波,刺激强度以针柄震颤且家兔安静不挣扎为度,治疗时间为30 min。针刺组在造模成功后6 h 开始首次针刺,各时间点疗程分别为1 天、3 天和7 天,每日1 次。假手术组和模型组家兔除不针刺外,每天同样抓取。
1.5 指标检测
各组家免于相应时间点乌拉坦(5 ml/kg) 麻醉后,心脏取血分离血清。然后用4%的多聚甲醛PBS 液进行心脏灌注固定后取脑,自视交叉向前后各取2.5 mm厚的冠状脑片,常规石蜡包埋,连续切片备用。
免疫组化PV 二步法检测脑组织Bcl-2、c-fos 和Caspase-3 蛋白表达,严格按说明书进行操作。免疫组化分析采用Image-pro plus6.0 病理图像分析系统,每张切片于梗死灶周围选择10 个表达最强的高倍视野(400 倍) 计算阳性细胞数。
1.6 统计学方法
2 结果
2.1 各组不同时间点脑组织中Bcl-2 蛋白表达
脑组织中Bcl-2 蛋白主要表达在神经元胞质中,阳性细胞呈现淡黄色、黄色或棕黄色。假手术组脑组织中Bcl-2 阳性神经元数很少,模型组各时间点脑组织中阳性细胞数明显增高,在1 天时表达最高,然后逐渐降低,与假手术组相比,差异均具有统计意义,P <0.01;而针刺组各时间点脑组织中阳性神经元细胞数均明显高于模型组,差异具有统计学意义,P <0.01。结果见表1。
表1 脑组织Bcl-2 蛋白表达的阳性细胞数(个/400 倍视野)比较( ±s,n=6)

表1 脑组织Bcl-2 蛋白表达的阳性细胞数(个/400 倍视野)比较( ±s,n=6)
注:与假手术组比较,#P <0.05,##P <0.01; 与模型组比较,▲P <0.05,▲▲P <0.01。
组别 再灌注1 天 再灌注3 天 再灌注7天假手术组6.17 ±1.47 6.83 ±1.36 6.00 ±1.41模型组 25.83 ±1.51## 19.66 ±2.16## 15.83 ±1.43##针刺组 34.00 ±2.82##▲▲27.12 ±1.78##▲▲ 22.67 ±1.75##▲▲
2.2 各组不同时间点脑组织中c-fos 蛋白表达
脑组织中c-fos 蛋白主要表达在神经元胞质中,阳性细胞呈现淡黄色、黄色或棕黄色。假手术组脑组织中c-fos 阳性细胞数极低;模型组各时间点脑组织中c-fos 阳性细胞数显著高于假手术组,在1 天时表达最高,以后逐渐降低,与假手术组相比,差异均具有统计意义,P <0.01; 针刺组各时间点脑组织中c-fos阳性细胞数较模型组明显减少,差异具有统计学意义,P <0.01。结果见表2。
表2 脑组织c-fos 蛋白表达的阳性细胞数(个/400 倍视野)比较( ±s,n=6)
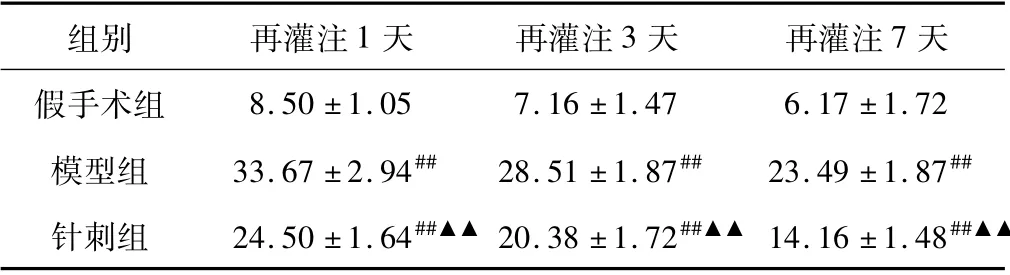
表2 脑组织c-fos 蛋白表达的阳性细胞数(个/400 倍视野)比较( ±s,n=6)
注:与假手术组比较,#P <0.05,##P <0.01; 与模型组比较,▲P <0.05,▲▲P <0.01。
组别 再灌注1 天 再灌注3 天 再灌注7天假手术组8.50 ±1.05 7.16 ±1.47 6.17 ±1.72模型组 33.67 ±2.94## 28.51 ±1.87## 23.49 ±1.87##针刺组 24.50 ±1.64##▲▲20.38 ±1.72##▲▲ 14.16 ±1.48##▲▲
2.3 各组不同时间点脑组织中Caspase-3 蛋白表达
脑组织中Caspase-3 蛋白主要表达在神经元胞质中,阳性细胞呈现淡黄色、黄色或棕黄色。假手术组脑组织中Caspase-3 阳性细胞数极低; 模型组各时间点脑组织中Caspase-3 阳性细胞数显著高于假手术组,在1 天时表达最高,以后逐渐降低,与假手术组相比,差异均具有统计意义,P <0.01; 针刺组各时间点脑组织中c-fos 阳性细胞数较模型组明显减少,差异具有统计学意义,P <0.01。结果见表3。
表3 脑组织Caspase-3 蛋白表达的阳性细胞数(个/400 倍视野)比较( ±s,n=6)

表3 脑组织Caspase-3 蛋白表达的阳性细胞数(个/400 倍视野)比较( ±s,n=6)
注:与假手术组比较,#P <0.05,##P <0.01; 与模型组比较,▲P <0.05,▲▲P <0.01。
组别 再灌注1 天 再灌注3 天 再灌注7天假手术组10.34 ±1.75 10.67 ±2.81 9.83 ±1.47模型组 32.17 ±3.31## 26.67 ±2.16## 21.65 ±2.07##针刺组 23.81 ±1.52##▲▲18.12 ±1.43##▲▲14.25 ±2.26##▲▲
3 讨论
脑缺血再灌注损伤的病理机制十分复杂,近年来研究认为脑缺血再灌注损伤中细胞凋亡是神经细胞死亡的重要形式[7],而如何有效地减少缺血再灌注后神经细胞凋亡成为重要的保护机制之一。脑缺血后缺血中心区域的神经元很快出现死亡,而缺血周围区的神经元却发生细胞凋亡,其中bcl-2、c-fos 和Caspase-3 在细胞凋亡过程中发挥重要作用。兴奋性氨基酸、Ca2+和氧自由基等也参与细胞凋亡过程[8]。
Bcl-2 具有抑制凋亡的作用,其在脑内的过量表达可增强脑组织对缺血性损伤的耐受性,提高神经细胞存活能力。Bcl-2 可以与Bax 竞争结合形成异源二聚体,阻止ctyc 穿过线粒体膜进入细胞质,从而抵抗细胞凋亡[9]。有研究表明,针刺可以通过调节凋亡相关蛋白bcl-2 和bax 表达,从而减轻脑缺血再灌注后的神经细胞凋亡[10-11]; 本实验的结果显示,Bcl-2蛋白在假手术组脑组织中呈低表达,缺血再灌注后不同时间点Bcl-2 蛋白均出现高表达,这是损伤的机体对抗细胞凋亡的一种反应。针刺组家兔脑组织中Bcl-2 蛋白的表达明显高于模型组。说明针刺头四关穴可能通过上调Bcl-2 蛋白的表达从而对脑缺血再灌注所造成的损伤起到一定的保护作用。
c- fos、c- jun 等基因在脑缺血过程中较早表达[12]。c-fos 作为转录调节因子参与细胞周期调控,并能阻断细胞内信号的转导而导致细胞凋亡,是评价脑缺血再灌注时细胞代谢变化的重要指标。正常情况下c-fos 在脑内呈现出低表达,在缺血缺氧等条件刺激下神经细胞c-fos 高表达,其产物c-fosmRNA 和fos 转入核内,与c-jun 产物蛋白形成异源二聚体来调节相关基因的转录,发挥第三信使的作用。脑缺血再灌注时多种因素共同参与中枢神经系统中c- fos的表达过程,诱导细胞凋亡的发生。本实验中观察针刺组家兔脑组织c-fos 蛋白的表达水平有所降低,表明针刺头四关穴可能是通过下调c-fos 蛋白的表达而实现对脑缺血再灌注损伤的保护作用。
Caspase-3 是促凋亡基因,在正常人脑神经元中无表达或低表达,而在脑缺血时表达明显升高[13]。Caspase-3 是多种凋亡途径的共同下游效应部分,它的激活是脑缺血后神经细胞凋亡关键步骤[14-15]。实验研究表明,缺血1 ~2 h 再灌注24 h ~46 h 后,脑组织中Caspase-3 表达增强,细胞凋亡数目也相应增多[16-18]。本实验的结果显示Caspase-3 蛋白在脑缺血再灌注不同时间点,其表达水平均有不同程度提高,表明在缺血再灌注损伤过程中发生了神经细胞凋亡。针刺干预后,Caspase-3 蛋白的表达水平都显著下降,表明针刺头四关穴可抑制其表达。
笔者推测脑缺血再灌注时,在能量代谢和氧自由基等内源性物质的刺激下,Ca2+的大量释放,诱导cfos 高表达,引起Caspase-3 介导的级联反应,从而加速了神经细胞凋亡。同时Bcl-2 表达明显增加,抑制了Ca2+的释放,发挥抗细胞凋亡作用。针刺头四关穴可以通过改变脑缺血区血液流变学、增加血液供应和改善脑组织能量代谢等途径,上调Bcl-2 蛋白水平、下调c-fos 蛋白和Caspase-3 蛋白水平从而抑制细胞凋亡,减轻脑组织的损伤。
[1] 徐虹,洪礼传,黄艳秋,等. 针刺对脑缺血再灌注模型大鼠脑组织基质金属蛋白酶、细胞间黏附分子表达的影响[J].基础医学与临床,2010,30(7) :731-736
[2] 孙洁,闫明茹,郑宇,等.“醒脑开窍”针刺法早期介入对脑缺血再灌注大鼠SOD 及MDA 的影响[J]. 中华中医药杂志,2012,27(5) :1397-1400
[3] 闫醒予.电针对脑缺血再灌注损伤大鼠脑组织中自由基及热休克蛋白70 表达的影响[J].针刺研究,2007,32(2) :102-104
[4] 杨冀萍,刘怀军,刘瑞春,等. 兔局灶性脑缺血再灌注模型的建立和影像学评价[J].脑与神经疾病杂志,2006,14(5) :354-356
[5] Longa EZ,Weinstein PR,Carlson S,et al. Reversible middle cerebral artery occlusion without cranieetomy in rats[J].Stroke,1989,20(1) :84-91
[6] 林文注,王佩. 实验针灸学[M]. 上海: 上海科学技术出版社,1999:280-281
[7] Nurmi A,Lindsberg PJ,Koistinaho M,et al. Nuclear factor kappaB contributes to infarction after permanent focal ischemia[J]. Stroke,2004,35(4) :987-991
[8] Espinoza MI,Parer JT. Mechanisms of asphyxial brain damage,and possible pharmacologic interventions,in the fetus[J]. Am J Obstet Gynecol,2005,164(6) :1582-1589
[9] 张强,熊婷,张其梅,等. 缺血后适应对大鼠脑缺血再灌注损伤Bcl-2 和Bax 蛋白表达的影响[J]. 细胞与分子免疫学杂志,2011,27(3) :329-330
[10] 刘丹,韩威,张迪.不同时间针刺对局灶性脑缺血再灌注大鼠bcl-2、bax 蛋白表达的影响[J]. 中华中医药学刊,2007,25( 3) :622-623
[11] 马惠芳,任秀君,王小宁,等. 针刺对高血脂合并脑缺血大鼠海马区Bc- l 2、Bax 蛋白表达的影响[J]. 针刺研究,2006,31( 4) :212-215
[12] Chandrasekar B,Mummidi S,Mahimainathan L,et al.Interleukin-18 induced human coronary artery smooth muscle cell migration is dependent on c-fos and AP-1-mediated matrix metalloproteinase-9 expression and is inhibited by atorvastatin[J].JBiol Chem,2006,281(22) :15099-15109
[13] 王莹,李文媛,贾桦,等.黄芪皂甙IV 联合骨髓间充质干细胞移植对大鼠脑缺血/再灌注损伤海马神经元凋亡及相关基因表达的影响[J].解剖科学进展,2011,17(4) :355-360
[14] Fjimum M,Morlta-Fujimura Y,Noshita N,et al.The cytosolic antioxidant copper/zinc-superoxide dismutase prevents the early release of mitochondrial cytochrome C in isehemic brain after transient focal cerebral ischemia in mice[J].Neurosci,2000,20(8) :2817-2824
[15] Solaroglu I,Tsubokawa T,Cahill J,et al. Anti- apoptotic effect of granulocyte-colony stimulating factor after focal cerebral ischemia in rat[J].Neurosci,2006,143(4) :965-974
[16] 杨晓燕,张力,蒋诗琴,等.蝙蝠葛碱对大鼠脑缺血/再灌注损伤后神经元细胞凋亡及凋亡相关蛋白表达的影响[J].中国中药杂志,2009,34(1) :78-83
[17] 徐晓虹,陈瑜,郑筱祥.葛根素对脑缺血诱导神经细胞凋亡的保护作用[J].中国药学杂志,2006,41(21) :1628-1631
[18] 李花,邓常清,陈北阳,等. 三七总皂苷对大鼠脑缺血/再灌注后Caspase-3 表达的影响[J].中国药理学通报,2006,22(2) :189-93
