电针干预血管性痴呆大鼠海马CA1 区AVP、Aβ1-40 蛋白表达的研究*
2015-07-11冯德琳刘玉驰
冯德琳,刘玉驰,刘 晨,邵 瑛
血管性痴呆( Vascular Dementia,VD) 是一种因脑血管病变,包括缺血性脑卒中、出血性脑卒中等原因,造成的脑部组织血流运行障碍,引起记忆、认知和行为等脑区低灌注的脑血管疾病,是一种严重的认知功能障碍综合征[1]。
针灸对痴呆大鼠脑内AVP 的调整和抑制脑缺血后Aβ 含量高表达的效果已得到肯定[2-4]。本实验以通督调神为治疗原则,选定督脉“百会”、“大椎”穴为电针组穴位,用电针疗法对VD 模型大鼠进行治疗,对比西药组( 吡拉西坦混悬液灌胃) 后,结合Morris 水迷宫对各组大鼠进行行为学测试,运用Western Blot 法对VD 大鼠海马CA1 区中AVP、Aβ1-40 蛋白含量的表达进行检测,探寻电针疗效与AVP 和Aβ1-40 蛋白含量的关系,为针灸治疗血管性痴呆提供新的科学依据。
1 材料与方法
1.1 实验动物及分组
本实验选择雄性SPF 级SD 大鼠70 只,体重180 ~220 g,由广州中医药大学实验动物中心提供[合格证号: NO. 44005900000212,许可证号: SCXK( 粤)2013-0020]。分组见图1。
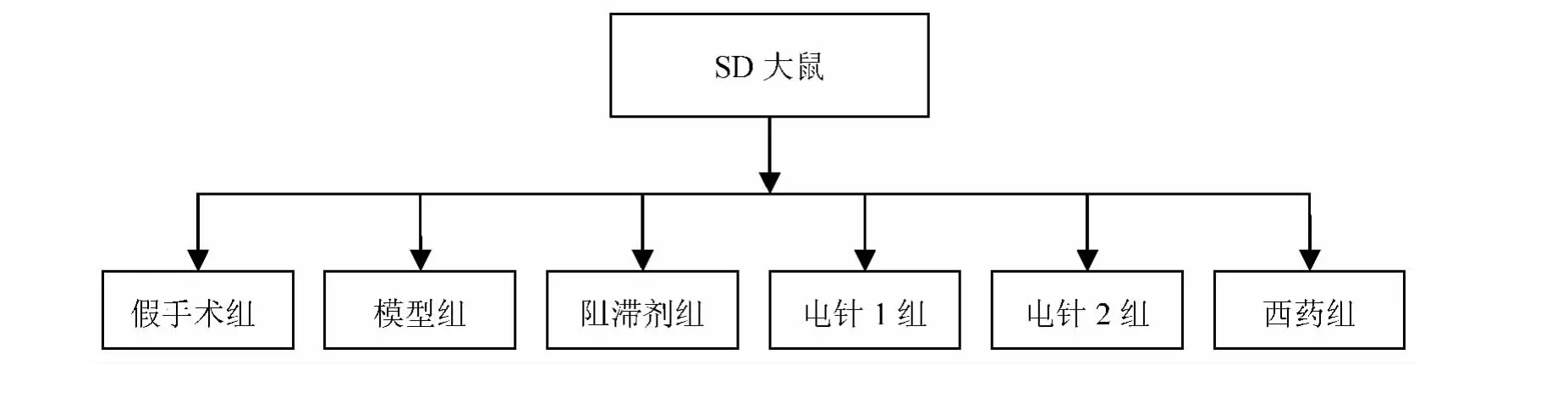
图1 实验动物分组图
假手术组:随机抽取8 只,在相应造模阶段给予一致的手术创伤,但不阻断椎动脉,不夹闭颈总动脉,其余手术过程同VD 模型组。
VD 模型组:采用改良4-VO 法。在阻断大鼠双侧椎动脉的基础上,可逆性夹闭双侧颈总动脉。
阻滞剂组:4-VO 法制备VD 模型成功后,VD 大鼠海马CA1 区注射AVP 受体阻滞剂。
电针1 组:VD 模型组+电针治疗。
电针2 组:阻滞剂组+电针治疗。
西药组:吡拉西坦混悬液灌胃。
1.2 实验动物随机分组方法与过程
将实验大鼠按体重从轻到重,依次编号为1、2、3、……70 号,在随机数目表上第2 横行第1 纵列97开始自左向右。连续抄取8 个数字,起代码为假手术组。其余大鼠均作为血管性痴呆模型造模候选大鼠。进行4-VO 造模7 天后,筛选符合实验标准的VD 模型。除去造模术后死亡12 只,剔除因术后肢体偏瘫严重,不能进行水迷宫测试的4 只;将余下46 只,随机抽取22 只模型大鼠进行AVP 受体阻滞剂注射,其余24只模型大鼠分成3 组,将动物编号后,从随机数字表抄录24 个数字,将各数一律以3 除之,并以余数1、2、3代表A、B、C。注射阻滞剂后,模型大鼠死亡4 只,另2只因注射阻滞剂后出现严重并发症,如腹水,均剔除。最后进入实验的大鼠48 只,分别为:假手术组8 只,模型组8 只,阻滞剂组8 只,电针1 组8 只,电针2 组8只,西药组8 只,造模死亡率为22.9%。
1.3 实验仪器与化学试剂
0.30 mm × 25 mm 华佗牌无菌针灸针,华佗牌SDZ-Ⅱ型电针机、Morris 水迷宫( 广州中医药大学动物实验中心提供) ,双臂数字式脑立体定位仪( 型号68015) 由深圳市瑞沃德生命科技有限公司提供。手术器械:止血钳、有齿镊、持针器、无齿镊、眼科剪、手术刀片、组织剪、眼科镊、止血弯钳、巾钳、4 号缝合线、无创动脉夹等。常规手术材料: 一次性乳胶手套、棉球、纱布等。
托伐普坦片( 批号120405S,规格15 mg,批准文号:国药准字H200110115,浙江大冢制药有限公司生产) ,水合氯醛( 批号20121204,规格250 g,国家集团化学试剂有限公司) ,注射用青霉素钠( 批号X1207619,规格160 万单位/瓶,华北制药股份有限公司) ,吡拉西坦片( 脑复康片,批号130103,规格0.4 mg/片,广东华南药业集团有限公司) ,0.9%氯化钠注射液( 批号T12111903,规格500 ml,四川科伦药业股份有限公司) ,过氧化氢溶液( 批号130403,规格100 ml,东恒健制药有限公司) ,甲紫溶液( 批号120901,规格20 ml,广东恒健制药有限公司) ,安尔碘皮肤消毒剂( 批号20120823,规格60 ml,上海利康消毒高科技有限公司) 。
1.4 动物模型的建立
1.4.1 血管性痴呆动物模型的制备 SD 大鼠术前12 h 禁食,4 h 禁水。按体重以10%水合氯醛腹腔注射(0.35 g/kg) 麻醉。随后将进入麻醉状态的大鼠俯卧位固定于特制的鼠台上,手术刀行颈部背侧正中切口,钝性分离,可见双侧第1 颈椎旁的棘突旁翼小孔,随后以直径0.5 mm 的电凝针头烧灼双侧翼小孔内的椎动脉,使之造成永久性闭塞。术后伤口处撒少量青霉素粉剂,避免伤口感染,手术线缝合伤口后,放回笼中,保温饲养,注意观察造摸大鼠的生理指征。24 h后,再次将大鼠麻醉,仰卧位固定于特制鼠台上,常规备皮消毒,手术刀行腹侧颈正中切口约1 cm,依次钝性分离出大鼠双侧胸锁乳突肌、胸骨舌肌之间的肌间隙,随后用眼科弯镊小心分离暴露出的颈总动脉和迷走神经,将分离出的颈总动脉穿4 号手术线备用,以手术线穿线后牵拉双侧颈总动脉,用无创动脉夹夹闭双侧颈总动脉15 min 后,再通10 min,反复夹闭3 次。术后以青霉素局部处理防止感染。常规皮肤缝合,碘酊消毒,放回笼中单独饲养,密切观测术后大鼠活动情况。
1.4.2 血管性痴呆大鼠阻滞剂组动物模型的制备术后3 天,待术口愈合及体力恢复后,随机选取22 只VD 大鼠进行海马CA1 区阻滞剂注射。术前12 h 禁食禁水。按实验动物体重,采用10%水合氯醛经腹腔注射麻醉(0.35 g/kg) ,俯卧位固定于脑立体定位仪,剪毛,备皮后安尔碘常规消毒,从大鼠双目锐眦连线中点,手术刀纵向垂直向后切开大鼠头顶部皮肤,长约1.5 cm,深度以切至骨膜为度。分离皮下组织,暴露颅骨,用带有过氧化氢溶液的消毒棉签用力擦拭骨膜后,可见前囟。将前囟交叉点设为原点。参照《大鼠脑立体定位图谱》[5],选取右侧海马区为注射区。定位坐标: 前 囟 后3. 0 mm,中 线 右 侧2. 0 mm,硬 膜 下2.6 mm。坐标点定位后,用注射器5 号针头,以旋转法小心钻开颅骨,以不穿透硬脑膜为度,有突破感时停止,缓慢拔出针头,将装有阻滞剂的微量进样器垂直脑表面,沿针孔缓慢垂直进针至靶点,至硬脑膜下2.6 mm,准备注射。阻滞剂选择药品混悬液为1 μl AVP 受体阻滞剂( 托伐普坦片Tolvaptan,100 μg/kg)缓慢注入,注射时间5 min(0.2 μlmin) ,留针2 min,以保证溶液充分弥散,再缓慢撤针。术口处撒少量青霉素粉剂消毒,手术线缝合术口。
1.5 动物模型标准依据
术后7 天,对VD 模型大鼠进行Morris 水迷宫试验,筛选模型大鼠,记录每只大鼠的逃避潜伏期后,分别计算假手术组平均值( 记为X) 、标准差( 记为Y) ,以“X+2Y”的标准,剔除不合格大鼠[6]。除假手术组外的其余模型大鼠,如逃避潜伏期大于“X +2Y”则认为符合实验标准的VD 模型。
1.6 处理及治疗方法
假手术组、模型组、阻滞剂组:造模7 天后开始,每日模拟抓取、固定、擦拭酒精等,不予施加任何干预措施。
电针1 组、电针2 组: 造模7 天后开始,穴位以75%酒精棉球常规消毒后,以32 号针灸针分别刺入百会穴( DU20) 、大椎穴( DU14) 。穴位的定位及针刺方法,参照《实验针灸学》[7]为准。百会穴: 位于顶骨正中,向前或向后斜刺2 mm;大椎穴:位于第7 颈椎与第1 胸椎间,背部正中,直刺3 ~5 mm。电针参数选择3 Hz的连续波,持续20 min,中等刺激,以VD 大鼠能耐受、头部轻微抖动为度( 电流强度在1 mA 左右) ,连续治疗5 天,休息2 天为1 个疗程,共治疗2 个疗程。
西药组: 造模7 天后开始,给予吡拉西坦片0.8 mg/kg混悬液灌胃。治疗周期同电针组。
1.7 Morris 水迷宫试验
Morris 水迷宫试验共进行6 天,包括定位航行试验及空间探索实验。为减少应激反应对正式试验的影响,第1 天为适应性训练,大鼠面朝池壁放入水中,游泳60 s,擦干放回笼中结束训练。第2 天开始,进行定位航行试验,以各组实验大鼠的平均成绩作为测试的最后成绩。最后1 天进行空间探索试验,记录模型大鼠首次跨越平台的时间,以及120 s 内大鼠跨越平台次数,计算每只大鼠的平均成绩,检测大鼠的空间学习以及记忆的情况。
1.8 Western Blot 法检测AVP、Aβ1-40 蛋白含量
在水迷宫试验进行完成以后,将实验大鼠以10%水合氯醛(0.35 g/kg) 麻醉后,迅速断头取脑,在冰盘上迅速从两侧大脑半球分离出的海马组织,放入标本瓶,进行Western Blot 法检测。
1.9 数据分析
用SPSS16.0 for windows 统计软件分析,计量资料以均数±标准差(±s) 记录。各组间比较采取独立样本t 检验,以P <0.05 认为差异具有统计学意义。
2 结果
2.1 Morris 水迷宫结果
电针1 组、西药组与模型组比较,电针2 组与阻滞剂组比较,平均逃避潜伏期减少、首次跨越时间缩短、120 s 内跨越原平台次数增加( P <0.05) ;阻滞剂组与模型组比较,逃避潜伏期、首次跨越时间延长,120 s 内跨越原平台次数减少( P <0.05) ;电针1 组与西药组比较,平均逃避潜伏期减少、首次跨越时间缩短、120 s 内跨越原平台次数增加( P <0.05) 。见表1、2 及图2、3。
图2 各组实验大鼠平均潜伏期对比图

图3 各组大鼠空间探索实验比较图
2.2 Western Blot 法检测结果
电针1 组、西药组对比模型组、电针2 组对比阻滞剂组后,AVP 蛋白含量增多,Aβ1-40 蛋白含量减少( P <0.05) ;模型组与假手术组比较,AVP 蛋白含量减少,Aβ1-40 蛋白含量增多( P <0.05) ;电针1 组与西药组比较,AVP 蛋白含量较多,Aβ1-40 蛋白含量较少( P <0.05) 。见表3、4 及图4 ~6。
表1 各组大鼠平均逃避潜伏期( ±s)
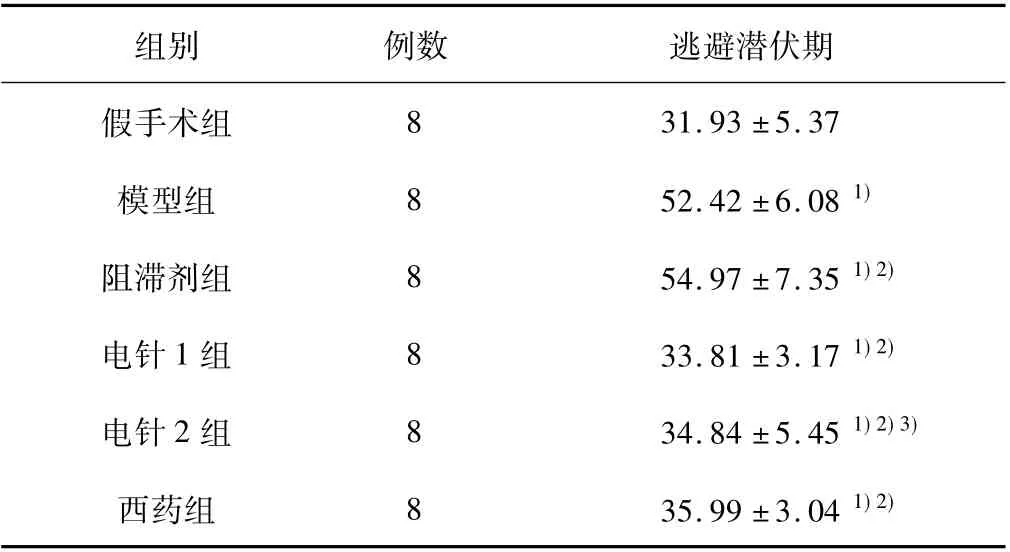
表1 各组大鼠平均逃避潜伏期( ±s)
注:与假手术组比较,1) P <0.05; 与模型组比较,2) P <0.05; 与阻滞剂组比较,3) P <0.05。
组别 例数 逃避潜伏期假手术组31.93 ±5.37模型组 8 52.42 ±6.08 1)阻滞剂组 8 54.97 ±7.35 1)2)电针1 组 8 33.81 ±3.17 1)2)电针2 组 8 34.84 ±5.45 1)2)3)西药组 8 35.99 ±3.04 1)2)8
表2 各组大鼠空间探索实验结果( ±s)
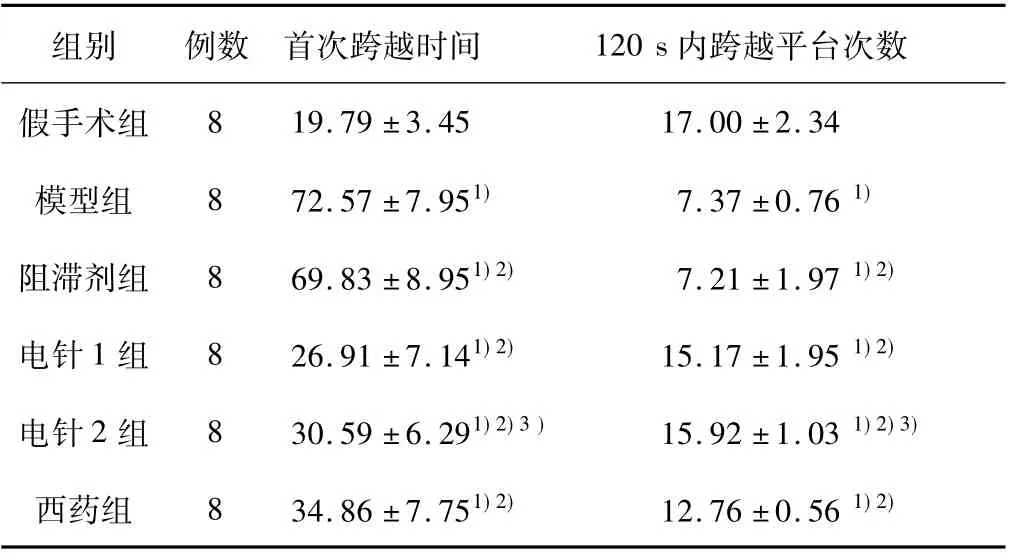
表2 各组大鼠空间探索实验结果( ±s)
注:与假手术组比较,1) P <0.05; 与模型组比较,2) P <0.05; 与阻滞剂组比较,3) P <0.05。
组别 例数 首次跨越时间 120 s 内跨越平台次数假手术组8 19.79 ±3.45 17.00 ±2.34模型组 8 72.57 ±7.951) 7.37 ±0.76 1)阻滞剂组 8 69.83 ±8.951)2) 7.21 ±1.97 1)2)电针1 组 8 26.91 ±7.141)2) 15.17 ±1.95 1)2)电针2 组 8 30.59 ±6.291)2)3 ) 15.92 ±1.03 1)2)3)西药组 8 34.86 ±7.751)2) 12.76 ±0.56 1)2)
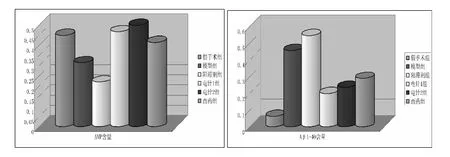
图4 Western Blot 法检测大鼠海马AVP、Aβ1-40 蛋白含量图

图5 Western Blot 法检测大鼠海马AVP 蛋白含量电泳图

图6 Western Blot 法检测大鼠海马Aβ1-40 蛋白含量电泳图
表3 各组大鼠海马CA1 区AVP 蛋白表达量( ±s)

表3 各组大鼠海马CA1 区AVP 蛋白表达量( ±s)
注:与假手术组比较,1) P <0.05; 与模型组比较,2) P <0.05; 与阻滞剂组比较,3) P <0.05。
组别 例数 AVP 含量假手术组0.450 ±0.012模型组 8 0.315 ±0.1071)阻滞剂组 8 0.220 ±0.2011)2)电针1 组 8 0.467 ±0.2591)2)电针2 组 8 0.499 ±0.1371)2)3)西药组 8 0.415 ±0.0591)2)8
表4 各组大鼠海马CA1 区Aβ1-40 蛋白表达量( ±s)
表4 各组大鼠海马CA1 区Aβ1-40 蛋白表达量( ±s)
注:与假手术组比较,1) P <0.05; 与模型组比较,2) P <0.05; 与阻滞剂组比较,3) P <0.05。
组别 例数 Aβ1-40含量假手术组0.063 ±0.021模型组 8 0.455 ±0.2751)阻滞剂组 8 0.544 ±0.2271)2)电针1 组 8 0.236 ±0.1931)2)电针2 组 8 0.199 ±0.1021)2)3)西药组 8 0.289 ±0.0151)2)8
3 讨论
血管性痴呆属祖国医学“呆病”范畴。其病位在脑,与五脏功能失调密切相关,病理性质多表现为本虚标实,五脏、气血、精髓亏虚为本,以风、火、痰、瘀为标,最终导致脑络瘀阻、脑府与诸脏腑之气不能顺接、脑失所养而渐至痴呆。本研究沿用赖新生教授的治疗方法[8-9],利用电针“百会”及“大椎”穴,通过通督调神的治疗原则,改善VD 大鼠的学习记忆、日常活动能力。
本研究选择督脉“百会”、“大椎”穴进行电针治疗。督脉为人体“阳脉之海”,是阳脉之总纲,与任、冲二脉同起于胞中。督脉循行于腰背正中,上至头面。手足三阳经经脉循行均上到头面,诸阴经之正,合于相表里阳经经别而上行头面。百会穴位于巅顶中央,居人身之最高点,头为诸阳之会,《针灸聚英》谓手足三阳皆会于此; 头为元神之府,足厥阴肝经与督脉会于巅,交百会,根据穴位的临近作用和远道作用,百会穴具有醒脑开窍、升阳固脱之功。大椎穴为手足三阳经的阳气与督脉的阳气汇聚而成,《循经考穴编》又称“上杼”穴,意指此穴位内的阳气为坚实饱满之状[10]。故针刺此二穴,能够激发脏腑经气,促进阳气的运行,从而达到通督调神、醒脑开窍的功效。有报道显示,针刺督脉穴,可明显降低VD 患者的全血低切比粘度、全血高切比粘度、血浆粘度、红细胞聚集指数,从而改善微循环,加速大脑病灶及病灶周围组织功能的恢复,进而改善脑部的缺血、缺氧状态,达到治疗脑VD 的目的[11-13]。
AVP( 血管加压素) 又称为加压素或抗利尿激素( ADH) ,是由下丘脑视上核和室旁核细胞合成和分泌的神经内分泌激素,贮存于神经垂体,广泛分布于人体各个脑区、脑脊液和血液中。同许多激素或肽类一样,AVP 同样是通过作用于不同类型受体而发挥出其多种生物学效应。在体内许多组织中,广泛存在着AVP的特异性受体,如心脑血管、泌尿生殖器官、肝脏、血小板、外周血淋巴细胞、单核细胞及肾上腺球状带等,AVP 通过与受体存在的不同靶点结合后,以激活第二信使系统而发挥其各自的生理效应[14]。根据激活第二信使系统不同,可将其划分为V1 和V2 两种类型,又根据V1 受体对不同靶细胞的药理作用的差别将V1受体划分为Vla 和V1b 两种亚型[15],前者主要分布于血管平滑肌细胞和肝细胞表面,后者主要分布于垂体前叶细胞表面。目前认为AVP 在中枢通过V1 受体发挥作用,它通过AVP-V1 受体调节中枢水、Na+、K+、Cl-等代谢,作用于脑血管平滑肌细胞和毛细血管内皮细胞,调节血脑屏障和脑血液循环[16]。故将中枢神经系统中AVP 受体分为3 种不同类型[17],V1、V2 受体均有自己的特异性受体拮抗剂。
对AVP 与情绪调控机制的猜测,是基于已发现的隔核及海马中AVP 受体的分布以及神经元投射到边缘系统的的生理因素相关。AVP 亦参与脑的认知功能调节,尤其影响脑的记忆巩固和回忆过程。AVP 已被证实是一种与学习、记忆密切相关的神经肽[18]。Griebel[19]选用V1b 受体的特异性拮抗剂SSR-149415 在一系列小鼠和大鼠模型中都进行了实验,结果证实,AVP 受体确实有很好的抗焦虑症和抑郁症的效果。脑内V1b 受体开始渐渐被认为是防治应激性相关疾病的重要中枢内部靶点[20]。有研究报道脑脊液中AVP 的变化与血液中AVP 含量的变化是相对独立的,因为AVP 不能够通过血脑屏障[21]。缺血缺氧时神经元坏死主要发生在选择性易损脑区,海马CA1区是海马结构中与人类学习记忆关系最为密切的功能区,具有对缺血的选择易损伤性[22]。所以本研究采取受体阻滞剂直接注射到模型大鼠海马CA1 区的方法。因尚无应用AVP 阻滞剂注射模型大鼠CA1 区的先例,故本研究尚属于探索性实验。
本实验所采用改良后的Pulsinelli 四血管阻断(4-VO) 法制作VD 动物模型[23],可以较好模拟VD的发病机制,及模拟人类脑缺血再灌注损伤的过程。
可以造成血管性痴呆大鼠行为学改变及记忆能力下降。实验结果显示大鼠海马CA1 区注射AVP 受体阻滞剂后,减少了AVP 的蛋白含量;且脑内Aβ1-40 的蛋白含量升高。结合治疗后的行为学改变、AVP 蛋白含量较高的组别( 电针1 组、电针2 组、西药组) 对比AVP 蛋白含量较少的组别( 模型组、阻滞剂组) ,平均逃避潜伏期均减少、首次跨越时间缩短、120 s 内跨越原平台次数增加( P <0.05) ;电针1 组与西药组比较,前者在改善VD 大鼠行为学检测的结果中明显优于西药组。在实验室检测中,电针可有效干预VD 大鼠海马CA1 区AVP 以及Aβ1-40 的蛋白含量表达,经电针治疗后,电针1、2 组比较其他各组别,AVP 蛋白含量均有升高,且Aβ1-40 含量减少。其机制可能与改善大鼠海马区AVP、Aβ1-40 在突触传递效率方面的神经调制及神经毒性作用有关,电针可促进脑内AVP的生成,从而减少Aβ1-40 的蛋白含量,从而降低老年斑的生成,减缓血管性痴呆的病变过程。
[1] 贾建平,崔丽英,王伟,等.神经病学[M].北京:人民卫生出版社,2008:205
[2] 王黎,赖新生,雷娓娓.电针对全脑缺血大鼠学习记忆能力和海马神经元超微结构的影响[J].中国针灸,2002,22(1) :47-50
[3] 牛文民,刘智斌,杨晓航,等. 嗅三针对血管性痴呆大鼠学习记忆功能及海马生长抑素、精氨酸加压素含量的影响[J]. 针刺研究,2009,34(4) :106-109
[4] 王频,杨骏,柳刚,等.艾灸头部穴位为主对血管性痴呆患者脑脊液中生长抑素和精氨酸血管加压素水平影响的随机对照试验[J].中西医结合学报,2010,8(7) :636-640
[5] 包新民,舒斯云.大鼠脑立体定位图谱[M]. 北京: 人民卫生出版社,1991:40-45
[6] 刘静.针刺“长强”穴对血管性痴呆大鼠海马CA1 区突触素蛋白表达及神经元超微结构的影响[D].福州:福建中医药大学,2012[7] 李忠仁,方剑乔,易受乡.实验针灸学[M].北京:中国中医药出版社,2008:246
[8] 赖新生,余瑾.电针治疗血管性痴呆的动物实验研究[J].中国老年医学杂志,2001,25(1) :38
[9] 莫飞智,李建强,赖新生,等. 电针对高血压血管性痴呆大鼠的疗效及对脑AVP 的影响中国康复理论与实践[J].中国康复理论与实践,2002,8(3) :129-131
[10] 曹文忠,李爱敏,代汝伟.大椎穴穴性辑考及发挥[J]. 四川中医,2012,30(12) :32-34
[11] 赵志轩,徐颖.针刺治疗血管性痴呆60 例临床观察[J].中医药学报,2103,41(3) :97-98
[12] 孟学峰,范晔,薛连峰. 调督醒神法针刺治疗血管性痴呆30 例[J].中医外治杂志,2009,18(4) :6-47
[13] 薛莉,康涛,张萍,等.调神益智针法治疗血管性痴呆患者120 例临床观察[J].四川中医,2013,31(5) :135-136
[14] 宋开梅,赵连友.精氨酸加压素受体及其拮抗剂[J]. 中国高血压杂志,1994(2) :43
[15] Howl J,Ismail T,Strain AJ,et al.Characterization of the human liver vasopressin receptor[J].Biochem J,1991(276) :189
[16] Vakili,Abedin,Kataoka,et al.Role of argininevasopressin V1 and V2 receptors for brain damage after transient focal cerebral ischemia[J].Cereb Blood Flow Metab,2005(25) :1012-1019
[17] Lebrun CJ,Grober WG,Meister M,et al.Central vasopressin pretreatment sensitizes phosphoinositol hydrolysisi in the rat septum[J].Btain Res,1990(31) :167
[18] 王建新,金志敏,徐凯,等. 不同针刺联合阿米三嗪萝巴新片治疗血管性痴呆临床对比观察[J]. 临床合理用药,2014,7( 3A) :118-119
[19] Griebel G,Simiand J,Serraoleil-Le,et al. Anxiolytic- and antidepressant-like effects of the non- peptide vasopressin V1b receptor antagonist,SSR149415,suggest an innovative approach for the treatment of stress- related disorders[J]. Proc. Natl Acad. Sci. USA,2002(99) :6370-6375
[20]Griebel G,Simiand J,Stemmelin J,et al.The vasopressin V1b receptor as a therapeutic target in stress- related disorders[J]. Current Drug Target CNS Neurol Disorder,2003(2) :191-200
[21] 杨光明,李涛,徐竞,等.V1a/V2 受体在精氨酸血管加压素恢复失血诱导大鼠血管低反应性中的作用[J].创伤外科杂志,2008,10(1) :57-60
[22] 何金波,金杰. 参芎葡萄糖注射液治疗血管性痴呆的疗效及对AVP 的影响[J].中国实验方剂学杂志,2012,18(21) :306-310
[23] 王萍,杨骏,王颖.血管性痴呆两种动物模型的比较[J].中国中医急症,2012,21(2) :214-216
