猪胎盘显微结构研究进展
2015-07-10张居作薛立群
彭 璇,张居作,薛立群
(湖南农业大学动物医学院,湖南长沙410128)
胎盘是哺乳动物妊娠期的临时器官,是母胎间进行物质交换的重要场所,胎盘形态异常严重影响其正常功能的发挥,导致胎儿宫内发育迟缓、产前损失和产后活力低下等[1]。Guttmacher[2]呼吁建立“人类胎盘计划”,以期能够实时动态的掌握人类胎盘的结构和功能,对于从胎儿期预防人类疾病具有重要意义。猪是多胎动物,窝产仔数与胎盘性状密切相关[3]。20世纪80年代,Friess[4,5]利用灌注固定方法对不同妊娠期的猪胎盘显微结构进行了观察,发现上皮绒毛膜胎盘是组织层次最为完整的胎盘。目前,国内外学者对猪胎盘形态学研究已经取得了较大进展,但仍留下了诸多疑点。我国是养猪大国,随着养猪业集约化、现代化发展,胎儿产前丢失给生产造成了巨大损失,胎盘形态学和形成机制等相关研究引起了广大学者的兴趣。掌握猪胎盘显微结构,分析探讨结构与功能之间的关系,对改善胎盘功能性指标和提高母猪繁殖效率具有重要的指导性意义。
1 猪的胎盘屏障
Burton等根据胎盘结构特点和母胎界面的连接方式将哺乳动物的胎盘大致分为4类,猪胎盘属于非蜕膜弥散型上皮绒毛膜胎盘[6],绒毛膜血管内皮、绒毛膜间充质、绒毛膜上皮(滋养层)、子宫内膜上皮、子宫内膜结缔组织和母体血管内皮6层组织共同形成胎盘屏障[7],阻止大部分微生物和毒物等从母体进入胎儿,同时也是维系母胎间物质转运、气体交换与血液循环的唯一部位[8]。在妊娠过程中,胎儿和母体血液循环各自独立,血管间隔着各种结缔组织交错逆流排列并与胎盘面垂直[9],其毛细血管网分别位于子宫内膜和绒毛膜的外侧[10]。因此,上皮绒毛膜胎盘较血绒毛膜胎盘(母体胎盘缺失,母体血液直接接触滋养层细胞)扩散距离较宽,胎盘屏障的厚度和血管密度将会很大程度上影响物质的交换效率[11]。
2 猪胎盘显微形态学结构
猪胎盘绒毛膜可以人为的分为三个区域:占据了胎囊中央大部分区域的胎盘区、邻近的副胎盘区和无血管形成的末端区。绒毛均匀地分布在胎盘区和副胎盘区,与子宫上皮平行紧靠,嵌合于子宫内膜,凹陷形成腺窝[4]。
2.1 妊娠早期
猪的胚胎附植发生在妊娠12~20天,胎儿滋养层细胞与子宫粘膜上皮细胞此时开始发生接触,建立母体与胎儿之间的联系[12]。附植完成后滋养层向尿囊绒毛膜和羊膜绒毛膜分化,胎盘血管增生;子宫内膜重构,和相应的绒毛膜上皮相互平行交错排列并彼此融合,形成初期的绒毛膜上皮/子宫内膜上皮双细胞层结构(图1)。绒毛膜不同部位的上皮细胞存在不同的形态,皱褶基部的上皮细胞呈平均高度为40μm的圆柱状,侧边和顶部的细胞高度减少,最小高度为20μm;但子宫内膜上皮细胞高度变化并不明显,平均高度维持在20μm左右。
此时子宫内膜和胎儿胎盘的联系并不紧密,羊膜和尿囊膜在实验过程中极易脱落。这一阶段在子宫腺口上方开始出现明显外缘增厚的白色圆盘状物,其横截面呈现圆顶状构造,即早期的绒毛晕[4](图2),绒毛晕的发育会使绒毛膜和子宫内膜的联系变得紧密,也有利于绒毛膜吸收腺体分泌的物质通过血管进入胎儿循环系统[5]。
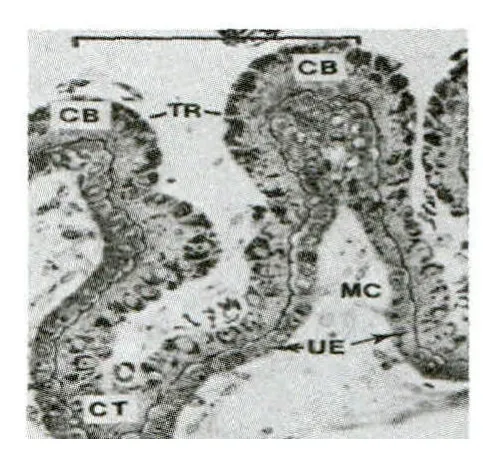
图1 绒毛膜上皮/子宫内膜
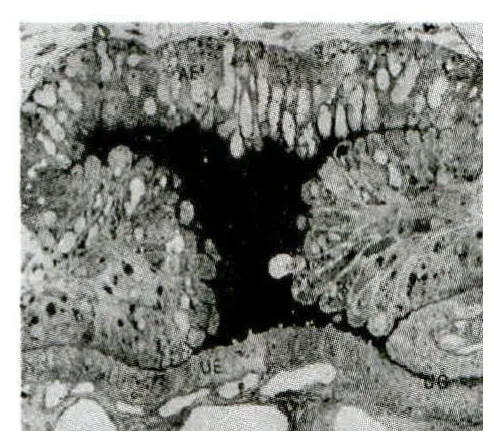
图2 绒毛晕,30d[4]
2.2 妊娠中期
猪胎盘在妊娠40天发育接近完整。为满足胚胎的快速增长,大多数品种的猪需要通过绒毛膜与子宫内膜接触面积的增大或血管密度的增加来克服有限子宫容量的缺陷,保证对胚胎的营养供给[13]。因此,子宫内膜重构进一步发展,皱褶延伸复杂化,绒毛膜嵌入凹陷处,与子宫内膜皱褶相互吻合,两者间隙距离减小,双细胞层嵌合更为紧密[4]。Hasselager[14]认为母胎界面接触面积的增加可以人为地分为在三个层次:(1)肉眼观察结构:覆以胎膜的子宫粘膜褶皱;(2)光学显微结构:覆以绒毛膜上皮细胞的子宫上皮细胞层褶皱;(3)超微结构:母胎双方形成指状突起的胎盘微绒毛。Vallt[15]也通过测量双细胞层褶皱的宽度,证实了同窝胎儿之间,胎儿大小与褶皱的平均宽度呈正相关性,证明子宫内膜与绒毛膜相互作用的界面的增大有利于促进胎儿的发育。
胎儿发育引起胎囊扩张、子宫容量增加,此时子宫内膜细胞高度缓慢减少,但仍然维持高圆柱状,基质中包括更为丰富的血管和腺体,邻近上皮细胞层的血管增生。绒毛膜侧部和顶部的上皮细胞高度进一步缩小(15μm),基部的上皮细胞高度变化不明显(35μm)。毛细血管凹陷到绒毛中,被绒毛膜上皮所包围,与上皮细胞融合成单独的一层[4]。Tanaka[16]推测侧面和顶部细胞层的薄化是气体交换的结构基础,而基底部细胞通过血液传输的形式来运输营养物质,则可能是由于受到子宫上皮细胞间通道系统的促进而导致的。Amin等[17]研究发现猪的胎盘屏障较其他种属哺乳动物更薄,扩散距离更短,这一特点有利于双方逐渐形成嵌合的毛细血管网络进行物质交换。
与此同时,大量的子宫腺也在活跃地分泌有明确营养功能的蛋白质,逐渐成熟的绒毛晕则在子宫腺开口处为组织吸收营养[6]。其内层上皮细胞呈高圆柱形,平均高度为45μm,顶部出现较长的微绒毛,相邻细胞通过发达的紧密连接和粘着小带排列在一起,部分绒毛晕相互融合形成较大的不规则绒毛晕。根据Roberts的实验,子宫运铁蛋白在整个子宫腺分泌物中占据了重要的部分(10%~15%)[5]。因此,绒毛晕能与子宫腺一起调控母胎间铁的运输,这对胎儿的发育和成长显得尤为重要。
2.3 妊娠后期
妊娠后期,双细胞层进一步发育,褶皱不断弯转延展,形成不同层次和等级的绒毛和微绒毛。绒毛膜和子宫内膜接触面积达到最大,嵌合非常紧密。子宫内膜下基质中的血管和腺体进一步增多,母胎毛细血管网平行排列、相互接近,距离达到最小[4]。覆盖在毛细血管上的上皮细胞高度进一步缩小,滋养层几乎完全被胎儿血管所分离,在妊娠结束的时刻,有效胎盘屏障的宽度将减少至2μm甚至更少[4]。以上结构变化是妊娠胎盘发育与物质交换功能增强的重要特征。
此时,成熟绒毛晕的内表面会形成大量的褶皱,使内表面的面积显著增加。接壤细胞的交错也会变得更加明显,并在相邻的细胞底侧部形成一个相当复杂的系统[5]。绒毛晕在发育过程中表现出许多典型的形态学参数,如长微绒毛、发达的顶部管状系统和无数位于细胞质顶部的有衣小泡,部分绒毛晕腔内还可观察到一定的分泌物,这些特征都是与其吸收功能相一致的[18]。
3 小结与展望
综上所述,母猪在妊娠期间胎盘显微结构不断变化,并与其物质交换功能的增强相一致,主要表现在以下四个方面:(1)绒毛膜上皮/子宫上皮双细胞层形成弯曲延展的皱褶,并随着妊娠的进行逐渐复杂化,部分区域可观察到初级、次级分支绒毛结构。(2)绒毛膜脊的滋养层细胞和子宫上皮细胞形态逐渐发生薄化,其厚度通常小于2μm,大大减少了胎盘屏障的厚度和两者间物质交换的距离。(3)胎儿胎盘和母体胎盘基质中的血管密度均随着妊娠发展而增加,使物质交换效率在有限子宫容量内得到提高。(4)绒毛晕作为吸收子宫腺体分泌物的结构,其数量的不断增加可以推论出子宫内膜分泌功能也在不断加强。
目前,国内外学者在猪胎盘显微形态学方面的研究取得了一些进展,但其生理形成和病理改变的深层机制仍不明确。在深入了解胎盘结构的基础上,如何控制形态学的相关指标来改善胎盘功能,从而防治母胎疾病和提高母猪繁殖效率,将是今后关于猪胎盘研究的主要方向。
[1]朱秋凤,张卫辉,黄进,等. 胎儿宫内发育迟缓胎盘形态学的研究进展[J]. 畜牧与兽医. 2008(06): 103-106.
[2]Guttmacher A E, Maddox Y T, Spong C Y. The Human Placenta Project: placental structure, development, and function in real time[J]. Placenta. 2014, 35(5): 303-304.
[3]常炳珍,刘瑞奇,徐珊珊. 影响母猪产仔数与出生重的十大原因分析[J]. 当代畜禽养殖业. 2012(02): 14-15.
[4]Friess A E, Sinowatz F, Skolek-Winnisch R, et al. The placenta of the pig. I. Finestructural changes of the placental barrier during pregnancy[J]. Anat Embryol (Berl). 1980, 158(2):179-191.
[5]Friess A E, Sinowatz F, Skolek-Winnisch R, et al. The placenta of the pig. II. The ultrastructure of the areolae[J]. Anat Embryol (Berl). 1981, 163(1): 43-53.
[6]Burton G, Wooding F B P. Comparative placentation :structures, functions and evolution[M]. Berlin: Springer, 2008: 301.
[7]杨倩. 动物组织学与胚胎学[M]. 北京: 中国农业大学出版社, 2008: 410.
[8]Wu G, Bazer F W, Wallace J M, et al. Board-invited review: intrauterine growth retardation: implications for the animal sciences[J]. J Anim Sci. 2006, 84(9): 2316-2337.
[9]Leiser R, Dantzer V. Structural and functional aspects of porcine placental microvasculature[J]. Anat Embryol (Berl).1988, 177(5): 409-419.
[10]Tung E, Roberts C T, Heinemann G K, et al. Increased placental nutrient transporter expression at midgestation after maternal growth hormone treatment in pigs: a placental mechanism for increased fetal growth[J]. Biol Reprod. 2012, 87(5):126.
[11]Bielanska-Osuchowska Z. Ultrastructure of mucous areolae in the pig placenta[J]. Folia Histochem Cytobiol. 1995, 33(2):103-110.
