柴胡与氯苯那敏在大鼠体内药物间的相互作用研究
2015-07-07高柳柳张晶徐外兰李玉良郭延垒于超
高柳柳,张晶,徐外兰,李玉良,郭延垒,于超
(重庆医科大学 生命科学研究院,重庆 400016)
柴胡与氯苯那敏在大鼠体内药物间的相互作用研究
高柳柳,张晶,徐外兰,李玉良,郭延垒,于超Δ
(重庆医科大学 生命科学研究院,重庆 400016)
目的 探讨柴胡提取物与氯苯那敏在大鼠体内药物间的相互作用。方法 将20只SD大鼠随机分为2组,实验组10只给予20 mg/kg的柴胡提取物2周,对照组10只平行给予生理盐水,第15天分别给予氯苯那敏,于(0、0.1、0.5、1、1.5、2、3、4、6、8、10、12、24 h)点采血200 μL,采用LC-MS分析方法测定氯苯那敏的血药浓度,以Graphpad prism 5.01软件计算2组的药代动力学参数。结果 实验组的AUC(0-∞)[1.40±0.27(μg·h)/mL] 明显高于对照组[0.87±0.25(μg·h)/mL];而代谢清除率CLint[14.25±2.84(L·kg)/h]明显低于对照组[22.97±2.03(L·kg)/h](P<0.05)。结论 柴胡提取物能够降低大鼠体内氯苯那敏的代谢清除率,临床上用药时应尽量避免2种药物的联合使用。
柴胡提取物;氯苯那敏;CYP2D6;相互作用
中药-西药联合使用导致的药物-药物相互作用引起广泛的关注,相关报道不断增多[1-3]。据2007年美国的一项调查显示,40%的患者可能因中药-西药相互作用导致不良反应[4]。中药有效成分在体内代谢酶的作用下发生代谢转化的同时对酶产生抑制或诱导作用,引起合用药物代谢行为的改变,增高血药浓度或引起蓄积,导致不良反应或者毒性反应的发生。例如甘草可增加地高辛的毒性,人参可增加阿司匹林和非甾体抗炎药的出血效应[5]等。因此研究中西药间相互作用对于临床安全用药、降低药物相互作用的风险有重要意义。
感冒是临床上的常见疾病,是由病毒引起的急性上呼吸道感染疾病。近年来,中药在治疗感冒时的有效性受到人们的广泛关注。在感冒药处方中,中西药联用的处方占有较大比例。柴胡是许多用于抗感冒的中成药或中药复方的主要药物之一,如小柴胡颗粒、小柴胡汤等,其具有解热、抗病毒、抗炎等多方面的药理作用[6]。马来酸氯苯那敏又称扑尔敏,是第一代组胺 H1 受体拮抗剂,常用于缓解流泪打喷嚏流涕等感冒症状[7],是常用的抗感冒药(如感冒灵颗粒)的组方成分[8]。因此2者在临床上联合使用的可能性非常大。本课题组在体外研究中发现柴胡提取物对氯苯那敏的代谢有明显的抑制作用[9]。而在动物体内是否存在抑制作用需进一步验证及探讨。
1 材料与方法
1.1 仪器与试药 岛津2010AH液质串联系统(日本岛津公司);XS-105十万分之一精密电子天平(美国METTLER TOLEDO公司);SIGMA1-14低速离心机(美国SIGMA公司);Elix10超纯水净化系统(美国MILLIPOER公司);RE-2000旋转蒸发仪(中国上海亚荣生化仪器厂)。
马来酸氯苯那敏(批号为D9684-5G,纯度≥99 %)购自Sigma公司;地西泮(批号为9101003, 纯度≥98%)由中国药品生物制品检定所提供;乙腈为色谱纯;实验用水为超纯水,其余所用试剂均为分析纯。
1.2 实验动物 清洁级雄性Sprague-Dawley (SD)大鼠,体质量(220±20)g,由重庆医科大学实验动物中心提供,实验动物合格许可证号: SCXK(渝)2007-0002。
1.3 方法
1.3.1 色谱与质谱条件:色谱条件:色谱柱为Waters C18柱(150 mm×2.0 mm,5 μm)。流动相为乙腈:醋酸铵(10 mmol/L, pH4.5)45:55,等度洗脱;流速:0.2 mL/min;柱温:30 ℃;检测波长:210 nm。质谱条件:MS选用ESI源,正离子条件下(Positive)采用选择性离子检测模式(SIM);喷雾电压为4.5 KV;采用高纯N2作为载气,载气流量为1.5 L/min;检测器电压为1.75 KV;干燥气温度250 ℃。SIM模式下氯苯那敏和地西泮的监测离子质核比分别为m/z 275和m/z 285。
1.3.2 标准品溶液的配制:精密称取马来酸氯苯那敏10.63 mg,加水溶解并定容至10 mL容量瓶,置于4 ℃冰箱存储备用。精密称取内标地西泮1.02 mg,加水溶解并定容至1 mL容量瓶,置于4 ℃冰箱存储备用。
1.3.3 柴胡提取物溶液[10]的配制:称取柴胡1000 g,置圆底烧瓶中,精密加入适量70% 乙醇并加热煮沸1 h后,置双层网孔滤膜过滤,滤渣以相同方法提取2次,收集并合并滤液。所得滤液首先经AB-8型大孔吸附树脂纯化,再用RE-2000旋转蒸发仪进行浓缩,烘干至恒重,得到柴胡提取物(产量为柴胡经烘干后质量的18.5 %)。所得柴胡提取物置于4 ℃冰箱备用。精密称取柴胡提取物50 mg于5 mL量瓶中,用热水溶解,冷却后定容至刻度,得10 mg/mL柴胡提取物溶液备用,每1 mL柴胡提取物相当于0.054 05 g柴胡。
1.3.4 给药与分组:本研究所用SD大鼠按照简单抽样的方法分实验组与对照组,每组各10只,均在标准条件下(正常白昼交替,温度为22~25 ℃)给予充足的食物和蒸馏水喂养。实验组大鼠每天给予20 mg/kg的柴胡提取物,连续给药2周,对照组的大鼠平行给予生理盐水。
1.3.5 血浆样品的采集:于第15天口服给予20 mg/kg的氯苯那敏溶液,分别在不同时间点(0、0.1、0.5、1、1.5、2、3、4、6、8、10、12、24 h)取大鼠眼静脉血液样品约200 μL,置于预先肝素化的EP管中。将得到的血液样品在5000 r/min下离心10 min,吸取上清液100 μL,放于-20 ℃冰箱存储至分析。
1.3.6 血浆样品的处理:采用液-液萃取的方法处理血浆样品。SD大鼠眼静脉采血约200 μL,置于肝素化的EP管中,以5000 r/min离心10 min,取上清液100 μL,并转移至2 mL的EP管中,依次加入100 μL饱和碳酸钠溶液,20 μL地西泮标准品溶液,1.5 mL乙酸乙酯︰正己烷(2:1,v/v)萃取液,涡旋混匀3 min,以5000 r/min转速离心10 min,取上清液1.4 mL,氮气吹干,残渣加入100 μL流动相复溶以12000 r/min的转速离心10 min,取上清液进行LC-MS分析并计算氯苯那敏血药浓度。
1.4 方法学考察
1.4.1 方法专属性:将空白血浆样品、氯苯那敏(0.25 μg/mL)和地西泮标准品(1.0 μg/mL)、加入氯苯那敏和地西泮的血浆样品,按照选定的色谱条件进行LC-MS分析,记录质谱图。
1.4.2 线性关系与检测限:取空白血浆样品100 μL,并转移至2 mL的EP管中,依次加入100 μL饱和碳酸钠溶液,20 μL地西泮标准品溶液,20 μL系列浓度的氯苯那敏标准品溶液,1.5 mL乙酸乙酯 :正己烷(2:1,v/v)萃取液,涡旋混匀3 min,以5000 r/min转速离心10 min,取上清液1.4 mL,氮气吹干,残渣加入100 μL流动相复溶以12000 r/min的转速离心10 min,取上清液进行LC-MS分析,氯苯那敏终浓度分别为0.1,0. 25,0.5,1,2.5,5,10,25,50 μg/mL。以氯苯那敏与内标(Y)的峰面积的比值为纵坐标,以氯苯那敏的浓度(X, μg/mL) 为横坐标进行线性回归分析。
1.4.3 精密度考察:配制浓度为0.25、2.5、25 μg/mL低、中、高3个浓度的氯苯那敏标准品及内标的血浆样品,按上述方法进行血浆样品的处理,在选定的色谱和质谱条件下于1 d内连续测定5次和连续测定3 d,评价测定方法的日内和日间精密度(随行标准曲线同时测定)。以同一已知浓度的不同样品测得值之间的RSD值作为日内精密度,第1、2、3 d进行3批样品的精密度测定,每批含低、中、高样品各5份,计算日间精密度。
1.4.4 准确度考察:配制浓度为0.25、2.5、25 μg/mL低、中、高3个浓度的氯苯那敏标准品及内标的血浆样品,按上述方法进行血浆样品的处理,在选定的色谱和质谱条件下进行LC-MS分析,每个浓度在同一水平条件下平行5个样品进行分析,以测得各样品实际测定值的均值与加入标准品测定值计算回收率。
1.4.5 提取回收率:配制浓度为0.25、2.5、25 μg/mL低、中、高3个浓度的氯苯那敏标准品及内标的血浆样品各5份,按上述方法进行血浆样品的处理,在选定的色谱和质谱条件下进行LC-MS分析,得到血浆样品中氯苯那敏的平均峰面积与内标的平均的峰面积之比值(A1)。另取浓度为0.25、2.5、25 μg/mL低、中、高3个浓度的氯苯那敏标准品溶液各20 μL,加入20 μL的内标溶液和60 μL的甲醇溶液,在选定的色谱和质谱条件下进行LC-MS分析,得到氯苯那敏的平均峰面积与内标的平均的峰面积之比值(A2)。血浆样品中的氯苯那敏的提取回收率(%)= A1/A2×100%。
1.4.6 基质效应考察:精密吸取浓度为0.25、2.5、25 μg/mL低、中、高3个浓度的氯苯那敏标准品各20 μL,加入20 μL的内标溶液,氮气吹干;另取空白血浆200 μL,按上述血浆样品处理方法萃取后,取上清液1.4 mL加入挥干后的标准品试管中,涡旋混匀,氮气吹干,100 μL流动相复溶后,在选定的色谱和质谱条件下进行LC-MS分析,得到血浆样品中氯苯那敏的平均峰面积与和内标的平均的峰面积之比值(A3)。血浆样品中的氯苯那敏的基质效应(%)=A3/A2×100%。
1.4.7 稳定性考察:配制浓度为0.25、2.5、25 μg/mL低、中、高3个浓度的氯苯那敏标准品及内标的血浆样品,分别在室温保存1 d考察室温稳定性;考察经液-液萃取后的样品在室温放置1 d的稳定性;-20 ℃保存1、2、3 d考察冻存条件下的稳定性。按上述方法进行血浆样品的处理,在选定的色谱和质谱条件下进行LC-MS分析,考察样品在室温和冻存条件下的稳定性。
1.4.8 血药浓度及药动学参数结果:将给药组和对照组采集的血浆样品按上述血浆样品处理方法处理并进行LC-MS分析,计算两组各时间点的氯苯那敏血药浓度。
1.5 统计学方法 采用DAS 3.0药物代谢动力学软件对血药浓度-时间数据进行房室模型分析,绘制血药浓度-时间曲线,采用Graphpad Prism 5.01 软件对氯苯那敏药代动力学参数进行统计分析。
2 结果
2.1 方法专属性 氯苯那敏与地西泮分离效果良好,且无内源性干扰,见图1。
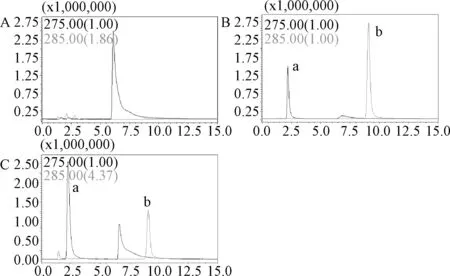
图1 血浆中氯苯那敏与内标的质谱图A:空白血浆;B:氯苯那敏+内标标准品;C:给药血样+内标标准品a:氯苯那敏;b:内标Fig. 1 MS profiles of chlorpheniramine and internal standardA:blank plasma;B: chlorpheniramine + internal standard; C:plasma + internal standard a:chlorpheniramine; b: internal standard
2.2 线性关系与检测限 计算氯苯那敏在0.1~50 μg/mL浓度范围内线性关系良好。回归方程为Y=0.0098X+0.1625,r=0.9934。氯苯那敏的检测限(LOD)为0.002 μg/mL(S/N>3,n=5),定量限(LLOQ)为0. 1 μg/mL。
2.3 精密度考察 结果显示低、中、高样品的日内RSD分别为6.69 %,3.24 %,5.74 %,日间RSD分别为10.70 %,8.07%,9.82%,以上结果表明样品测定的重现性良好。
2.4 准确度考察 以测得各样品实际浓度的均值与加入对照品浓度的比值作为回收率,经计算低、中、高样品的回收率
分别为95.36 %, 102.59 %,93.18 %,结果显示回收率均在85%~115%之间,表明该分析方法准确性良好,符合生物样品分析检测要求。
2.5 提取回收率 经计算,3种浓度氯苯那敏血浆样品的提取回收率分别为83.8%,76.8%,80.5%,符合相关要求。
2.6 基质效应考察 经计算,3种浓度氯苯那敏血浆样品的基质效应分别为95.2%,97.6%,96.0%(n=5)。结果表明本研究建立的方法无基质效应干扰。
2.7 稳定性考察 结果表明室温保存1 d后,低、中、高3个样品的实际测得浓度与样品浓度的比值分别为105.6%,100.2%,102.5 %(n=5);经液-液萃取的样品在室温下放置1 d后,低、中、高3个样品的实际测得浓度与样品浓度的比值分别为98.6%,95.2%,96.7%(n=5);-20 ℃保存1、2、3 d后,低、中、高3个样品的实际测得浓度与样品浓度的比值分别在98.4%~107.1%,97.8%~ 108.6 %,96.8%~ 97.7%(n=5)之间。结果显示稳定性均在95%~115% 之间,表明样品在室温下保存1 d和-20 ℃保存3 d的过程中都较为稳定。
2.8 血药浓度及药动学参数结果 血药浓度-时间曲线见图2,并采用Graphpad Prism 5.01 软件计算氯苯那敏药代动力学参数,见表1。

图2 氯苯那敏给药后的血药浓度-时间曲线Fig.2 Plot of plasma concentration vs time after administered with chlorpheniramine

组别 AUC(0-t)(μg·h/mL)AUC(0-∞)(μg·h/mL)t1/2(h)Tmax(h)Cmax(μg/mL)CLint(L·kg/h)对照组0.81±0.160.87±0.253.09±0.161.50.81±0.2022.97±2.03实验组1.29±0.271.40±0.277.04±1.481.51.44±0.2914.25±2.84
3 讨论
柴胡为我国传统中药,在中国的临床应用历史悠久。其具有镇静、解热、抗炎、抗病毒、保肝、降血压和抗肿瘤等多种药理活性[12]。有文献[13]报道,小柴胡汤对大鼠肝线粒体的单胺氧化酶有一定抑制作用。因此,当柴胡药物与其他药物联合使用时,很可能会发生药物-药物相互作用。马来酸氯苯那敏主要用于治疗打喷嚏、流涕等感冒症状,是第一代组胺 H1受体拮抗剂。临床上常将柴胡药物与马来酸氯苯那敏联合使用,用于治疗感冒等症状。氯苯那敏在体内主要由CYP2D6酶代谢[11],当柴胡提取物使CYP2D6酶活性受到影响时,体内氯苯那敏的代谢清除率应当会发生变化[14]。因此,研究柴胡提取物与氯苯那敏是否存在相互作用具有重要意义。
将给药组和对照组的动力学参数进行比较结果显示,实验组的AUC(0-∞)(1.40±0.27)μg·h/mL明显高于对照组(0.87±0.25)μg·h/mL;而代谢清除率CLint(14.25±2.84)μg·h/mL明显低于对照组 (22.97±2.03)L·kg/h(P<0.05)。实验组和对照组的药代动力学参数经t检验, 发现平均AUC(0-∞)和体内总体清除常数2组之间均存在统计学差异 (P<0.05),其他药代动力学参数(如Cmax, Tmax, t1/2)与对照组相比无统计学差异。结果分析表明给药柴胡提取物后,大鼠体内氯苯那敏的代谢受到抑制。文献[11]报道,氯苯那敏主要经由CYP2D6代谢,由此推断,柴胡提取物可能是通过抑制CYP2D6的活性,从而抑制了氯苯那敏的代谢。因此柴胡与马来酸氯苯那敏合用可能发生药物-药物相互作用。
研究结果表明,给药柴胡提取物后大鼠体内氯苯那敏的代谢受到了抑制。而氯苯那敏主要经P450酶中的CYP2D6代谢。因此可推断柴胡提取物对氯苯那敏代谢抑制原因可能柴胡提取物对CYP2D6产生抑制,进而抑制氯苯那敏的代谢。因此柴胡提取物对氯苯那敏的代谢存在抑制作用,当柴胡与马来酸氯苯那敏联合使用时可能会发生药物-药物相互作用。这将为临床上柴胡的合理化用药提供理论依据。
[1] 艾常虹,孙汉雄,李桦,等.中药有效成分对细胞色素P450酶的抑制活性评价[J].中国药理学通报.2011,27(4):519-523.
[2] Williamson EM.Drug interactions between herbal and prescription medicines[J].Drug Safty,2003,26(15):1075-1092.
[3] Izzo AA,Ernst E.Interactions between herbal medicines and prescribed drugs[J].Drugs,2009,69(13):1777-1799.
[4] Bush TM,Rayburn KS,Holloway SW,et al.Adverse interactions between herbal and dietary substances and prescription medicines:a clinical survey[J].Alternat Ther Health Med,2007,13(2):30-35.
[5] 王爱军,要林青,张鑫.临床安全用药应重视药物相互作用[J].中国药业.2014,23(5):49-50.
[6] 李芳,李建北,张东明.柴胡的药理研究进展[J].时珍国医国药,2004,15(2):120-121.
[7] 赵瑜.小柴胡颗粒的儿科临床应用[J].辽宁医学杂志,2012,26(3):141-143.
[8] 马春梅,赵变,席荣英,等.高效液相色谱法测定马来酸氯苯那敏[J].理化检验-化学分册,2012,48(10):1244.
[9] 惠俊敏,郭延垒,赵德璋,等.柴胡提取物对氯苯那敏经大鼠肝微粒体代谢抑制的考察[J].中国医院药学杂志,2013,23(33) :1911-1914.
[10] 曹纬国,陶燕铎,张有金,等.青海产小叶黑柴胡中皂苷类成分的含量分析[J].中国现代应用药学,2012,29(4) :323-326.
[11] Sally UY,Peter Z,Andrea E,et al.The roles of CYP2D6 and stereoselectivity in the clinical pharmacokinetics of chlorpheniramine[J].British Journal of Clinical Pharmacology,2002,53(5):519-525.[12] 牛向荣.柴胡药理作用研究概述[J].中国药师,2009,12(9):1310-1312.
[13] 吴春福,刘雯,解庆峰,等.小柴胡汤对大鼠肝线粒体的单胺氧化酶的抑制作用[J].沈阳药学院学报,1991,8(3) :207-210.
[14] Melinda JR,Robert MW,Keith TM,et al.An in Vitro Mechanistic Study to Elucidate the Desipramine/Bupropion Clinical Drug-Drug Interaction[J].Drug Metabolism and Disposition,2008,36(7):1198-1201.
(编校:王冬梅)
Study of drug interaction betweenBupleurumsmithiiextracts and chlorpheniramine in rats
GAO Liu-liu,ZHANG Jing,XU Wai-lan,LI Yu-liang,GUO Yan-lei,YU ChaoΔ
(Institute of Life Sciences, Chongqing Medical University, Chongqing 400016, China)
ObjectiveTo investigate the drug-drug interaction betweenBupleurumsmithiiextract and chlorpheniramine in rats.Methods20 SD rats were randomized into two groups. 10 SD rats in experimental group were orally administered withBupleurumsmithiiextract (20 mg/kg) once a day for two weeks and the other 10 rats in control group were orally administered with normal saline. On the 15th day, 20 SD rats were orally administered with chlorpheniramine.200 μL plasma samples were collected at(0,0.1,0.5,1,1.5,2,3,4,6,8,10,12,24 h) different time points. Plasma concentrations of chlorpheniramine were detected by LC-MS and pharmacokinetic parameters of 2 groups were calculated using Graphpad prism 5.01.ResultsThe AUC(0-∞)of experimental group[1.40±0.27(μg·h)/mL]was higher than that of control group[0.87±0.25(μg·h)/mL], while the CLintof experimental group[14.25±2.84(L·kg)/h]was obviously lower than that of control group[22.97±2.03(L·kg)/h](P< 0.05). ConclusionThese results demonstrates that Bupleurum smithii extract can decrease the CLintof chlorpheniramine, clinical medication should try to avoid combination of 2 drugs.
Bupleurumsmithiiextract; chlorpheniramine; CYP2D6; interaction
国家自然科学基金(81370403)
高柳柳,女,硕士,研究方向:药物代谢与动力学E-mail:coucoi1234@sina.com;于超,通讯作者,男,博士,教授,研究方向:药物代谢与动力学,E-mail:yuchaom@163.com。
R969
A
1005-1678(2015)02-0165-04
