脂氧素在对乙酰氨基酚所致急性肝损伤中的保护作用及机制研究
2015-07-07李世清杜宗汉周晓晴罗君安启娴靳斌
李世清,杜宗汉,周晓晴,罗君,安启娴,靳斌
(1.川北医学院第二临床学院,南充市中心医院 消化内科,四川 南充 637000;2.云南省第二人民医院 消化内科,云南 昆明 650032;3.山东大学 临床医学系,山东 济南 250100)
脂氧素在对乙酰氨基酚所致急性肝损伤中的保护作用及机制研究
李世清1,杜宗汉1,周晓晴1,罗君1,安启娴2,靳斌3
(1.川北医学院第二临床学院,南充市中心医院 消化内科,四川 南充 637000;2.云南省第二人民医院 消化内科,云南 昆明 650032;3.山东大学 临床医学系,山东 济南 250100)
目的 探讨脂氧素A4(lipoxin A4,LXA4)在对乙酰氨基酚所致肝损伤中的保护作用及可能机制。方法 100只雄性新西兰大白兔随机分为空白对照组、对乙酰氨基酚组(PCM组)、N-乙酰半胱胺酸组(NAC组)和脂氧素A4组(LXA4组)4组,每组25只。除空白组兔外给其他3组兔对乙酰氨基酚灌胃24 h后NAC组静脉注射NAC,LXA4组静脉注射LXA4,36 h后,麻醉动物取肝脏组织进行免疫组化及RT-PCR分析并检测肝组织中TNF-α和IL-10的表达,Western blot检测NF-κB p65的表达。结果 PCM组NF-κB p65的表达水平明显高于空白对照组(P<0.01),NAC、LXA4治疗组NF-κB p65的表达显著低于PCM组且具有统计学意义(P<0.01)。对乙酰氨基酚组肝脏组织中TNF-α mRNA水平高于脂氧素A4组和空白对照组(P<0.05)。脂氧素A4组中IL-10 mRNA表达水平明显高于对乙酰氨基酚组(P<0.05)。结论 脂氧素A4 通过抑制对乙酰氨基酚中毒所致急性肝损伤中NF-κB p65的活化,下调促炎因子TNF-α基因的表达,促进抗炎因子IL-10基因的表达,从而控制炎症反应进程,继而发挥其肝脏保护作用。
对乙酰氨基酚;急性肝损伤;脂氧素A4
对乙酰氨基酚是目前临床上仍广泛使用的退热镇痛药。在正常的治疗剂量之下其副作用较为少见,因而通常被认为是一种比较安全的药品,但短时间内大量服用则会引肝脏损伤,严重时导致肝功能衰竭甚至死亡[1-2]。在我国,对乙酰氨基酚广泛应用于感冒所致的发热、头痛的药物。发达国家中对乙酰氨基酚肝中毒是急性肝功能衰竭所致死亡最为常见的原因之一。因此,近年来,该药的过量使用和滥用所引起的不良反应和严重的肝脏毒性越发引起临床和基础研究者的关注[3]。脂氧素A4(lipoxin A4,LXA4)是脂氧素(lipoxins,LXs)家族的一员,其对多种炎症反应具有重要的调节作用,常被称为炎症反应的“刹车信号”,或者“停止信号”,此外,脂氧素A4在机体的免疫调解中同样具有重要的调节作用。脂氧素A4在多种组织器官的缺血再灌注中具有保护作用,同时调节炎症因子表达。本文使用灌胃法成功建立对乙酰氨基酚中毒的新西兰大白兔模型。在对乙酰氨基酚中毒后期使用脂氧素A4治疗,观察脂氧素A4对于对乙酰氨基酚中毒兔肝脏损伤的保护作用,探讨脂氧素A4在对乙酰氨基酚中毒所致急性肝损伤中的保护作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物:SPF级雄性新西兰大白兔100只(编号:16655759268231),体质量为2.5~3.0kg,SPF级,由川北医学院动物实验中心提供,实验前自由饮水,禁食24 h。
1.1.2 主要试剂:甲酯化脂氧素A4(Cayman,美国);水合氯醛(北京化学试剂公司);2,3,5-三苯基氯化四氮唑(天津市化学试剂研究所);N-乙酰半胱氨酸(宁波科瑞生物工程有限公司);对乙酰氨基酚(上海施贵宝制药);TNF-α 免疫组化S-P 试剂盒、IL-10 免疫组化S-P 试剂盒、NF-κB p65免疫组化S-P 试剂盒(英国Abcam 公司);TUNEL 检测试剂盒(Boehringer Mannheim 公司);PBS 粉剂(北京中杉金桥公司)。多聚甲醛(北京中杉生物技术有限公司);无水乙醇(江阴市瑞通化工贸易有限公司),NF-κB p65和Anti-β-actin 抗体(Santa cruz),辣根过氧化物酶(北京中杉金桥公司)。
1.1.3 主要设备:手提式压力灭菌消毒器(上海申安医疗器械厂);YJ-875S 超净工作台(苏州净化设备厂);SZ-97 自动三重纯水蒸馏器(上海亚荣生化仪器厂);M-6 离心机(美国Beckman 公司); HJ-3 磁力搅拌器(深圳天南海北实业有限公司);Eppendorf 1000 μL,200 μL,10 μL 自动移液器(德国Eppendorf 公司);电子天平(AE200 型,瑞典梅特勒-托利多仪器有限公司);BS60 三用恒温水箱(北京医疗设备厂);300 ℃恒温烘箱(北京医疗设备厂);HQ45 恒温摇床(中国科学院武汉科学仪器厂);微波炉(顺德市格兰仕电器实业有限公司);YL3 回转式切片机(北京手术器械厂产品);OLMPUS AU2700全自动生化分析仪(日本OLMPUS公司);UV-754 紫外分光光度计(上海第三分析仪器厂)。
1.2 方法
1.2.1 实验动物分组:100只新西兰大白兔随机分为4组,每组25只。常规麻醉后,空白对照组给予生理盐水灌胃;对乙酰氨基酚组(PCM组)给予对乙酰氨基酚灌胃(300 mg/kg);N-乙酰半胱胺酸组(NAC组)在对乙酰氨基酚灌胃(300 mg/kg)24 h后,给予负荷剂量的N-乙酰半胱胺酸(140 mg/kg)静脉注射治疗;脂氧素A4 组(LXA4)在对乙酰氨基酚灌胃(300 mg/kg)24 h后,给予脂氧素A4(1.5 μg/kg)静脉注射;各组兔均在灌胃后36 h后进行组织标本制备,并进行生化分析。
1.2.2 Western blot检测各组兔肝脏组织内NF-κB p65的表达:将30~60 μg样品放在SDS聚丙烯酰胺凝胶上进行电泳,4 ℃条件下转膜过夜。转膜完成后,将硝酸纤维素膜封闭液封闭,室温轻摇1 h。一抗反应:加入用封闭液稀释的一抗10 mL(抗NF-κB p65、actin特异抗体,1:1000稀释),4 ℃轻摇过夜或者室温2 h。漂洗滤膜3次,每次10 min。二抗反应:将膜用封闭液稀释的辣根过氧化物酶标记的相应抗体(稀释浓度为1:2000),室温轻摇1 h。漂洗滤膜3次。ECL法显色 :将等体积ECL试剂A液、B液,混合均匀加到转印膜上,反应5 min。暗室曝光,曝光1~2 min,显影、定影,自来水充分冲洗。蛋白质定量分析: X光片用Mixrotek ScanWizard 5扫描软件进行电脑扫描、Quantity one 7.0图像分析软件作灰度分析。
1.2.3 RT-PCR检测肝脏组织中TNF-α及IL-10 mRNA 表达:引物 TNF-α(90bp):5′-GGCAGGTCTACTTTGGAGTCA-TTGC-3′,5′ACATTCGA-GGCTCCAGTGAATTCGG-3′;IL-10(100bp):5′-CCAGTTTTACCTGGTAGAAGTGATG-3′,5′-TGTCTAGGTCCTGG-AGTCCAGCAGA-3′;β-actin:5′-TGGAATCCTGTGGCATCCAT-GAAAC-3′,5′-TAAAACGCAGCTCAGTAACAGTCCG-3′。
采用20 μL PCR 反应体系:纯水12 μL,10×PCR缓冲液2 μL,25mMMgCl21 μL,10mM dNTP 0.5 μL,10 μM的上、下游引物各1 μL,Taq聚合酶1 U,DNA模板2.5 μL。PCR循环条件为: 94 ℃预变性3 min, 94 ℃变性30 s, 60 ℃退火30 s, 72 ℃延伸50 s,共计35个循环。用1.5%琼脂糖凝胶电泳,以标准DNA Marker为参照鉴定PCR扩增产物。
1.2.4 免疫组化检测NF-κBp65的表达:①组织切片脱蜡、水化、PBS洗2~3次;②滴加3%H2O2(80%甲醇)室温静置10 min;③PBS洗2~3次后抗原修复;④PBS洗2~3次滴加正常山羊血清封闭液,20 mn后甩去多余液体;⑤滴加Ⅰ抗(抗NF-κB p65、actin特异抗体,1:1000稀释)37 ℃1 h,PBS洗3次;⑥滴加辣根过氧化物酶标记的相应Ⅱ抗(稀释浓度为1:2000,加入0.05%的Tween-20);⑦PBS洗3次,DAB显色,镜下掌握染色程度;⑧自来水冲洗,苏木精复染,盐酸酒精分化;⑨自来水冲洗、脱水、透明、封片、镜检。结果判断:根据细胞染色强度分为4级,并分别记分:阴性细胞(-)无显色;弱阳性细胞(+)显色为浅黄色;中度阳性细胞(++)显色为棕黄色;强阳性细胞(+++)显色为棕褐色。
1.2.5 肝脏细胞凋亡的TUNEL试剂盒检测:细胞固定、浸洗;加入Proteinase K处理细胞15 min,浸洗; 4%多聚甲醛固定细胞5 min,浸洗;细胞中加平衡液,湿盒平衡10 min;后滴加TUNEL反应混合液:加TUNEL反应混合溶液;暗湿盒中反应37 ℃×1 h、浸洗;之后加转化剂-POD,在湿盒37 ℃×30 min,浸洗;加入DAB显色(避光),镜下观察显色情况;去离子水冲洗,苏木精复染;自来水冲洗、脱水、透明、封片、镜检。结果判定:细胞核固,缩有的呈碎片状,不规则,大小不一致,呈棕黄色颗粒者为阳性细胞,即凋亡的细胞。
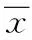
2 结果
2.1 各组肝脏组织中NF-κB p65蛋白的表达 Western blot结果显示,同空白对照组比较,PCM组中NF-κBp65的表达显著升高(P<0.01),而与PCM组相比,NAC、LXA4治疗组NF-κB p65的表达显著降低,差异具有统计学意义(P<0.01,见图1)。免疫组化结果显示,PCM组NF-κB p65阳性表达率最高,NAC组次之,脂氧素A4组较低,而空白对照组阳性表达率最低。见图2。

图1 肝脏组织中NF-κB p65的表达#P<0.01,与对照组比较;*P<0.01,与PCM组比较Fig.1 Expression of NF-κBp65 in liver tissue#P<0.01,compared with control group;*P<0.01,compared with PCM group
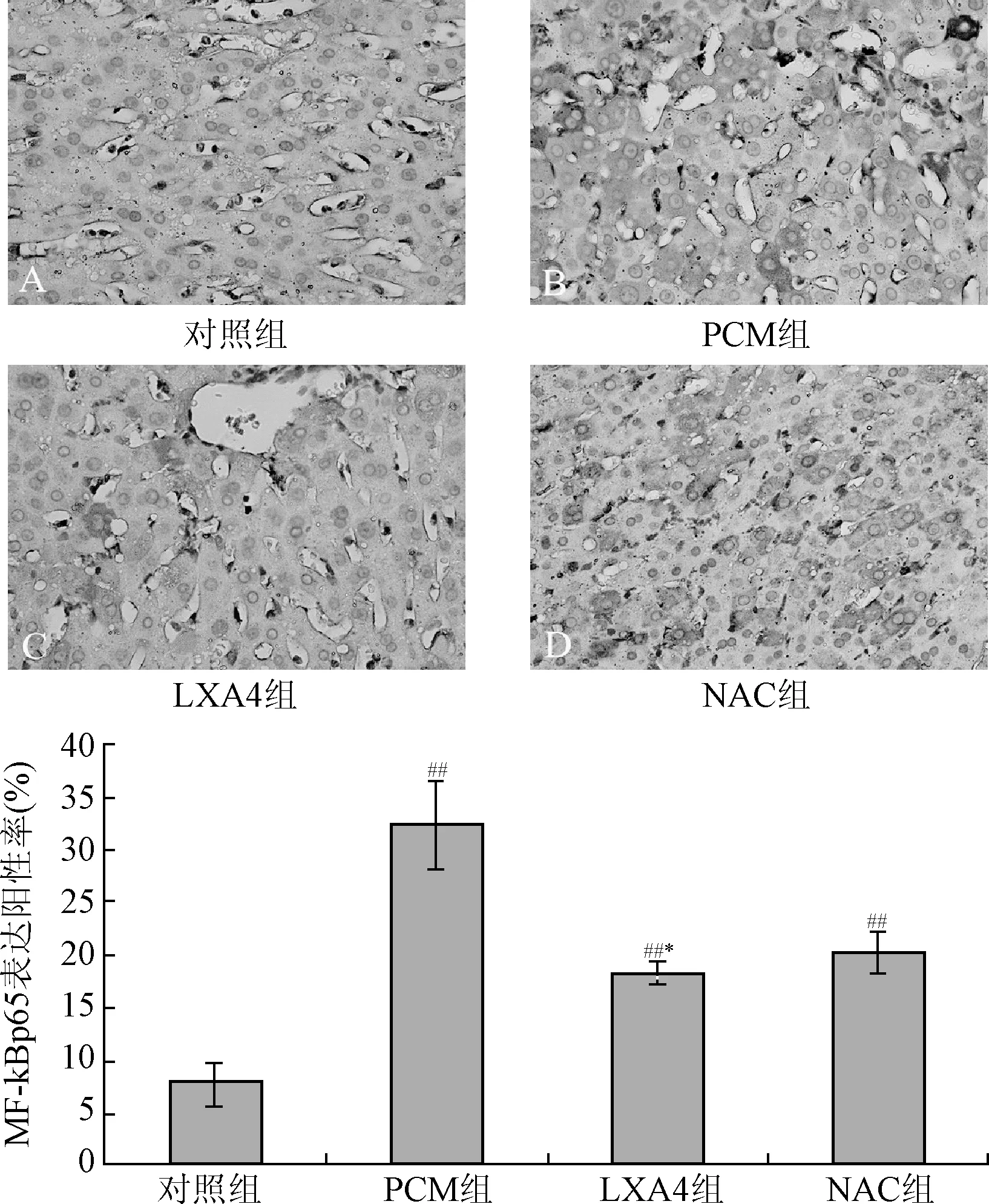
图2 肝组织NF-κB p65表达阳性率(×400)#P<0.01,与对照组组比较;*P<0.05,与PCM组比较Fig.2 Expression of NF-κBp65 positive rate in liver tissue(×400)#P<0.01,compared with control group;*P<0.05,compared with PCM group
2.2 肝脏组织中TNF-α、IL-10表达水平 RT-PCR结果显示,对乙酰氨基酚组肝脏组织中TNF-αmRNA水平显著升高,明显高于脂氧素A4组N-乙酰半胱氨酸组和空白对照组,且差异具有统计学意义(P<0.05)。相反地,脂氧素A4组中IL-10 mRNA表达水平明显高于对乙酰氨基酚组,差异同样具有统计学意义(P<0.05),见表1。免疫组化结果与RT-PCR结果相符合,与对乙酰氨基酚组比较,LXA4组中TNF-α阳性表达率明显降低,而IL-10阳性表达率显著升高(P<0.05),见图3,4。
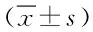
表1 细胞因子TNF-αmRNA和IL-10 mRNA的表达Tab.1 Expression of cytokines TNF-α and ±s)
#P<0.05,与对照组比较,compared with control group;*P<0.05,与PCM组比较,compared with PCM group

图4 肝组织IL-10 表达阳性率(×400)#P<0.05,与对照组比较;*P<0.05,与PCM组比较Fig.4 The positive rates of IL-10 expression in liver tissue(×400)#P<0.05,compared with control group;*P<0.05,compared with PCM group
3 讨论
本研究通过建立兔急性对乙酰氨基酚中毒模型,探讨了脂氧素A4在对乙酰氨基酚中毒所致急性肝损伤中可能的保护机制。研究结果显示,同空白对照组比较,对乙酰氨基酚组(PCM组)中NF-κB p65的表达显著升高,而在脂氧素A4(LXA4)治疗组中,NF-κB p65的表达显著降低。于此同时,RT-PCR结果显示,对乙酰氨基酚组肝脏组织中TNF-α mRNA水平显著升高,明显高于脂氧素A4组和空白对照组。相反,脂氧素A4组中IL-10 mRNA表达水平明显高于对乙酰氨基酚组。该研究结果提示,脂氧素A4可能通过抑制NF-κB p65的活化,下调了促炎因子的表达而上调了抑炎因子的表达,从而控制了肝损伤过程中的炎症反应进程,从而发挥其肝脏保护作用。
研究证实LXA4对缺血再灌注损伤的保护作用不仅仅局限于肾脏。实际上,ATL可以抑制由于肢体缺血再灌注引起的肺内PMN浸润,表明LXA4和ATL可以阻止应激反应,如在围手术期药物使用过程中观察到的一样。在此过程中,LXA4和ATLa可减少兔肝脏细胞缺血再灌注诱导的趋化因子和细胞因子诱导的中性粒细胞趋化因子(CINC)-1表达水平[4]。另外,在阻塞大脑中动脉引起的短暂性局部脑缺血兔模型中,经脑室给与LXA4类似物可以减小梗塞体积,减轻神经系统体征。促炎症因子TNF-β1和IL-1β的下调可以在缺血脑组织中观察到[5]。LXA4-IL10轴似乎在缺血再灌注损伤保护机制中扮演着相关角色,因为LXA4并不能减轻IL-10缺乏小鼠的炎症和组织损伤[6]。此外,众多研究显示LXA4通过抑制NF-κB p65的活性来发挥其抗炎作用。有学者[7-9]研究显示在兔心跳骤停复苏后,LXA4可以通过抑制NF-κB p65的活性而减轻心肌组织中的炎症反应,从而减轻兔心肌损伤,提高其存活率。此外,有研究显示,LXA4可以通过抑制NF-κB p65的活化而减轻巨噬细胞和肠上皮细胞中的炎症反应[10]。本研究中,LXA4通过抑制NF-κB p65的活化,下调了促炎因子TNF-α的表达,同时促进了抗炎因子IL-10的表达,从而减轻了肝脏组织中的炎症反应进程。众多的研究证实,LXA4可以发挥明显的抗炎效应,其可以通过抑制NF-κB p65的活化进而抑制促炎因子TNF-α,IL-1β,IL-6,IL-8,以及血小板活化因子(PAF)的表达[10-12]。NF-κB p65作为转录因子,其也可以调控凋亡相关基因的表达,从而发挥促凋亡作用[13-15]。前一部分研究也显示,LXA4治疗组中肝细胞的凋亡明显减轻,这或许与LXA4抑制了NF-κB p65的活化有关。
脂氧素A4可以抑制对乙酰氨基酚中毒所致肝损伤中NF-κB p65的活化,继而抑制促炎因子TNF-α基因的表达,促进抗炎因子IL-10基因的表达,从而控制急性肝损伤中的炎症反应进程,从而发挥其保护作用[16]。
[1] Altavilla D, Saitta A, Squadrito G,et a1.Evidence for a role of nuclear—kappa B in acute hypovolemic hemorrhagic shock Surgery,2002,131:502-581.
[2] Remick DG,Call DR,Ebong SJ,et al.Combination immunotherapywith soluble tulnor necrosis factor receptors plus interleukin l receptor antagonist decreases sepsis mortality[J].Crit Care Med,2001,29(3):473-481.
[3] Wang T, Zhang X, Li JJ.The role of NF-kappaB in the regulation of cell stress responses[J].Immunopharmacol, 2002,2(11):1509-1520.
[4] Yamamoto Y, Gaynor RB.Therapeutic potential of inhibition of the NF-kappaB[J].Immunopharmacol,2001, 107(2): 135-142.
[5] Alkalay I, YaronA, Hatzubai A, et a1.Stimulation-dependent I kappa B alpha phosphorylation marks the NF-kappa B inhibitor for degradation via the ubiquitinproteasome pathway[J].Proc Natl Acad Sci US A ,1995,92(23): 10599-10603.
[6] Jin SW;Zhang L;Lian QQ.Posttreatment with Aspirin-Triggered Lipoxin A4 Analog Attenuates Lipopolysaccharide-lnduced Acute Lung Injury in Mice:The Role of Heme Oxygenase-1[J].Anesthesia and Analgesia,2007,104(2):369-377.
[7] Scully M,Gang C,Condron C,et al.Protective role of cyclooxygenase (COX)-2 in experimental lung injury: Evidence of a lipoxin A 4-mediated effect[J].Journal of Surgical Research,2012,175(1):176-184.
[8] Samuelsson.An elucidation of the arachidonic acid cascade.Discovery of prostaglandins, thromboxane and leukotrienes[J].Drugs,1987,33(Suppl 1): 2-9.
[9] Chen Z, Wu Z, Huang C, et a1.Effect of lipoxin A4 on myocardial ischemia reperfusion injury following cardiac arrest in a rabbit model[J].Inflammation,2013 ,36(2):468-475.
[10] Kakazu A,He J,Kenchegowda S,et al.Lipoxin A4 inhibits platelet-activating factor inflammatory response and stimulates corneal wound healing of injuries that compromise the stroma[J].Experimental Eye Research,2012,103(2):9-16.
[11] Pamplona F A,Ferreira J,De Lima Jr.O M,et al.Anti-inflammatory lipoxin A_4 is an endogenous allosteric enhancer of CB1 cannabinoid receptor[J].Proceedings of the National Academy of Sciences of the United States of America,2012,109(51):21134-21139.
[12] Pertwee R G..Lipoxin A4 is an allosteric endocannabinoid that strengthens anandamide-induced CB_1 receptor activation (Note)[J].Proceedings of the National Academy of Sciences of the United States of America,2012,109(51):20781-20782.
[13] Luo CL,Li QQ,Chen XP,et al.Lipoxin A4 attenuates brain damage and downregulates the production of pro-inflammatory cytokines and phosphorylated mitogen-activated protein kinases in a mouse model of traumatic brain injury[J].Brain research,2013,150(2):1-10.
[14] Das UN.Arachidonic acid and lipoxin A4 as possible endogenous anti-diabetic molecules[J].Prostaglandins, Leukotrienes, and Essential Fatty Acids,2013,88(3):201-210.
[15] Wu SH,Chen XQ,Liu B,et al.Efficacy and safety of 15(R/S)-methyl-lipoxin A4 in topical treatment of infantile eczema[J].British Journal of Dermatology,2013,168(1):172-178.
[16] 何维佳,常克.脂氧素在炎症反应中的作用研究进展[J].西部医学,2010,22(12):2335-2336.
(编校:王俨俨,谭玲)
Role of lipoxin in preventing paracetamol-induced acute hepatic injury and its mechanism
LI Shi-qing1,DU Zong-han1,ZHOU Xiao-qing1,LUO Jun1,AN Qi-xian2,JIN Bin3
(1.Department of Gastroenterology, Second Clinical College of North Sichuan Medical College, Municipal Nanchong Central Hospital, Nanchong 637000, China; 2.Department of Gastroenterology, The Second People’s Hospital of Yunnan Province, Kunming 650032, China; 3.Department of Clinical Medicine, Shandong University, Ji’nan 250100, China)
ObjectiveTo investigate the potential role of the lipoxin A4 in preventing paracetamol (PCM)-induced hepatic injury, and reveal its possible related signal path.Methods100 adult male New Zealand white rabbits were randomly divided into five groups, 20 rabbits in each group: Control group; PCM group; NAC group; LXA4 group; LXA4+NAC group.The rabbits were treated with paracetamol for 36 h by gastric lavage, then given NAC of NAC group,LXA4 of LXA4 group,after 24 h,the rabbits anesthetized were removed liver in which TNF-αand IL-10 were analyzed by immunohistochemistry and RT-PCR method.The expression of NF-κB p65 were detected by Western blot.ResultsThe activation of NF-κB p65 was inhibited by lipoxin A4 in patients of paracetamol-induced hepatic injury, and the expression of NF-κB p65 significantly decreased in LXA4 group compared with PCM group with statistically significant difference (P<0.01).What’s more, the expression of TNF-α and TNF-αmRNA in liver of LXA4 group decreased, conversely, IL-10 mRNA levels increased significantly, and there were statistical differences, respectively (P<0.01). ConclusionLipoxin A4 could control inflammation in paracetamol-induced acute heaptic injury via activation inhibition of NF-κB p65, down regulation of proinflammatory cytokine TNF-α level and up regulation of anti-inflammatory cytokine IL-10, which manifests a protective effect on liver protection.
paracetamol; acute hepatic injury; lipoxin A4
山东省自然科学基金(Y2008C10)
李世清,男,硕士,主治医师,研究方向:消化道肿瘤及癌前状态疾病、慢性肝病的防治,E-mail:lsq18258062152@126.com。
R575.3
A
1005-1678(2015)02-0088-04
