中枢内神经化学物质在癌症侵袭镜像痛中的作用及加巴喷丁对其的影响
2015-07-07孙丹丹王志国李涛赵小亮刘洋李玉娟欧阳竞锋牛晓红王丹巧
孙丹丹,王志国,李涛,赵小亮,焦,刘洋,李玉娟,欧阳竞锋,牛晓红,王丹巧
(中国中医科学院医学实验中心,北京市中医药防治重大疾病基础研究重点实验室,北京 100700)
中枢内神经化学物质在癌症侵袭镜像痛中的作用及加巴喷丁对其的影响
(中国中医科学院医学实验中心,北京市中医药防治重大疾病基础研究重点实验室,北京 100700)
目的 研究脊髓组织神经化学物质谷氨酸(glutamate,Glu)、γ-氨基丁酸(γ-aminobutyric acid,GABA)及大脑皮质内P物质(substance P,SP)和强啡肽A1-13(dynorphin A1-13,DynA1-13)在癌症侵袭镜像痛中的作用及加巴喷丁对其影响。方法 雄性BALB/c小鼠随机分为正常组、操作对照组(注射0.2 mL灭活的S180肉瘤细胞液)、模型组(于右腿股骨大转子处注射0.2 mL S180肉瘤细胞液)和加巴喷丁组(0.2 mL S180肉瘤细胞液+120 mg/kg加巴喷丁,ip),造模前及术后分别用Von Frey 纤维丝测定术侧及对侧后足的机械痛阈值;采用高效液相-荧光法检测脊髓L3-L5节段内Glu、GABA浓度;放射免疫法检测大脑皮质内SP、DynA1-13的含量。结果 伴随术侧癌症侵袭痛的产生,模型组小鼠术侧的镜像部位出现了与术侧发展趋势相同、程度近似的机械痛阈下降。模型组小鼠脊髓内Glu 及大脑皮质内SP水平均显著升高(P<0.05,P<0.01),而脊髓内GABA及大脑皮质内Dyn A1-13的含量均显著降低(P<0.05);加巴喷丁给药后小鼠双侧的机械痛阈值均显著升高,可持续240 min(P<0.05,P<0.01),并逆转了癌症侵袭镜像痛小鼠中枢神经系统内上述神经化学物质的改变(P<0.01或P<0.05)。结论 S180肉瘤细胞所致癌症侵袭痛模型小鼠存在镜像痛现象,脊髓内Glu、GABA及大脑皮质中SP、Dyn A1-13可能参与癌症侵袭镜像痛的发生和维持机制,加巴喷丁通过这一机制对癌症侵袭镜像痛模型小鼠发挥镇痛作用。
镜像痛;癌症侵袭痛;加巴喷丁;神经化学物质
在躯体损伤部位的对侧对称部位(镜像部位)出现疼痛和痛觉过敏的病症称之为镜像痛。临床上,一些严重的慢性疼痛及复杂区域疼痛综合征患者均可出现镜像痛,其中,癌症疼痛出现的镜像痛既严重影响患者的生存质量又干扰癌症的治疗,是临床医生面临的棘手问题。由于镜像痛发生、发展与维持的机制至今尚不十分清楚,治疗效果也不理想。据研究报道,许多神经病理性疼痛、炎性疼痛等多种动物模型均可以观察到双侧痛觉敏感的现象[1-2],大鼠胫骨转移性癌痛模型也出现镜像痛现象[3],但临床上频发的肿瘤浸润引起的癌症侵袭痛(cancer invasion pain,CIP)的动物模型是否出现镜像痛?相关机制如何?目前鲜见报道。
本实验拟采用S180肉瘤细胞构建小鼠CIP模型,采用 Von Frey 纤维丝测定小鼠肿瘤细胞接种侧及对侧后足的机械痛阈值,确认CIP模型小鼠是否发生镜像痛,并观察加巴喷丁对其的影响;进一步将采用HPLC-FLD法检测脊髓内与疼痛发生和维持密切相关的兴奋性和抑制性氨基酸谷氨酸(glutamate,Glu)、γ-氨基丁酸(γ-aminobutyric acid,GABA)水平,放射免疫法检测大脑皮质内源性致痛和镇痛物质P物质(substance,SP)、强啡肽A1-13(dynorphin A1-13,DynA1-13)的含量,探讨中枢神经系统上述物质在CIP镜像痛机制中的作用,为CIP镜像痛的机制研究和治疗提供参考。
1 材料与方法
1.1 材料
1.1.1 实验动物:SPF级BALB/c雄性小鼠63只,体质量18~20 g,购于中国食品药品检定研究院,许可证号:SCXK(京)2014-0013。
1.1.2 瘤株、主要药品及试剂:S180肉瘤细胞系中国中医科学院中药所惠赠;加巴喷丁(江苏恒瑞医药股份有限公司,批号:14031491 No.121);SP和DynA1-13放免试剂盒(中国人民解放军第二军医大学,批号:20150120);Glu,GABA,乙酸钠,硼酸(均为 Sigma 公司);甲醇、四氢呋喃(均为Fisher Chemicals),邻苯二甲醛(Aldrich 公司);β-巯基乙醇(Amresco 公司)。
1.1.3 主要仪器:51000-20C Von Frey hairs 疼痛测试包(美国Danmic公司);XH6080型放射免疫γ计数仪(中国核工业总公司国营二六二厂);台式高速离心机(德国Eppendorf,5417R);倒置显微镜(奥林巴斯,CKX41);组织研磨仪(IKA,T10 basic ULTRA-TURRAX);HPLC检测系统(德国Sykam S-2100,G1321 A 荧光检测器,Agilent ZORBAX Eclipse AAA 色谱柱及化学工作站)。
1.2 方法
1.2.1 分组、造模:将冻存的S180肉瘤细胞注射于健康小鼠腹腔,使其产生癌性腹水,收取后分装冻存。冻存腹水瘤细胞复苏后,台盼蓝染色计数,调整活细胞浓度1×107个/mL,置于冰盒内备用。将上述小鼠连续3 d进行预刺激(0.16 g纤维丝刺激小鼠双侧的后足),第4天将右后足机械痛阈值≥0.4 g的53只小鼠随机分为正常组(Native组,n=13)、操作对照组(Sham组,n=13)、手术组(Surgery组,n=27)。Surgery组小鼠于右腿股骨大转子(相当于坐骨神经分支部位上方)注射0.2 mL瘤细胞液,Sham组于相同部位注射相同体积相同浓度灭活的瘤细胞液。瘤细胞灭活方法:沸水中煮沸15 min,然后台盼蓝染色确定无活细胞。Native组不作任何操作。
1.2.2 行为学评价及药效观察:采用机械触痛法[4]测定小鼠对机械刺激反应的痛阈值。将待测小鼠放在自制的0.5 cm×0.5 cm金属网孔的疼痛测试架上,用透明塑料盒罩住,其足部可暴露于金属网孔中,待其探究活动基本消失后,依次用标准化的不同刺激力度(0.008、0.02、0.04、0.07、0.16、0.4、0.6、1、2 g)Von Frey纤维丝,从0.008 g开始,以1次/s的频率,垂直刺激小鼠双侧后肢足爪底中外侧皮肤表面,观察小鼠的缩足反应,连续试验5次,记录出现3次或3次以上缩足反应的最小纤维丝值作为小鼠的机械痛阈值。
术后第2、3、4、5、6、7天测评小鼠术侧及对侧后足的机械痛阈值,将术后5~7 d连续3 d机械痛阈值≤0.07 g的成模小鼠,随机分为加巴喷丁组(GBP)和模型组(Model),每组12只。加巴喷丁组于造模术后第8、9、10天腹腔注射加巴喷丁120 mg/kg,1次/d,Model组、Sham组、Native组腹腔注射相同体积的生理盐水。并于第10天给药前及给药后30、60、90、120、180、240 min等时间点测评术侧、对侧后足的机械痛阈值。
1.2.4 脊髓内Glu及GABA 水平测定:末次行为学测评的次日,再次给药45 min后,安抚小鼠并脱颈椎断头处死,将小鼠身体放在冰上,用剪刀剪开皮肤、剥离肌肉,从脊髓断点处剪开椎板,暴露脊髓后取L3-L5段脊髓,称量,加入1 mL冰生理盐水,使用组织匀浆仪充分匀浆后,经去蛋白及微粒等前处理得到脊髓匀浆的处理液。采用HPLC-FLD法,检测脊髓组织内的Glu、GABA含量,具体检测方法参照文献[5]。
1.2.5 大脑皮质内SP及DynA1-13含量测定:小鼠断头后迅速剥离全脑,在冰上分离大脑皮质,放入生理盐水中煮沸5 min,取出称量后,置于玻璃匀浆管内加入1 N HCl 1mL充分匀浆,室温放置100 min,4 ℃ 4000 r/min离心20 min,取上清750 μL,再加入等量的1N NaOH中和酸,采用放射免疫法,按照试剂盒说明书要求测定SP及DynA1-13的含量。

2 结果
2.1 CIP模型小鼠镜像痛观察 术后2~7 d连续评价各组小鼠术侧、对侧的机械痛阈值,发现Surgery组小鼠术侧机械痛阈值在术后第2天较Native组明显下降(P<0.05),第4~7天均稳定维持在(0.030±0.004)g~(0.065±0.024)g,明显低于Sham组和Native组(P<0.05,P<0.01)。Sham组小鼠的术侧机械痛阈值在第2天亦降低,但随后逐渐回升,第5天以后达到Native组水平,见图1A;Surgery组小鼠对侧机械痛阈值亦在术后第2天明显下降(P<0.05),第4~7天均稳定维持在(0.062±0.017)g~(0.156±0.085)g,明显低于Sham组和Native组(P<0.05,P<0.01),见图 1B。表明CIP模型小鼠对侧发生了与术侧CIP趋势相同、程度近似的镜像痛。

图1 CIP模型小鼠术侧(A)和对侧(B)后足机械痛阈值变化±SE)*P<0.05,**P<0.01,与Native组相比;#P<0.05,##P<0.01,与Sham组相比 Fig .1 Changes of mechanical withdrawal threshold of the ipsilateral and contralateral hind paw on CIP model ±SE)*P<0.05,**P<0.01,compared with Native group;#P<0.05,##P<0.01,compared with Sham group
2.2 加巴喷丁对CIP镜像痛小鼠术侧及对侧后足机械痛阈值的影响 第3天给药前小鼠双侧机械痛阈值测评结果见图 2。术侧的机械阈值在给药后30 min明显升高,达到(1.77±0.16)g,在观察的240 min内所有时间点的机械阈值较Model组均显著升高(P<0.01,P<0.05),见图2A;对侧的机械阈值也在给药后30 min明显升高,达到(1.52±0.19)g,在观察的240 min内所有时间点的机械阈值较Model组均显著升高(P<0.01,P<0.05),见图 2B。表明加巴喷丁对小鼠术侧CIP及健侧镜像痛均有明显镇痛作用。
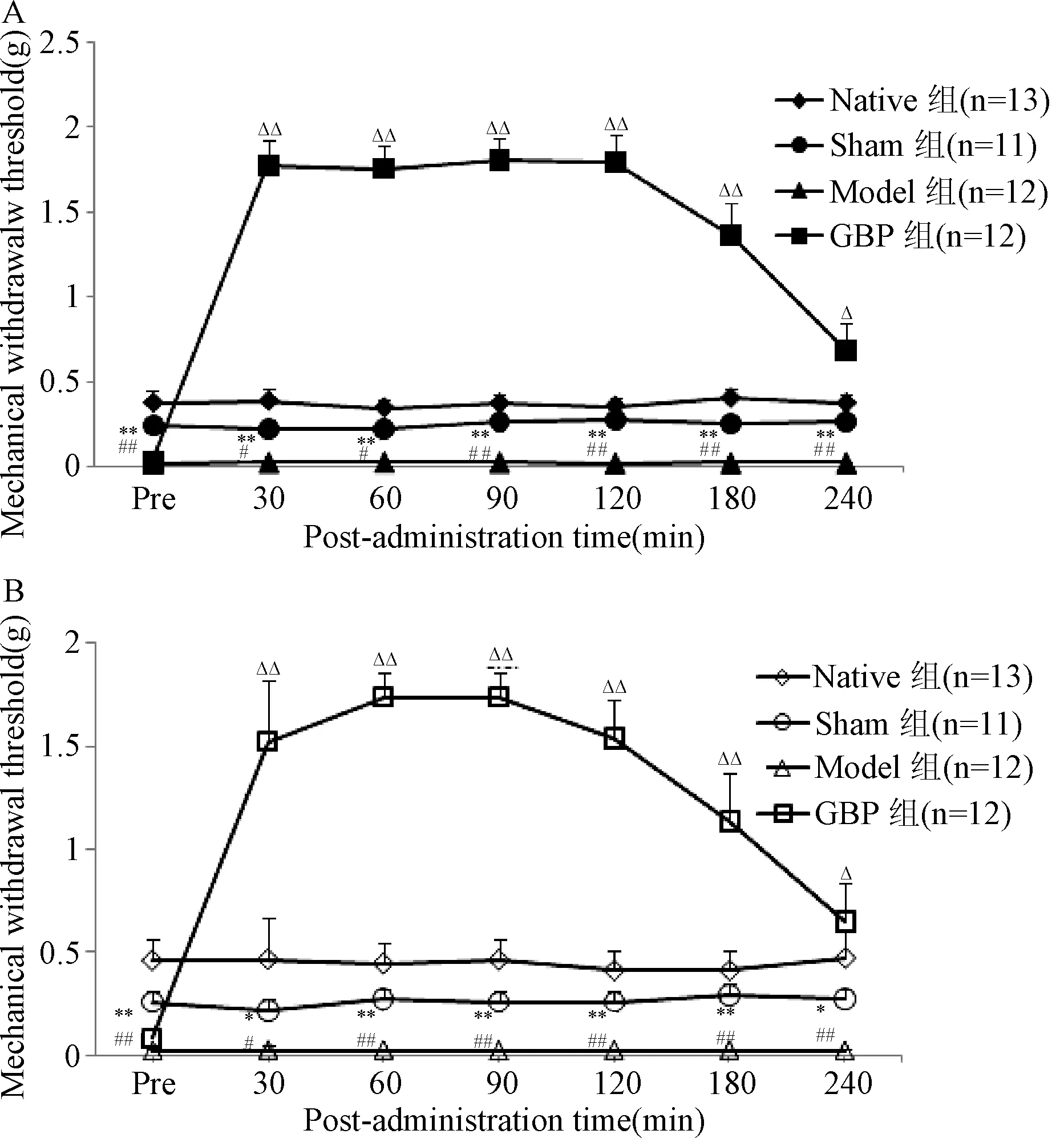
图2 加巴喷丁对CIP模型小鼠术侧(A)和对侧(B)后足机械痛阈值的影响*P<0.05,**P<0.01,与Native组相比;#P<0.05,##P<0.01,与Sham组相比;△P<0.05,△△P<0.01,与Model组相比Fig.2 Effects of gabapentin on mechanical withdrawal threshold of the ipsilateral andcontralateral hind paw of CIP mirror image pain ±SE)*P<0.05,**P<0.01,compared with Native group;#P<0.05,##P<0.01,compared with Model group;△P<0.05,△△P<0.01,compared with Model group
2.3 CIP镜像痛小鼠L3-L5脊髓组织中Glu、GABA水平及加巴喷丁对其的影响 如表1所示,与Native组相比,Model组小鼠脊髓内的Glu水平及Glu/GABA比值显著升高(P<0.05),而GABA水平显著降低(P<0.05)。加巴喷丁能显著抑制CIP模型小鼠脊髓内Glu水平,升高GABA水平,致Glu/GABA比值显著降低(P<0.01)。Sham组小鼠脊髓内Glu水平较Native组显著升高(P<0.05),抑制性氨基酸GABA水平及Glu/GABA的比值差异无统计学意义,可能与注射灭活瘤细胞引起一次性CIP及镜像痛有关。

表1 加巴喷丁对CIP镜像痛小鼠L3-L5脊髓组织内Glu、 GABA 水平的影响Tab.1 Effects of gabapentin on Glu, GABA of the L3-L5 spinal cord of CIP mirror image pain model ±SE)
*P<0.05,与Native组相比,compared with Native group;△△P<0.01,与Model组相比,compared with Model group
2.4 CIP镜像痛小鼠大脑皮质内SP及DynA1-13含量及加巴喷丁对其的影响 SP是内源性的致痛物质,与Native组相比,Model组小鼠大脑皮质内SP含量有显著性升高(P<0.01),加巴喷丁能显著降低CIP镜像痛小鼠大脑皮质内SP含量(P<0.05);与Native组相比,CIP镜像痛Model组内源性的镇痛物质DynA1-13显著降低(P<0.05)。加巴喷丁干预后能显著提高了大脑皮质内DynA1-13含量(P<0.01),见表2。

表2 加巴喷丁对CIP镜像痛小鼠大脑皮质内SP及 DynA1-13含量的影响Tab.2 Effects of gabapentin on SP and DynA1-13 of Cerebral cortex of CIP mirror image pain model ±SE)
*P<0.05,**P<0.01,与Native组相比,compared with Native group;△P<0.05,△△P<0.01,与Model组相比,compared with Model group
3 讨论
关于镜像痛机制的解释,目前被广泛接受的有三大主要假说,即体液学说、神经学说及胶质细胞学说。很多学者认为中枢敏化是产生镜像痛的主要原因[6]。神经系统具有解剖学的对称性,脊髓、下丘脑及大脑皮层等左右两侧存在中间连接[7],表明神经学说关于镜像痛的中枢机制具有组织学基础。起中间连接作用的中间神经元可能通过调节细胞的神经化学信号或电反应模式参与镜像痛的发生和维持。近年来,中枢神经系统胶质细胞激活,通过缝隙连接、钙波及促炎性因子的释放3个途径参与镜像痛的发生的胶质细胞学说在镜像痛发生机制中受到越来越多的关注[8-9]。
本实验直接将复苏后的S180肉瘤细胞通过肌肉注射接种至小鼠坐骨神经周围,术后伴局部肿瘤增长,术侧后足的机械痛阈值明显降低,第4天以后稳定维持在较低水平;对侧镜像部位机械痛阈值变化类似于术侧,程度较术侧略低。研究结果证明小鼠在肿瘤进行性压迫或浸润坐骨神经引起CIP的同时也发生镜像痛现象,并且L3-L5段脊髓内的Glu含量显著升高,GABA含量显著降低;大脑皮质内SP含量显著增加、DynA1-13含量显著降低。而上述神经化学物质含量及其比例关系的变化可能参与了CIP镜像痛发生和维持的机制。
Glu是中枢神经系统内最主要的兴奋性神经递质,SP也是直接参与中枢敏化过程的重要神经递质和调质。在损伤/疼痛状态下,过量的Glu由初级传入神经纤维末端释放,激活脊髓背角神经元细胞膜上的NMDA受体,引起大量Ca2+内流,使神经元发生去极化,一方面增强伤害性感受器和脊髓疼痛传递神经元突触联系,产生痛觉过敏[10],另一方面囊泡膜与突触前膜融合释放SP,SP结合到突触后膜的NK1受体,传递疼痛信息。在这一过程中产生正反馈作用,使突触前膜释放更多的神经化学物质,进一步增强神经元的兴奋性,并由此形成链式反应。神经病理性疼痛及骨癌痛模型大鼠的脊髓、纹状体细胞外液、脑脊液内等均发现Glu、SP含量显著升高[11-13],表明这些变化参与术侧的痛觉过敏机制。然而,这些神经递质通过激活中间神经元的突触后受体传递神经冲动,可跨越到脊髓对侧[14],造成对侧镜像部位产生痛觉或痛敏,这是镜像痛的重要中枢机制之一。Glu、SP等疼痛相关递质还可以直接激活脊髓背角末端的胶质细胞(星形胶质细胞和小胶质细胞),通过使其活化释放大量神经活性物质(兴奋性氨基酸、前列腺素等)和促炎性细胞因子,以旁分泌的方式扩散并作用于对侧脊髓背角,从而激活对侧的胶质细胞和神经元[15]。有研究显示,星形胶质细胞对Glu等信号反应为细胞内Ca2+升高,并通过缝隙连接将Ca2+波传播到相邻的细胞,最终可以到达脊髓损伤部位对侧的胶质细胞[16],这可能是钙波参与镜像痛发生的机制和途径。星形胶质细胞间的钙波传播亦能引起新突触的形成,是长距离信号传播的基础[7]。除脊髓背角外,胶质细胞激活的现象也发生于高级中枢的多个层次,以丘脑和顶部皮层为最多。这种经Glu介导、以钙波形式传递疼痛信息,致使对侧胶质细胞和神经元活化的假说,在镜像痛中枢机制中越来越受关注。
GABA是中枢神经系统中广泛分布的最重要的抑制性神经递质,GABA 能神经元在下行抑制系统起重要作用。内源性痛觉下行抑制系统中重要的核团中央导水管周围灰质及延髓头端腹内侧区的神经末梢40%以上是 GABA 能的,投射神经元有50%的胞体和树突接受GABA能的突触联系[17]。延髓头端腹内侧区向脊髓的投射神经元有50%接受GABA能的突触后抑制[18]。癌侵袭镜像痛脊髓中GABA减少,提示脊髓背角疼痛信号抑制性调控减少,使下行抑制和下行易化系统失衡,导致镜像痛的发生,Glu/GABA的失衡是其标志之一。
强啡肽是内源性阿片肽的一种,是阿片κ受体激动剂,其中DynA1-13是强啡肽家族中主要活性片段之一。Dyn作为一种镇痛介质被广泛用于镇痛效果的评价,但也有研究认为其参与炎症痛及神经病理痛的痛敏过程[19]。脊髓中的强啡肽样免疫活性物质在吗啡内源性镇痛系统中起下行镇痛的作用。大脑皮质、边缘皮质与许多疼痛密切相关的核团之间有直接或间接的往返投射,大脑皮质DynA1-13的降低,可能使内源性镇痛系统下行抑制减弱、下行抑制和下行易化失衡;此外,DynA1-13可能还通过抑制脊髓后角C纤维末梢释放SP而参与镜像痛效应的机制。
加巴喷丁是电压依赖性钙通道α2δ亚单位配体,能有效缓解糖尿病疼痛性神经病变、带状疱疹后遗神经痛、脊髓损伤及幻象肢体疼痛引起的神经性疼痛[20-23]。其生物利用率高,不良反应小,极少和血浆蛋白结合,对肝药酶无影响,临床上联合阿片类药物用于治疗癌痛有协同作用。在癌痛基础研究中,单独应用加巴喷丁亦能明显提高胫骨转移性癌痛模型大鼠的机械痛撤足阈值,改善疼痛[13],然而加巴喷丁对CIP镜像痛的干预作用尚未见报道。本实验结果表明,加巴喷丁不仅对小鼠术侧CIP、而且对对侧的镜像痛均有明显干预作用。关于加巴喷丁镇痛机理的解释,既往有拮抗NMDA受体、拮抗中枢神经系统钙通道和抑制外周神经、增加 GABA 的合成及减少 GABA 的降解等。本研究发现加巴喷丁能显著降低癌侵袭镜像痛模型小鼠脊髓内Glu及大脑皮质内SP含量,显著增加脊髓内GABA及大脑皮质内DynA1-13的含量,推测加巴喷丁可能通过抑制Glu、SP介导的神经元去极化、钙波传导,减少胶质细胞的活化,减少伤害性信息的中枢传导;增加GABA、DynA1-13含量,促使下行抑制系统和下行易化系统平衡,加强内源性的镇痛,从而发挥对癌侵袭镜像痛的镇痛作用。至于加巴喷丁抑制Glu、SP介导的胶质细胞活化的分子机制尚需进一步研究。
综上所述,本文发现并报道了S180肉瘤细胞构建的CIP小鼠模型存在镜像痛的现象,初步探讨了脊髓内Glu、GABA,大脑皮质内SP、DynA1-13在癌症侵袭镜像痛中枢机制中的作用;发现了加巴喷丁对小鼠CIP镜像痛具有镇痛作用,并探讨了其可能的机制。为CIP镜像痛机制的深入研究提供了参考,也为加巴喷丁临床治疗CIP镜像痛提供了一定的药理学依据。
[1] Arguis MJ,Perez J,Martínez G,et al.Contralateral neuropathic pain following a surgical model of unilateral nerve injury in rats[J].Regional Anesthesia and Pain Medicine,2008,33(3):211-216.
[2] Bai ZT, Liu T, Jiang F,et al.Phenotypes and peripheral mechanisms underlying inflammatory pain-related behaviors induced by BmK I, a modulator of sodium channels [J].Exp Neurol,2010,226(1):159-172.
[3] Mao-Ying QL,Zhao J,Dong ZQ,et al.A rat model of bone cancer pain induced by intra-tibia inoculation of Walker 256 mammary gland carcinoma cells[J].Biochem Biophys Res Commun,2006,345(4):1292-1298.
[4] Chaplan SR,Bach FW,Pogrel JW,et al.Quantitative assessments of tactile allodynia in the rat paw [J].J Neurosci Methods,1994,53(1):55-63.
[5] 焦玥,王丹巧,吴兆恩,等.脑内灌流 6-羟基多巴胺对大鼠纹状体细胞外液氨基酸类神经递质的影响及美多芭的作用[J].中国药理学通报,2009,25(8):1055-1059.
[6] Jaggi AS,Singh N.Role of different brain areas in peripheral nerve injury-induced neuropathic pain[J].Brain Res,2011,1381(24):187-201.
[7] Huang DY,Yu BW.The mirror image pain: an unclered phenomenon and its possible mechanism[J].Neurosci Biobehav Rev,2010,34(4):528-532.
[8] Obata H,Sakurazawa S,Kimura M,et al.Activation of astrocytes in the spinal cord contributes to the development of bilateral allodynia after peripheral nerve injury in rats[J].Brain Res,2010,1363(2):72-80.
[9] 李雪飞,许倩,刘建,等.镜像痛的研究进展[J].医学研究生学报,2013,26(2):198-201.
[10] Basbaum AI,Bautista DM,Scherrer G, et al.Cellular and Molecular Mechanisms of Pain[J].Cell,2009,139(2):267-284.
[11] Li CX,Yan LP,Yi JL,et al.Effects of electroacupuncture on the rats with neuropathic pain and EAAs in spinal cord[J].J Acupunct Tuina,2011,9(2):73-78.
[12] 李鹏,张美玉,王丹巧,等.青藤碱对SSNI模型大鼠镇痛效应及脑内兴奋性氨基酸递质的影响[J].中国药理学通报,2012,16(7):662-665.
[13] 张莹,王志国,孙丹丹,等.加巴喷丁对骨癌痛模型大鼠的镇痛作用及机制研究[J].中国生化药物杂志,2014,34(3):8-15.
[14] Lundeberg T,Ekholm J.Pain-from periphery to brain[J].Disabil Rehabil,2002,24(8):402-406.
[15] Abbadie C,Bhanqoo S,De Koninck Y,et al.Chemokines and pain mechanisms[J].Brain Res Rev,2009,60(1):125-134.
[16] Hanani M,Huang YT,Cherkas PS,et al.Glial cell plasticity in sensory ganglia induced by nerve damage[J].Neuroscience,2002,114(2):279-283.
[17] Reichling DB,Bassbaum AI.Contribution of brainstem GABAergic circuitry to descending antinociceptive controls: I.GABA-immunoreactive projection neurons in the periaqueductal gray and nucleus raphe magnus[J].J Comp Neurol,1990,302(2):378-393.
[18] Cho HJ,Basbaum AI .GABAergic circuitry in the rostral ventral medulla of the rat and its relationship to descending antinociceptive controls [J].J Comp Neurol,1991,303(2):316-328.
[19] Yeomans DC,Jones T,Laurito CE,et al.Reversal of ongoing thermal hyperalgesia in mice by a recombinant herpesvirus that encodes human preproenkephalin[J].Mol Ther,2004,9(1):24-29.
[20] Finnerup NB,Otto M,McQuay HJ,et al.Algorithm for neuropathic pain treatment: an evidence based proposal[J].Pain,2005,118(3)289-305.
[21] Rice AS,Maton S.Gabapentin in postherpetic neuralgia: a randomised, double blind, placebo controlled study[J].Pain,2001,94(2):215-224.
[22] Tzellos TG,Papazisis G,Amaniti E,et al.Efficacy of pregabalin and gabapentin for neuropathic pain in spinal-cord injury: an evidence-based evaluation of the literature[J].Eur J Clin Pharmacol,2008,64(9):851-858.
[23] Serpell MG.Gabapentin in neuropathic pain syndromes: a randomised, double-blind, placebo-controlled trial [J].Pain,2002,99(3):557-566.
(编校:吴茜)
Roles of neurochemicals in central nerve system of mirror image pain in cancer invasion pain model and effects of gabapentin on them
SUN Dan-dan,WANG Zhi-guo,LI Tao,ZHAO Xiao-liang,JIAO Yue,LIU Yang,LI Yu-juan, OU YANG Jing-feng,NIU Xiao-hong,WANG Dan-qiaoΔ
(Experimental Research Center, China Academy of Chinese Medical Sciences, Beijing Key Laboratory of TCM Basic Research on Prevention and Treatment of Major Diseases, Beijing 100700, China)
ObjectiveTo study the roles of neurochemicals as Glu, GABA in the spinal cord and SP, DynA1-13in the cerebral cortex of mirror image pain in cancer invasion pain model and the effects of gabapentin on them.MethodsMale BALB/c mices were randomly divided into native group, sham group (injected inactivated S180 sarcoma cell sap), model group (injected 0.2 mL of S180 sarcoma cell sap on the right leg near the greater trochanter of femur) and GBP group (intraperitoneally injected gabapentin 120 mg/kg on the basis of model mice).Mechanical withdraw threshold of the ipsilateral and contralateral hind paw were evaluated by Von Frey hairs before and after surgery.The levels of Glu and GABA in the L3-L5 spinal cord were measured by the high performance liquid chromatography-fluorescence detector (HPLC-FLD) and radioimmunoassay was used to detect the concentrations of SP and DynA1-13in the cerebral cortex.ResultsThe mechanical withdraw threshold of contralateral mirror sites in model mice appeared same trend and approximate degree of decline, following the generation of cancer invasion pain of ipsilateral hind paw.Compared with native group, the concentrations of Glu in the spinal cord and SP in the cerebral cortex in model group were significantly increased (P<0.05,P<0.01), and the levels of GABA in the spinal cord and Dyn A1-13in the cerebral cortex in model group were significantly decreased (P<0.05,P<0.01).Gabapentin could significantly increase the bilateral mechanical withdraw threshold of model mice and the analgesic effect could maintain to 240 min after administration (P<0.05 orP<0.01).Moreover, gabapentin could reverse the changes of above neurochemicals in the central nervous system of mirror image pain in cancer invasion pain model mice (P<0.01 orP<0.05).ConclusionThe mirror image pain phenomenon does exist in the cancer invasion pain model mice induced by S180 sarcoma.The mechanism of mirror image pain occurr and preserve in cancer invasion pain model may involve the changes of Glu, GABA in the spinal cord and SP, Dyn A1-13in the cerebral cortex, through which gabapentin can relieve mirror image pain in cancer invasion pain model.
mirror image pain; cancer invasion pain; gabapentin; neurochemicals
国家科技部国际科技合作专项(2010DFA31890);中国中医科学院自主选题研究项目(ZZ2013003)
孙丹丹,女,硕士,研究方向:中药药理,E-mail:sdd900827@163.com;王丹巧,通讯作者,女,博士,研究员、博士生导师,研究方向:中药药理、中西医结合老年医学基础研究,E-mail:dq_wang96@sohu.com。
R747
A
1005-1678(2015)03-0013-05
