骨髓间充质干细胞在神经移植修复大鼠坐骨神经缺损过程中对调节性T 细胞亚群的影响
2015-07-07陈鸥王建军
陈鸥 王建军
周围神经缺损是临床常见的致残性疾病,其常用治疗方法是自体神经移植[1]。但自体神经移植存在一些局限性,包括供区功能障碍、感觉缺失、神经瘤形成以及长距离神经缺损时自体神经来源有限[2-3]。为克服这些缺点,研究者开始关注异体神经移植。但是,异体神经移植需要面临排斥反应的问题。Hudson 等[4]用化学去细胞神经治疗大鼠坐骨神经缺损,未发生强烈的排斥反应,但这种方法的治疗效果与自体神经移植比较仍有较大的差距,主要原因在于修复过程中缺少促进神经生长的细胞及相关细胞因子,比如雪旺细胞、神经生长因子等。近年来,很多研究利用去细胞神经和骨髓间充质干细胞(bone marrow derived mesenchymal stem cells,BMSCs)、脂肪间充质干细胞及它们诱导分化的雪旺细胞等种子细胞共同移植修复大鼠坐骨神经缺损,并取 得 了 一 定 的 进 展[5-7]。如Wang 等[8]通 过BMSCs 和去细胞神经联合移植治疗大鼠坐骨神经缺损,取得了优于单纯使用去细胞神经的效果。体外研究中发现,BMSCs 和T 细胞共培养后,可以促进调节性T 细胞的分泌和成熟[9-10]。但在利用去细胞神经移植治疗神经缺损的过程中,联合移植BMSCs 对T 细胞亚群有何影响还少有报道。因此,本研究旨在观察BMSCs 和去细胞神经联合移植修复大鼠坐骨神经缺损的过程中,大鼠外周血T 细胞亚群的变化,从而确定BMSCs 在此过程中的免疫调节作用。
1 材料和方法
1.1 实验动物
选择健康雄性SD 大鼠15 只及雄性Wistar 大鼠15 只,体质量均为150 ~200 g,月龄均为2 个月(均购自温州医学院动物实验中心)。SD 大鼠作为受体,用于制作坐骨神经缺损动物模型及分离雪旺细胞。Wsitar 大鼠作为供体,用于提供去细胞神经。所有实验方案经温州医学院动物伦理委员会批准通过。
1.2 实验方法
1.2.1 制备去细胞神经
取15 只Wistar 大鼠,10%水合氯醛(上海碧云天公司)腹腔注射麻醉(0.4 mL/100 g),无菌条件下切取约2.0 cm 长的右侧坐骨神经共15 条。参照Hudson 等[4]的方法,使用蒸馏水、sulfobetaine-10、sulfobetaine-16 和Triton-200(均购自上海碧云天公司)等依次浸泡萃取,以获取去细胞神经。
1.2.2 坐骨神经缺损模型的建立及雪旺细胞的分离培养
SD 大鼠常规消毒后手术切取1.5 cm 长的坐骨神经一段,断端回缩后造成2.0 cm 坐骨神经缺损。同时采用Lao 等[11]的方法分离培养大鼠雪旺细胞,将上述切取的坐骨神经放入含10%胎牛血清(美国Hyclone 公司)的DMEM/F12 培养基(美国Gibco 公司)。清除神经外膜及周围神经结缔组织,仔细地将神经分成单束并剪碎,放入含有0.25%胰蛋白酶和0.03%胶原蛋白酶(美国Sigma 公司)的2 mL PBS 中。37 ℃消化60 min 后,加入DMEM/F12 培养基终止消化,并用200 目筛网过滤。滤出液1 000 ×g离心5 min,即得细胞沉淀,加入DMEM/F12 培养基重悬浮后,将所得细胞以1 ×104个/mL密度种入培养瓶中,常规培养并通过免疫方法鉴定是否为雪旺细胞。
1.2.3 去细胞神经的细胞植入
将鉴定成功的雪旺细胞及大鼠BMSCs(广州赛业生物有限公司)传代培养,培养3 代后,用0.25%胰蛋白酶消化后制成密度为1.0 ×107/mL 的雪旺细胞,以备植入。如需同时植入雪旺细胞和BMSCs,则将两种细胞按等比例混合后制成混合细胞悬液。用25 μL 微量注射器,每隔0.4 mm 向去细胞神经注射2 μL 细胞悬液,将相应细胞植入。处理好的去细胞神经置于含15%胎牛血清和1%青链霉素的DMEM/F12 培养基中过夜。
1.2.4 分组和坐骨神经修复方案
将15 只坐骨神经缺损的SD 大鼠随机分为3 组,每组5 只。去细胞神经组,仅采取单纯去细胞神经移植修复缺损;去细胞神经+雪旺细胞组,采用植入雪旺细胞的去细胞神经移植修复缺损;去细胞神经+雪旺细胞+BMSCs 组,采用同时植入雪旺细胞和BMSCs 的去细胞神经移植修复缺损。去细胞神经的植入方法为使用8-0 普罗灵缝线端端吻合去细胞神经的两端与受体SD 大鼠坐骨神经的2 个断端。
1.2.5 流式细胞仪检测调节性T 细胞比例
分别在移植前和移植后3、7、14 d 4 个时间点采集受体SD 大鼠尾静脉血50 μL,用淋巴细胞分离液(美国eBioscience 公司)分离出外周血单个核细胞。加入CD4-FITC 抗体(美国eBioscience 公司)2 μL及CD25-PE 抗体(美国eBioscience 公司)2 μL,4 ℃避光孵育30 min,用预冷PBS 溶液洗涤细胞,1 000 ×g 离心5 min,去上清液。加入专用破膜固定液(美国eBioscience 公司)1 mL,置于4 ℃冰箱避光孵育30 min,1 000×g 离心5 min,去上清液。加入专用缓冲液(美国eBioscience 公司)1 mL,1 000 ×g 离心5 min,去上清液。加入Foxp3 抗体(美国eBioscience公司)2 mL,轻轻震荡摇匀后置于4 ℃避光孵育30 min。加入专用Buffer 缓冲液(美国eBioscience公司)1 mL,1 000 ×g 离心5 min,去上清液。加入PBS 缓冲液400 μL 重悬浮细胞,震荡后进行流式细胞仪(FACSCalibur,美国BD 公司)检测。
1.3 统计学方法
采用SSPS 16.0 统计学软件进行数据处理。计量资料以均数±标准差()表示。多组间均数比较采用单因素方差分析,多组间两两比较、同组内多个时间点两两比较均采用LSD-t 检验。P <0.05 为差异具有统计学意义。
2 结 果
如表1 ~3 所示,移植前去细胞神经组、去细胞神经+雪旺细胞组及去细胞神经+雪旺细胞+BMSCs 组受体SD 大鼠CD4+、CD25+及CD4+CD25+Foxp3+T细胞比例差异均无统计学意义(P 均>0.05)。移植后,各组3 种T 细胞比例均呈逐渐上升趋势,移植后14 d 达到峰值,与移植前、移植后3 d 及移植后7 d 相比,差异均具有统计学意义(P 均<0.05)。移植后14 d,去细胞神经组CD4+、CD25+及CD4+CD25+Foxp3+T 细胞比例分别为(39.9±1.9)%、(9.15 ±0.17)%及(2.37 ±0.09)%;去细胞神经+雪旺细胞组CD4+、CD25+及CD4+CD25+Foxp3+T细胞比例分别为(41.0 ±1.7)%、(10.11 ±0.15)%及(2.47 ±0. 05)%;去细胞神经+ 雪旺细胞组+BMSCs 组CD4+、CD25+及CD4+CD25+Foxp3+T 细胞比例分别为(38.1 ±1.6)%、(8.19 ±0.13)%及(2.79 ±0.12)%,可见移植后14 d 去细胞神经+雪旺细胞+BMSCs 组的CD4+及CD25+T 细胞比例均低于去细胞神经组和去细胞神经+ 雪旺细胞组(P 均<0.05),而CD4+CD25+Foxp3+T 细胞比例高于去细胞神经组和去细胞神经+ 雪旺细胞组(P <0.05)。
表1 采用不同坐骨神经修复方案的三组受体大鼠去细胞神经移植前后CD4 + T 细胞比例
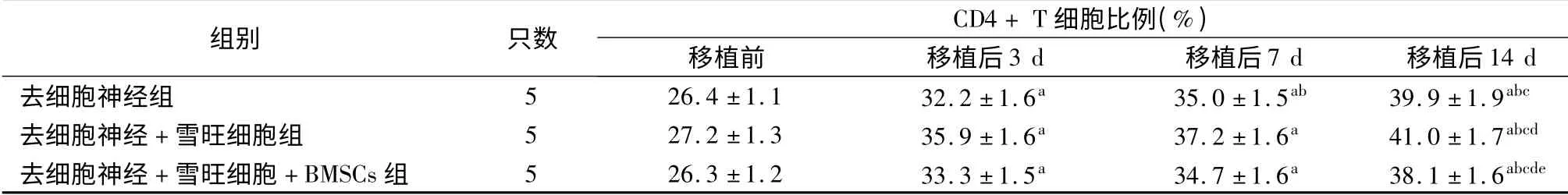
表1 采用不同坐骨神经修复方案的三组受体大鼠去细胞神经移植前后CD4 + T 细胞比例
注:与移植前相比,aP <0.05;与移植后3 d 相比,bP <0.05;与移植后7 d 相比,cP <0.05;与去细胞神经组相比,dP <0.05;与去细胞神经+雪旺细胞组相比,eP <0.05
表2 采用不同坐骨神经修复方案的三组受体大鼠去细胞神经移植前后CD25 + T 细胞比例
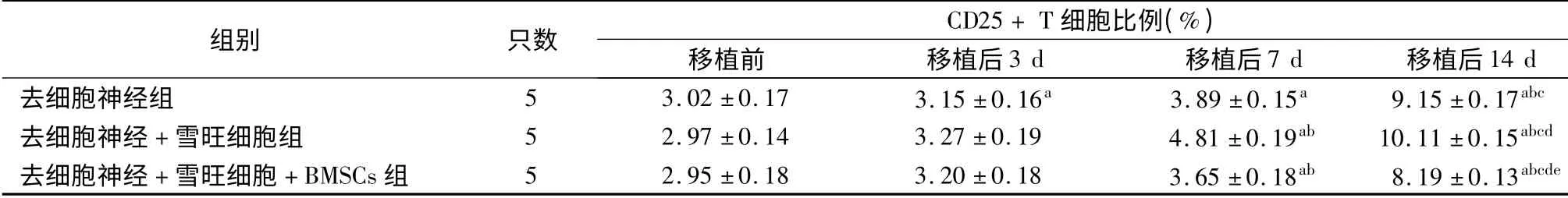
表2 采用不同坐骨神经修复方案的三组受体大鼠去细胞神经移植前后CD25 + T 细胞比例
注:与移植前相比,aP <0.05;与移植后3 d 相比,bP <0.05;与移植后7 d 相比,cP <0.05;与去细胞神经组相比,dP <0.05;与去细胞神经+雪旺细胞组相比,eP <0.05
表3 采用不同坐骨神经修复方案的三组受体大鼠去细胞神经移植前后CD4 +CD25 +Foxp3 + T 细胞比例
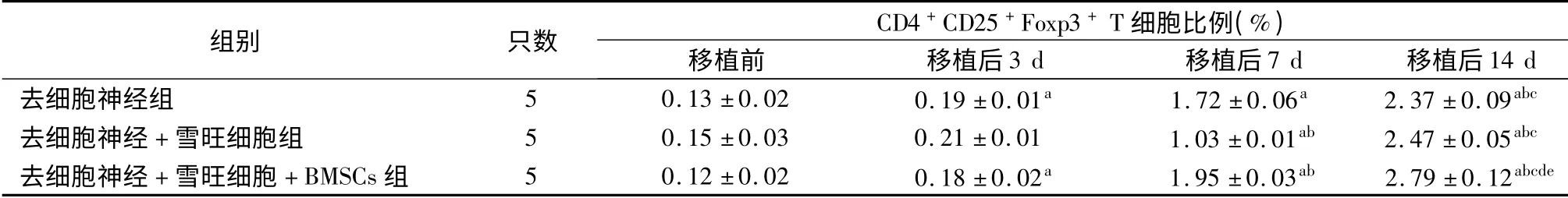
表3 采用不同坐骨神经修复方案的三组受体大鼠去细胞神经移植前后CD4 +CD25 +Foxp3 + T 细胞比例
注:与移植前相比,aP <0.05;与移植后3 d 相比,bP <0.05;与移植后7 d 相比,cP <0.05;与去细胞神经组相比,dP <0.05;与去细胞神经+雪旺细胞组相比,eP <0.05
3 讨 论
化学萃取去细胞神经免疫原性较低,是目前实验研究应用较多的组织工程学神经支架,但是化学萃取去细胞神经支架单独用于修复周围神经缺损的效果较自体神经仍有不足,因此在化学去细胞神经中种植种子细胞,共同促进周围神经再生,成为了研究热点。目前,大多数研究为向去细胞神经中种植自体雪旺细胞。雪旺细胞是神经细胞周围的重要组成细胞,对于神经细胞(包括胞体、轴突及树突)再生有重要作用。研究认为自体雪旺细胞植入异体去细胞神经桥接物修神经缺损有利于早期轴突再生及再生轴突数量的增加[12]。但是利用自体组织分离培养出种子细胞及其衍生细胞会造成供区的组织损伤,且来源有限。而利用异体组织分离培养种子细胞及其衍生细胞虽来源充足且广泛,但无法消除抗原性,可能引发神经移植后免疫排斥反应;而应用免疫抑制剂又存在引起各种全身性并发症的风险。
神经移植后的免疫排斥反应主要由T 细胞介导。T 细胞按照功能可分为辅助性T 细胞、效应性T 细胞以及调节性T 细胞。CD4+T 细胞是具有细胞免疫功能的效应性T 细胞,CD25+T 细胞为活化的CD4+T 细胞,二者均代表免疫激活状态,反映免疫排斥反应的发生。CD4+CD25+Foxp3+T 细胞是调节性T 细胞,是T 淋巴细胞中唯一起负性免疫调节作用的亚群[13-14],但其调节机制尚不完全明确。目前认为可能和以下途径有关:(1)细胞接触途径,通过细胞表面膜分子CTLA-4 和TGF-β 与效应性T 细胞相应配体结合,抑制效应性T 细胞分泌IL-2;(2)通过分泌TGF-β 等抑制性细胞因子,发挥负性免疫调节作用;(3)通过下调抗原提呈物质如MHC-Ⅰ,MHC-Ⅱ等,间接发挥负性免疫调节作用;(4)通过分泌颗粒蛋白酶B 和穿孔素导致NK 细胞和CD8+T 细胞的凋亡[15-18]。
综上所述,在向去细胞神经植入雪旺细胞的同时,如能同时植入调节T 细胞免疫的种子细胞,则可能减轻或解决神经移植后的免疫排斥反应问题。BMSCs 是由骨髓中分离培养的干细胞,能多向分化为多种细胞。由于BMSCs 表面不表达或者低表达MHC-Ⅱ,因此在自体移植时免疫原性较低[19]。近年来,English 等[20]研究发现将BMSCs 和CD4+T 细胞共培养后,CD4+T 细胞Foxp3 表达升高,将CD4+T细胞重新纯化分离培养后,其Foxp3 表达下降,这意味着BMSCs 可能具有增加调节性T 细胞比例的作用。现已有研究在去细胞神经移植修复坐骨神经的过程中应用BMSCs,并且发现同时植入BMSCs,神经修复的效果更佳[21],但其机制仅涉及BMSCs 的营养因子提供功能,并未涉及免疫调节功能。实际上,关于BMSCs 植入在神经修复过程中是否发挥免疫调节作用,还少有报道。本研究中,接受神经移植后,各组受体SD 大鼠的CD4+、CD25+及CD4+CD25+Foxp3+T 细胞比例呈增高趋势,提示移植物具有一定的免疫原性,引起了免疫激活。去细胞神经+雪旺细胞+BMSCs 组CD4+及CD25+T 细胞的比例最低,但CD4+CD25+Foxp3+T 细胞的比例最高,因此,我们认为在神经移植过程中,BMSCs 具有增强免疫耐受的作用,其机制为BMSCs 增加调节性T 细胞比例从而抑制免疫活性。
1 Flores AJ,Lavernia CJ,Owens PW. Anatomy and physiology of peripheral nerve injury and repair[J]. Am J Orthop (Belle Mead NJ),2000,29(3):167-173.
2 de Ruiter GC,Spinner RJ,Yaszemski MJ,et al. Nerve tubes for peripheral nerve repair[J]. Neurosurg Clin N Am,2009,20(1):91-105
3 Kemp SW,Walsh SK,Midha R. Growth factor and stem cell enhanced conduits in peripheral nerve regeneration and repair[J].Neurol Res,2008,30(10):1030-1038.
4 Hudson TW,Zawko S,Deister C,et al. Optimized acellular nerve graft is immunologically tolerated and supports regeneration[J].Tissue Eng,2004,10(11-12):1641-1651.
5 Jesuraj NJ,Santosa KB,Newton P,et al. A systematic evaluation of Schwann cell injection into acellular cold-preserved nerve grafts[J].J Neurosci Methods,2011,197(2):209-215.
6 Carriel V,Garrido-Gomez J,Hernandez-Cortes P,et al. Combination of fibrin-agarose hydrogels and adipose-derived mesenchymal stem cells for peripheral nerve regeneration[J]. J Neural Eng,2013,10(2):026022.
7 Wang Y,Zhao Z,Ren Z,et al. Recellularized nerve allografts with differentiated mesenchymal stem cells promote peripheral nerve regeneration[J]. Neurosci Lett,2012,514(1):96-101.
8 Wang D,Liu XL,Zhu JK,et al. Repairing large radial nerve defects by acellular nerve allografts seeded with autologous bone marrow stromal cells in a monkey model[J]. J Neurotrauma,2010,27(10):1935-1943.
9 English K,French A,Wood KJ. Mesenchymal stromal cells:facilitators of successful transplantation[J]. Cell Stem Cell,2010,7(4):431-442.
10 Griffin MD,Ritter T,Mahon BP. Immunological aspects of allogeneic mesenchymal stem cell therapies[J]. Hum Gene Ther,2010,21(12):1641-1655.
11 Lao Jie,Hung LK ,GU Yudong ,et al. Modified Schwann cell culture from adult SD rats[J]. Chin J Hand Surg,1999,15(2):44-46.
12 王建云. 化学萃取同种异体神经种植自体雪旺细胞实验研究[D]. 广州:中山大学,2002.
13 Nik TN,Hambly BD,Sullivan DR,et al. Forkhead box protein 3:essential immune regulatory role[J]. Int J Biochem Cell Biol,2008,40(11):2369-2373.
14 Hanidziar D,Koulmanda M. Inflammation and the balance of Treg and Th17 cells in transplant rejection and tolerance[J]. Curr Opin Organ Transplant,2010,15(4):411-415.
15 Jenabian MA,Seddiki N,Yatim A,et al. Regulatory T cells negatively affect IL-2 production of effector T cells through CD39/adenosine pathway in HIV infection[J]. PLoS Pathog,2013,9(4):e1003319.
16 Ishigame H,Zenewicz LA,Sanjabi S,et al. Excessive Th1 responses due to the absence of TGF-beta signaling cause autoimmune diabetes and dysregulated Treg cell homeostasis[J]. Proc Natl Acad Sci U S A,2013,110(17):6961-6966.
17 Baecher-Allan C,Wolf E,Hafler DA. MHC class Ⅱexpression identifies functionally distinct human regulatory T cells[J]. J Immunol,2006,176(8):4622-4631.
18 Beeston T,Smith TR,Maricic I,et al. Involvement of IFN-gamma and perforin,but not Fas/FasL interactions in regulatory T cellmediated suppression of experimental autoimmune encephalomyelitis[J]. J Neuroimmunol,2010,229(1-2):91-97.
19 Trento C,Dazzi F. Mesenchymal stem cells and innate tolerance:biology and clinical applications[J]. Swiss Med Wkly,2010,140:w13121.
20 English K,Ryan JM,Tobin L,et al. Cell contact,prostaglandin E(2)and transforming growth factor beta 1 play non-redundant roles in human mesenchymal stem cell induction of CD4 + CD25(High)forkhead box P3 + regulatory T cells[J]. Clin Exp Immunol,2009,156(1):149-160.
21 丁昌荣,杨选影,韩迎秋,等. 富血小板血浆诱导骨髓间充质干细胞结合化学萃取去细胞神经修复坐骨神经缺损[J]. 中国组织工程研究与临床康复,2010,14(27):4946-4950.
