碳离子辐照对菘蓝药性品质和分子水平的诱变效应
2015-07-05李雪虎
阎 侃,李雪虎
(1 兰州大学 生命科学学院,兰州730000;2 中国科学院 近代物理研究所,兰州730000)
菘蓝(Isatis indigotica)系十字花科两年生草本植物,根叶分别是中国大宗使用的传统中药材板蓝根和大青叶,它们具有较好的治疗流行性感冒[1]、咽喉肿痛[2]和抗癌症[3]的功效。化学分析发现,菘蓝中的主要药用成分为4(3H)喹唑酮和靛玉红等[4]。4(3H)喹唑酮对流感病毒和柯萨奇病毒的活性有较强的抑制作用[5]。靛玉红有较强的抗癌作用,可有效抑制人类乳腺癌细胞MCF-7 的生长[6]。野生菘蓝中4(3H)喹唑酮和靛玉红的含量极少,工业化提取要求高,代价大。随着菘蓝在制药行业中的使用量越来越大,如何培育有效药用成分含量高的新品种成为一个重要科学问题。
重离子辐照是一种新型的诱发突变源,具有高传能线密度和独特的电离峰[7]。碳离子辐照作为重离子辐照的一种,具有突变谱广,突变性状容易稳定,正向突变率高等独特的优势[8]。近些年来,在利用重离子辐照育种或筛选突变体的过程中,获得了大量其他诱变方式难以获得的表型,并在生产和科研中得到成功运用,比如碳离子辐照菊属植物使之颜色发生改变并生成了舌状花的形状[9];碳离子辐照拟南芥(Arabidopsis thaliana)产生了叶子形状发生改变的突变体[10],这些突变体产生的原因多是由于重离子辐照导致DNA 发生了突变。
目前评价和确认新的突变体常用的分子标记有RAPD[11]、AFLP[12]、ISSR[13]和SRAP[14]等。重 离子辐照突变体利用分子标记技术进行鉴定的也很多。比如,4He2+对日本扁柏(Chamaecyparis obtusa)的茎芽原基辐照后,进行了RAPD 分析,以检验不同突变体的DNA 变化差异[15];空间重离子对水稻(Oryza sativa)辐照后,利用AFLP 分析突变体基因组的变化特点[16]。但是RAPD 的扩增结果重复性较差,容易受各种因素的影响;AFLP对于反应条件和DNA 纯度要求过高;ISSR 可能在特定基因组DNA 中没有配对区域。SRAP 是一种新型的基于PCR 的分子标记,为显性标记,是由美国加州大学的Quiros等[14]于2001 年在芸薹属作物中开发出来的。该标记对基因的开放阅读框的特定区域进行扩增,重复性较好,步骤简洁,目前已成功地应用于遗传图谱的构建、遗传多样性分析、重要性状相关基因的克隆等方面,比如对于双齿围沙蚕(Nereis succinea)的基因多样性分析[17]和对花烛(Anthurium andraeanum)遗传连锁图谱的建立[18]。因此,研究第一次运用SRAP 技术对于碳离子辐照突变体进行了分析。
为了培育含有高药效成分的菘蓝品系,本研究利用剂量呈梯度递增的碳离子辐照菘蓝干种子,探讨不同剂量辐照下菘蓝生理指标和药性质量的变化,同时还首次运用SRAP、SDS-PAGE和蛋白磷酸化染色分别从DNA 水平、蛋白水平和蛋白修饰水平系统评价了不同剂量碳离子辐照对菘蓝分子层面的影响,这将对重离子辐照的突变特性研究和菘蓝的分子生物学研究提供重要参考。
1 材料和方法
1.1 种子辐照、种植和生长状况测定
本研究所采用的野生型菘蓝种子经中国农业科学院兰州畜牧与兽药研究所药物研究室罗永江副研究员鉴定为十字花科两年生草本菘蓝种子。将野生型的干种子在中国科学院近代物理研究所重离子加速器上进行12C6+辐照诱变。碳离子的能量为270 MeV/u,剂量比率是20 Gy/min,设30Gy、60Gy、90Gy和120Gy 4个剂量梯度。野生型和辐照突变体统一种植于辐照植物培养间,每个剂量采用1 000粒M1种子统计成苗率;以繁殖3代以上稳定遗传的辐照突变体为材料,培养3个月后进行指标测定,至少30棵植株统计根平均鲜重。
1.2 靛玉红和4(3H)喹唑酮的样品制备和含量测定
(1)靛玉红 将菘蓝根在60 ℃水浴蒸干,残渣用色谱级甲醇定容,0.45μm 滤膜过滤,滤液作为检测样品。含量检测使用高效液相色谱仪,流动相为甲醇∶水(75∶25),流速为1.0mL/min,检测波长为289nm。
(2)4(3H)喹唑酮 将菘蓝根粉碎,用滤纸包好放入玻璃器皿中,加色谱级甲醇,于超声波清洗器中超声0.5h,再重复2次后,合并3次滤液,0.45μm滤膜过滤。含量检测使用高效液相色谱仪,流动相为乙腈∶甲醇∶水(5∶20∶75),流速为0.8 mL/min,检测波长为225nm。
1.3 总蛋白表达分析
1.3.1 总蛋白的提取 菘蓝根加液氮研磨至粉末,加入2×SDS-PAGE loading buffer(100 mmol/L Tris-HCl(pH 6.8),4% SDS,0.2% BPB,20%甘油,5%β-巯基乙醇),在沸水浴5min,18 000g离心10min,取上清加4倍体积的丙酮,-20 ℃沉淀过夜后离心弃上清,加80%的丙酮洗沉淀1~2遍,沉淀干燥后加入2×SDS-PAGE loading buffer溶解。
1.3.2 考马斯亮蓝染色和蛋白磷酸化染色 采用Bradford法测定样品蛋白浓度后[19],加入1×SDSPAGE loading buffer with dye上样于10%的SDSPAGE胶中,待溴酚蓝刚刚跑出胶后,取胶于固定液(10% 乙酸,50%甲醇)中孵育30min后,换新固定液,孵育过夜。去离子水漂洗30 min×2。暗下于稀释3倍的pro-Q(Invitrogen 公司)染液中孵育2 h,暗下脱色液(50 mmol/L 乙酸钠(pH 4.0),20%乙腈)脱色30min×4,去离子水洗2次。通过UVP凝胶成像系统成像。之后把胶在考马斯亮蓝染液(10%磷酸,0.12%考马斯亮蓝G-250,20%甲醇,10%硫酸铵)中孵育2h,脱色(10%甲醇,10%乙酸)过夜后,扫描仪成像。
1.4 基因表达分析
1.4.1 DNA 的提取 取幼嫩叶片,采用DNA 提取试剂盒(Axygen公司)提取基因组DNA,具体提取方法参照试剂盒说明书。DNA 的总量和质量通过nanodrop2000和电泳来分析。
1.4.2 DNA扩增 SRAP分子标记引物购于华大基因公司,具体序列见表1。扩增仪器为BIO-RAD的S1000型号PCR 仪。通过前期正交分析获得的最佳扩增体系为:r Taq(takara)0.3μL,Mg2+1.5 μL,dNTP(2.5mmol/L)1.5μL,DNA(20ng/μL)2.5μL,引物(10μmol/L)1.5μL,10×buffer 2.5 μL,dH2O 13.7μL。扩增条件为:94 ℃预变性4 min;94 ℃30s,35 ℃1 min,72 ℃2 min,循环5次;94 ℃30s,52 ℃1 min,72 ℃2 min,循环35次;72 ℃10 min。产物在1.5%的琼脂糖凝胶中电泳。
1.5 数据分析
采用SRAP扩增出的条带来统计基因座,一个条带即代表一个基因座,记为1,同一大小处突变体或野生型中未出现该条带则表示该基因座发生改变,记为0。不同剂量的突变体分别与野生型进行比较,用软件Popgene计算多态性比率和Nei-Li’s距离指数。蛋白条带和磷酸化蛋白条带的增减由软件Quantity One进行分析。

表1 菘蓝SRAP-PCR的引物序列Table 1 Nucleotide sequences of primers for I.indigotica SRAP-PCR
2 结果与分析
2.1 碳离子辐照对菘蓝出苗率和根鲜重的影响
随着12C6+辐照剂量从30Gy逐渐增高到120Gy,菘蓝种子成苗率也比野生型(WT)下降了16.6%~66.6%(图1,A),同时90d龄的M1代植株的根平均鲜重也不断下降,相比野生型对照降低了22.93%~71.20%,各辐照材料间均差异显著(图1,B)。可见,不同剂量碳离子辐照均不利于菘蓝种子成苗和幼苗生长。
2.2 碳离子辐照对菘蓝次生代谢产物含量的影响
HPLC技术现已广泛运用于天然产物的分析和测定,已有研究者成功利用醇浸提法提取了菘蓝叶子的次生代谢产物,并用HPLC测定了其中靛蓝前体的含量[20]。本研究表明,不同剂量的碳离子辐照后,菘蓝根的醇浸出物量较野生型均显著下降,且有随辐照剂量增加而逐渐降低的趋势(图2,A)。同时,辐照前后菘蓝根中两个主要药效成分靛玉红和喹唑酮[4]的HPLC 检测结果显示:根靛玉红(图2,B)和根喹唑酮(图2,C)的含量均随着辐照剂量的增大先升高后下降,并均在30Gy辐照时均达到了最大值,此时分别比野生型对照显著升高了2.3倍和2.2倍;同时,两种活性成分含量在60Gy辐照时也显著高于野生型,而在120Gy辐照时却显著低于野生型。以上结果说明碳离子辐照显著降低了菘蓝根次生代谢产物含量,但适宜剂量辐照(30和60Gy)能显著提高其根中主要药效成分靛玉红和喹唑酮含量,改良药物品质。

图1 不同剂量碳离子辐照下菘蓝的成苗率(A)和根平均鲜重(B)WT 为野生型,30Gy、60Gy、90Gy和120Gy分别表示不同剂量辐照材料;不同字母表示不同材料间在0.05水平存在显著性差异;下同Fig.1 The seedling surviving rate(A)and average root fresh weight(B)of I.indigotica under different carbon ion irradiation doses WT is wild type,while 30Gy,60Gy,90Gy and 120Gy are materials treated by different carbon ion irradiation doses;Different letters meant significant differences among treatments at 0.05level;the same as blow
2.3 碳离子辐照对菘蓝基因组的影响
为了分析辐照后菘蓝植株的变异情况,本研究借助SRAP分析了样本在DNA 水平的多样性。采用了15 条SRAP 通用引物(表1),组合形成了56对不同的引物,对野生型和不同剂量辐照后的菘蓝DNA 分别进行扩增。通过统计,野生型和突变体中一共扩增出了387个基因座,其中309个具有多态性。每对引物扩增出的基因座数的统计结果见表2。其中,不同引物对扩增产生的多态性基因座数从4个到13个不等;引物组合Me1Em4扩增最多达到13 个 基 因 座,而 Me2Em4、Me5Em2、Me5Em3、Me5Em4和Me5Em7引物组合只扩增出了2 个基因座。通过软件Popgene分析,56对引物的平均多态性基因座比率为79.84%。图3,A~C 分别展示在1.5% 的 琼 脂 糖 凝 胶 上 Me2Em1、Me1Em2、Me3Em6这3对SRAP引物的扩增条带,其扩增产物条带的大小在200~2 000bp之间。
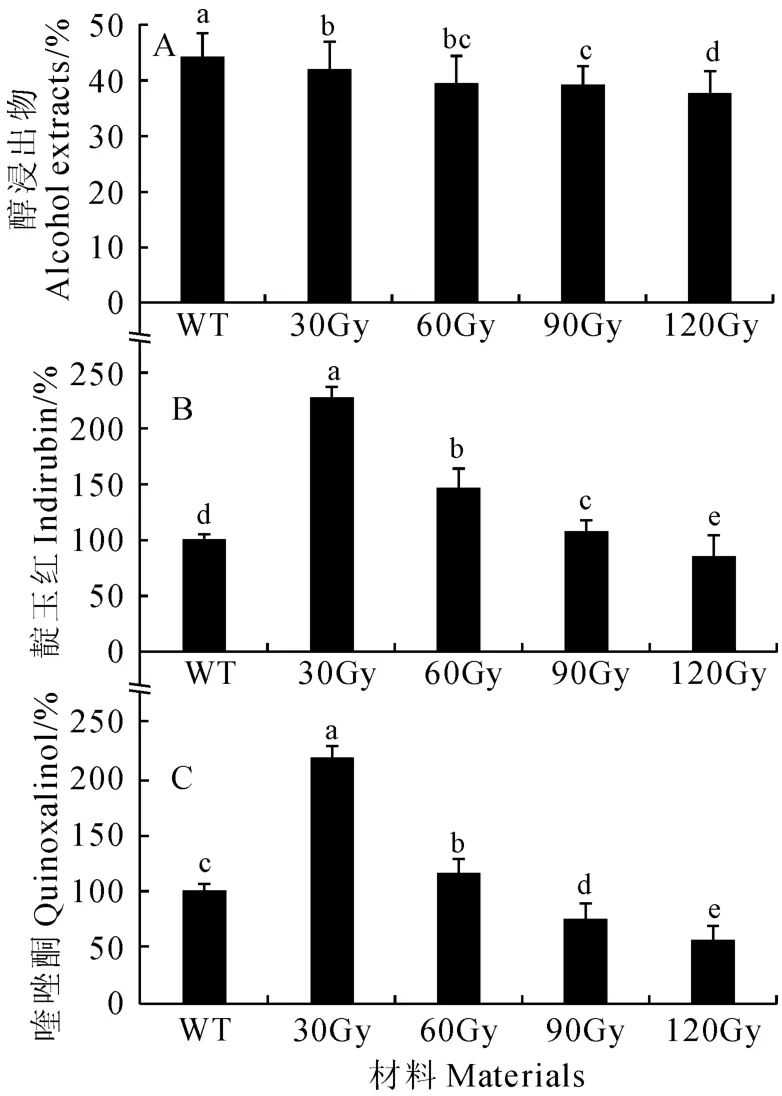
图2 不同剂量的碳离子辐照下菘蓝根的醇浸出物(A)、靛玉红(B)和喹唑酮(C)的含量Fig.2 The contents of alcohol extracts(A),indirubin(B)and quinoxalinol(C)in the root of I.indigotica under different carbon ion irradiation doses
多态性基因座占基因座总数中的比率称为多态性基因座比率。与野生型对照比较,在387个基因座总数(表2)中,30Gy、60Gy、90Gy和120Gy辐照菘蓝的多态性基因座比率分别为:33.59%、37.73%、40.31%和43.41%(表3)。可见,碳离子辐照后的菘蓝在DNA 水平与对照表现出明显的不同,且其多态性随着辐照剂量的增加而增强。
另外,用56对引物组合扩增出的野生型和辐照突变体得到的条带数据来确定Nei-Li’s距离指数。其中,最高的距离指数是0.727 3,出现在30Gy与120Gy 辐照材料之间,而最低的距离指数是0.409 3,出现在30Gy与60Gy辐照材料、30Gy辐照材料与野生型对照组之间;所有样品之间平均距离指数为0.518 4(表4)。
进一步基于SRAP 分子标记做出的UPGMA的进化树将野生型和突变体分为了两个簇,一个簇包括60Gy和120Gy辐照材料,另一个簇包括了其他的辐照突变体和野生型对照组,含有对照组的簇又包含了两个子簇,一个是60Gy,另一个是野生型和30Gy(图4),这样就更加直观低展现出了不同剂
量的辐照突变体之间基因组变异度的关系。
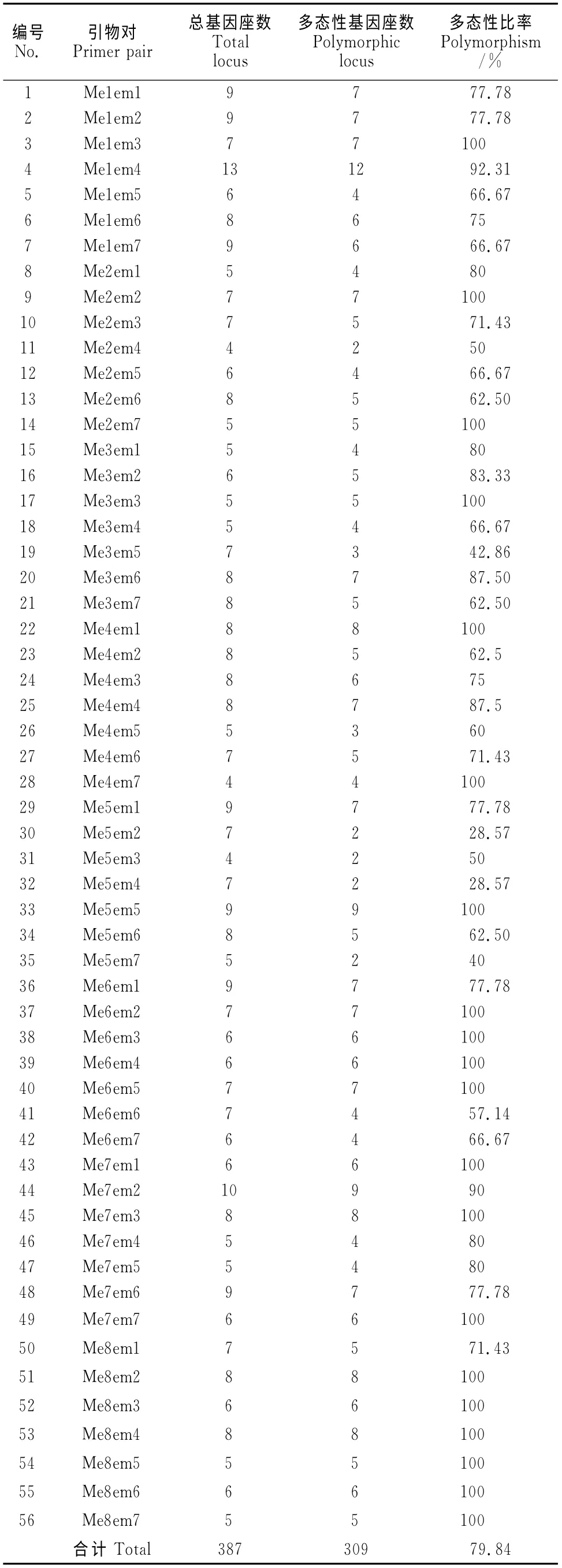
表2 菘蓝SRAP数据统计Table 2 Statistics for SRAP data of I.indigotica
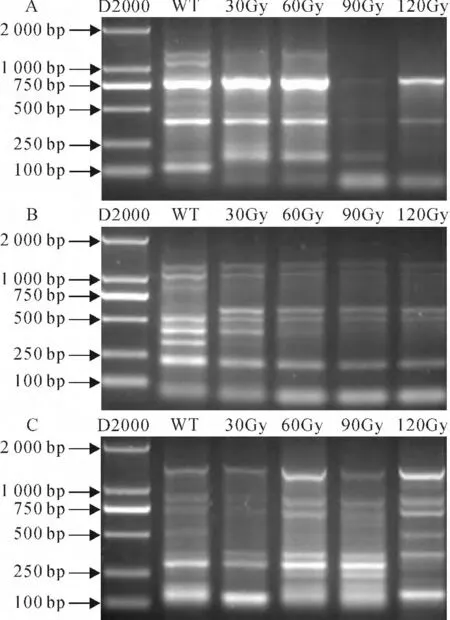
图3 不同剂量的碳离子辐照下菘蓝的SRAP分析结果A~C分别为引物组合Me2Em1、Me1Em2、Me3Em6的PCR扩增结果Fig.3 SRAP analysis of I.indigotica under different carbon ion irradiation doses A-C are PCR results amplified by primer pair Me2Em1,Me1Em2and Me3Em6,respectively

表3 不同剂量碳离子辐照下菘蓝的多态性基因座比率Table 3 Polymorphic locus ratio of I.indigotica under different carbon ion irradiation doses
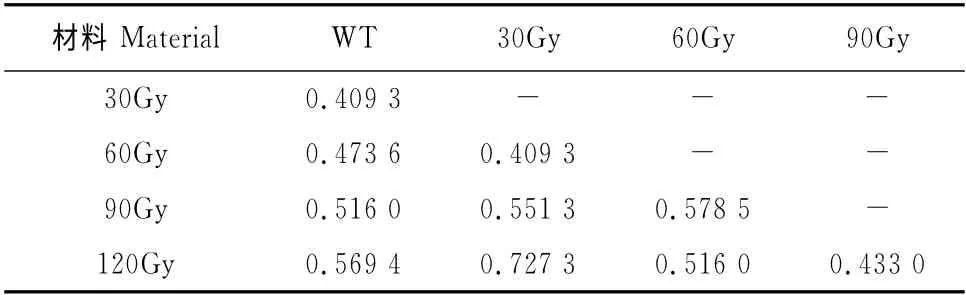
表4 不同剂量碳离子辐照下菘蓝的Nei-Li’s距离指数Table 4 The Nei and Li’s distance index of I.indigotica under different carbon ion irradiation doses
2.4 碳离子辐照对菘蓝总蛋白表达水平的影响
碳离子辐照不仅会导致DNA 水平的突变,也会导致蛋白水平的变化。突变体的蛋白水平变化(条带的增加或缺失)可以用SDS-PAGE 方法检测[21]。本研究中野生型和碳离子辐照菘蓝总蛋白表达水平使用SDS-PAGE进行了检测,再经考马斯亮蓝G-250染色后(图5),通过软件Quantity One利用蛋白Maker估算了所有条带的分子量,并分析了同一分子量处条带的增减。结果发现,野生型和突变体菘蓝中一共分离出了19个条带,其中9条具有多态性,具体统计结果见表5;与野生型相比,辐射突变体均出现了新增或消失的条带,30Gy、60Gy、90Gy和120Gy 辐照菘蓝的多态性比率分别为42.11%、36.84%、36.84%和42.11%(表6)。这说明各剂量碳离子辐照对菘蓝的蛋白质表达水平造成了不同程度的影响,而辐照突变体总蛋白的表达水平与基因组的变化程度并不呈正相关关系。
2.5 碳离子辐照对菘蓝磷酸化蛋白表达水平影响

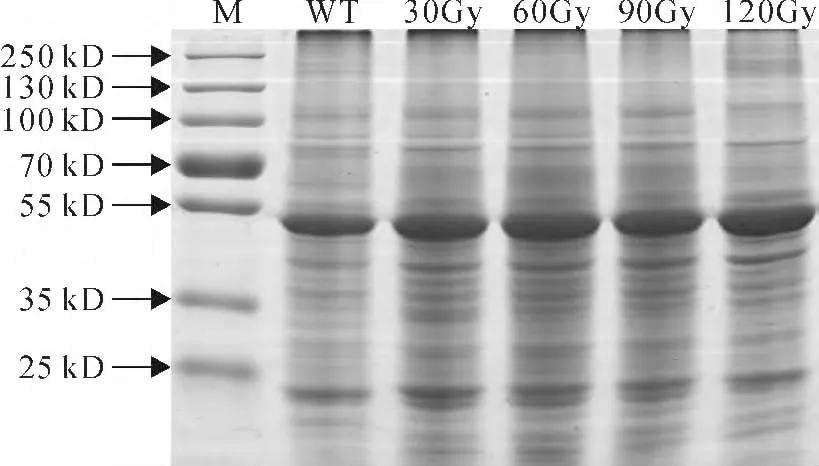
图5 不同剂量的碳离子辐照下菘蓝的考马斯亮蓝染色SDS-PAGE胶图Fig.5 SDS-PAGE gel of carbon ion irradiated(different doses)I.indigoticastained by CBB
磷酸化是一种蛋白质的翻译后修饰形式,参与调控了很多生命过程,因此检测蛋白质的磷酸化状态可以有效反映辐照对植物的生长发育的影响。Pro-Q 是一种特异的磷酸化蛋白荧光染料,它可对磷酸化基团特异性地着色。野生型和各剂量辐照菘蓝的SDS-PAGE胶经Pro-Q 染色后(图6),通过软件Quantity One分析,野生型和突变体中一共有10个条带被着色,其中8条具有多态性,具体统计结果见表7。与 野 生 型 相 比,各 剂 量(30、60、90 和120Gy)辐照菘蓝突变体条带多态性比率分别为60%、60%、70%和50%(表8)。由此可见,碳离子辐照对菘蓝蛋白磷酸化水平产生了影响,也就意味着碳离子辐照对调控菘蓝生长发育的分子机制产生了影响,而这种变化跟其总蛋白表达水平一样,与其基因组的变化程度并不呈正相关关系。

表5 不同剂量的碳离子辐照下菘蓝的总蛋白条带统计Table 5 Statistics for total protein bands of I.indigotica under different carbon ion irradiation doses

表6 不同剂量的碳离子辐照下菘蓝的多态性蛋白条带比率Table 6 Polymorphic protein bands ratio of I.indigotica under different carbon ion irradiation doses

图6 不同剂量的碳离子辐照下菘蓝的Pro-Q 染色SDS-PAGE胶图Fig.6 SDS-PAGE gel of carbon ion irradiated(different doses)I.indigoticastained by Pro-Q

表7 不同剂量的碳离子辐照下菘蓝的磷酸化蛋白条带统计Table 7 Statistics for total phosphoprotein bands of I.indigotica under different carbon ion irradiation doses

表8 不同剂量的碳离子辐照下菘蓝的多态性磷酸化蛋白条带比率Table 8 Polymorphic phosphoprotein bands ratio of I.indigotica under different carbon ion irradiation doses
3 讨 论
磷酸化是蛋白质翻译后修饰中很重要的一种,磷酸化修饰会改变蛋白质的活性,完成蛋白激酶在激活态和失活态之间的转变,如胰岛素受体[22]。根据目前的研究,调控植物和动物生长发育的各大主要途径几乎都有蛋白激酶的参与,如第六大类植物激素油菜素内酯的受体BRI1[23],通过一系列磷酸化修饰将信号从细胞外转导至细胞内[24],从而调节植物的细胞伸长、光形态建成、育性等至关重要的生命过程[25-26]。可见,蛋白质的磷酸化状态可以从宏观调控水平有效地反映生物的生长发育状态是否受到影响。因此,本研究使用了磷酸化染料Pro-Q 对梯度剂量的碳离子辐照突变体进行了分析,这在重离子诱导突变体的特性研究中还未见报道。结果发现,碳离子辐照对菘蓝的蛋白表达以及蛋白磷酸化水平均造成了较大的改变,这些改变可能是因为辐照造成的基因突变或者表观遗传学改变。同时,本研究还发现基因组突变频率与辐照强度呈正相关,但总蛋白和磷酸化蛋白多态性并不如此,说明植物在抵抗重离子辐照造成的伤害时有着补偿性的应对机制,这其中的分子机理有待进一步的研究。
利用碳离子辐照培育植物新品种有广泛的应用前景。相比一般低传能线密度的辐照,比如X 射线、伽马射线等,碳离子辐照具有高传能线密度和强生物学效应,能获得很多其他诱变源难以获得的表型[7-8]。据统计,到目前为止已通过辐射诱变的方法获得了3 100多种植物突变体[27]。此类研究还主要集中在花卉观赏性表型的培育[9]和抗胁迫的农作物的育种,如抗旱[21]、抗盐[28]等。利用碳离子辐照进行药用植物诱变育种的研究目前还相对较少。本研究利用碳离子辐照对药用植物菘蓝进行了诱变,首先对最佳的辐照剂量进行了选择,其选择应该由处理后的生长参数决定[29]。已有报道表明,高剂量的伽马射线会导致甘蔗(Saccharum sinense)高比率的突变率,但是同时甘蔗的成活率也下降了[30]。诱变育种必须综合考虑突变率和成苗率之间的关系。本次研究发现,菘蓝种子成苗率和3个月时的根鲜重均随碳离子辐照剂量增加而明显降低;相对其他剂量处理,30Gy对菘蓝生长抑制最小,实际突变率已处于较高水平,是一个相对较好的诱变剂量。另外,靛玉红和喹唑酮是菘蓝中最重要的药用成分,前者具有抗病毒功效[1],后者具有良好的抗癌功效[3]。HPLC的检测发现30Gy的辐照剂量导致菘蓝根中喹唑酮和靛玉红含量分别比野生型升高了2.2倍和2.3倍,相比其他剂量也含量最高,且差异均达到显著水平,这也进一步说明了30Gy是菘蓝辐照育种最佳的诱变剂量。而更大剂量如90Gy和120Gy辐照处理,两种有效成分的含量并没有大幅度的改变,可能是因为高突变率导致多种调控途径受影响,启动了反馈抑制调节。
本研究还使用了SRAP 分子标记分析了菘蓝辐照突变体基因组的变化,目前对碳离子辐照突变体使用SRAP 分析还未见报道。不同于其他分子标记的是,SRAP的上游引物特异结合外显子区域,下游引物特异结合内含子区域或启动子区域,因不同个体内含子、启动子与间隔区长度不同而产生多态性,因此SRAP 是对基因开放阅读框的扩增,能够通过遗传作图更有效定位到有利性状的主效基因[14]。作者前期通过正交实验建立起了菘蓝进行SRAP分析的最佳条件,并对辐照突变体进行扩增后数据稳定可信,这为以后的研究中菘蓝有利基因座的图位克隆提供了技术参考。本研究中最佳条件下SRAP数据显示,碳离子辐照菘蓝突变率在30~120Gy剂量范围内随着辐照剂量的增强而增加,这也与其他重离子辐照植物的基因组变化趋势相符,且结果重复性较好,说明SRAP是一个很好的研究重离子诱变特性指标。
综上所述,本研究采用不同剂量(30~120Gy)碳离子辐照对传统中药材菘蓝进行诱变处理,发现30Gy是最佳辐照剂量;30Gy碳离子辐照后,导致菘蓝根中主要的活性成分喹唑酮和靛玉红含量提高了2.2倍和2.3倍,且相比于其他剂量处理,30Gy对菘蓝根的产量影响最小。同时,SRAP 分子标记分析结果表明,碳离子辐照后的菘蓝在DNA 水平与对照表现出明显的不同,且其多态性随着辐照剂量的增加而增强;诱变后的菘蓝植株在蛋白水平和蛋白修饰水平也有较大的改变。本研究将为菘蓝在医药行业中的大规模应用提供基础,也对其他药用植物的诱变育种产生示范作用。
[1] KO H C,WEI B L,CHIOU W F.The effect of medicinal plants used in Chinese folk medicine on RANTES secretion by virus-infected human epithelial cells[J].Journal of Ethnopharmacology,2006,107(2):205-210.
[2] MA S C,DU J,BUT P P H,et al.Antiviral Chinese medicinal herbs against respiratory syncytial virus[J].Journal of Ethnopharmacology,2002,79(2):205-211.
[3] RODR GUEZ-CABALLERO A,TORRES-LAGARES D,ROBLES-GARC A M,et al.Cancer treatment-induced oral mucositis:a critical review[J].International Journal of Oral and Maxillofacial Surgery,2012,41(2):225-238.
[4] YANG L G,JIANG H M,WANG G,et al.Phenylpropanoids and some nitrogen-containing constituents from the roots of Isatis indigotica Fort.(Cruciferae)[J].Biochemical Systematics and Ecology,2014,(54):313-315.
[5] OBERTH R C,GRAF H,HAMBURGER M.The content of indigo precursors in Isatis tinctorialeaves——a comparative study of selected accessions and post-harvest treatments[J].Phytochemistry,2004,65(24):3 261-3 268.
[6] AOBCHEY P,SINCHAIKUL S,PHUTRAKUL S,et al.Simple purification of indirubin fromIndigofera tinctoria Linn.and inhibitory effect on MCF-7Human breast cancer cells[J].Chiang Mai Journal of Science,2007,34(3):329-337.
[7] DESAI N,DURANTE M,LIN Z W,et al.High LET-induced H2AX phosphorylation around the Bragg curve[J].Advances in Space Research,2005,35(2):236-242.
[8] ZHOU L B,LI W J,MA S,et al.Effects of ion beam irradiation on adventitious shoot regeneration fromin vitro leaf explants of Saintpaulia ionahta[J].Nuclear Instruments and Methods in Physics Research Section B:Beam Interactions with Materials and Atoms,2006,244(2):349-353.
[9] MATSUMURA A,NOMIZU T,FURUTANI N,et al.Ray florets color and shape mutants induced by12C5+ion beam irradiation in chrysanthemum[J].Sci.Scientia Horticulturae,2010,123(4):558-561.
[10] HIRANO T,KAZAMA Y,OHBU S,et al.Molecular nature of mutations induced by high-LET irradiation with argon and carbon ions in Arabidopsis thaliana[J].Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis,2012,735(1-2):19-31.
[11] ATAKÇ,ALIKAMANOˇCLU S,A IK L,et al.Induced of plastid mutations in soybean plant(Glycine max L.Merrill)with gamma radiation and determination with RAPD[J].Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis,2004,556(1):35-44.
[12] VOS PHOGERS RBLEEKER Met al.AFLPa new technique for DNA fingerprintingJ.Nucleic Acids Research19952321 4 407-4 414.
[13] CHARTERS Y,ROBERTSON A,WILKINSON M,et al.PCR analysis of oilseed rape cultivars(Brassica napus L.ssp.oleifera)using 5′-anchored simple sequence repeat(SSR)primers[J].Theoretical and Applied Genetics,1996,92(3-4):442-447.
[14] LI G,QUIROS C F.Sequence-related amplified polymorphism(SRAP),a new marker system based on a simple PCR reaction:its application to mapping and gene tagging in Brassica[J].Theoretical and Applied Genetics,2001,103(2-3):455-461.
[15] ISHII K,YAMADA Y,HASE Y,et al.RAPD analysis of mutants obtained by ion beam irradiation to hinoki cypress shoot primordia[J].Nuclear Instruments and Methods in Physics Research Section B:Beam Interactions with Materials and Atoms,2003,(206):570-573.
[16] SHI J,LU W,SUN Y.Comparison of space flight and heavy ion radiation induced genomic/epigenomic mutations in rice(Oryza sativa)[J].Life Sciences in Space Research,2014,(1):74-79.
[17] LIU F,GUO Q S,SHI H Z,et al.Genetic diversity analysis of Perinereis aibuhitensis based on ISSR and SRAP markers of Chinese coast populations[J].Biochemical Systematics and Ecology,2014,(57):262-269.
[18] VENKAT S K,BOMMISETTY P,PATIL M S,et al.The genetic linkage maps of Anthurium species based on RAPD,ISSR and SRAP markers[J].Scientia Horticulturae,2014,(178):132-137.
[19] BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of proteindye binding[J].Analytical Biochemistry,1976,72(1-2):248-254.
[20] ADACHI J,MORI Y,MATSUI S,et al.Indirubin and indigo are potent aryl hydrocarbon receptor ligands present in human urine[J].Journal of Biological Chemistry,2001,276(34):31 475-31 478.
[21] SEN A,ALIKAMANOGLU S.Analysis of drought-tolerant sugar beet(Beta vulgaris L.)mutants induced with gamma radiation using SDS-PAGE and ISSR markers[J].Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis,2012,(738-739):38-44.
[22] HUSE M,KURIYAN J.The conformational plasticity of protein kinases[J].Cell,2002,109(3):275-282.
[23] LI J,CHORY J.A Putative leucine-rich repeat receptor kinase involved in brassinosteroid signal transduction[J].Cell,1997,90(5):929-938.
[24] WANG X,KOTA U,HE K,et al.Sequential transphosphorylation of the BRI1/BAK1receptor kinase complex impacts early events in brassinosteroid signaling[J].Developmental Cell,2008,15(2):220-235.
[25] KHRIPACH V,ZHABINSKII V,DE GROOT A.Twenty years of brassinosteroids:steroidal plant hormones warrant better crops for the XXI century[J].Annals of Botany,2000,86(3):441-447.
[26] MANDAVA N B.Plant growth-promoting brassinosteroids[J].Annual Review of Plant Physiology and Plant Molecular Biology,1988,39(1):23-52.
[27] JAIN S M.Mutagenesis in crop improvement under the climate change[J].Romanian Biotechnological Letters,2010,15(2):88-106.
[28] YAYCILI O,ALIKAMANOˇGLU S.Induction of salt-tolerant potato(Solanum tuberosum L.)mutants with gamma irradiation and characterization of genetic variations via RAPD-PCR analysis[J].Turkish Journal of Biology,2012,36(4):405-412.
[29] LU G,ZHANG X,ZOU Y,et al.Effect of radiation on regeneration of Chinese narcissus and analysis of genetic variation with AFLP and RAPD markers[J].Plant Cell,Tissue and Organ Culture,2007,88(3):319-327.
[30] PATADE V,SUPRASANNA P.Radiation induced invitro mutagenesis for sugarcane improvement[J].Sugar Tech.,2008,10(1):14-19.
