高盐低温胁迫下水稻叶细胞ROS清除系统的相关基因表达
2015-07-05梁建生吴雪玲刘晓琴栗会召朱素琴
赵 静,梁建生,吴雪玲,刘晓琴,栗会召,朱素琴*
(1 南通大学 生命科学学院,江苏南通226007;2 南方科技大学,广东深圳518055)
植物响应高盐/低温胁迫的氧化还原控制途径是一个庞杂的抗氧化体系,该体系是在细胞质、叶绿体(基质、类囊体膜)和线粒体(内膜和基质)等中进行的酶促和非酶促生化反应的网络体系,涉及到光合电子传递、呼吸链电子传递。植物体内的活性氧(ROS)由抗氧化的非酶类物质如抗坏血酸(ASC)、谷胱甘肽(GSH)、生育酚等和抗氧化酶如超氧化物歧化酶(SOD)、抗坏血酸过氧化物酶(APX)、过氧化氢酶(CAT)等组成的抗氧化系统清除。水-水循环以及抗坏血酸-谷胱甘肽循环在植物抗氧化系统中起着重要作用[1]。植物的抗氧化系统活性明显受到环境胁迫因子的影响,并且与光合作用密切相关。当光合速率和电子传递能力处于最佳状态,细胞内的抗氧化系统维持本底水平的运行。逆境条件如低温、高盐、干旱等胁迫下,光合速率和电子传递速率都因逆境因子的影响而显著下降,此时抗氧化系统中的谷胱甘肽(GSH)、抗坏血酸(ASC)含量都上升到最高值。抗坏血酸在植物体内有多种重要功能,首先,在光保护过程中起着重要作用,调节非光化学淬灭(NPQ)和光化学淬灭的强度,直接调节紫黄质去环氧化酶的活性从而调节紫黄质循环的强度[2]。其次,它是细胞内外重要的抗氧化物质。ASC 可直接与活性氧反应而将其还原,又可作为酶的底物在活性氧的清除过程中起作用,即在叶绿体类囊体表面作为还原剂参与抗坏血酸过氧化物酶(APX)介导的H2O2的清除过程。在这一过程中,ASC 氧化成单脱氢抗坏血酸(MDHA)。叶绿体中APX 发挥正常的催化作用时,需要依赖单脱氢抗坏血酸还原酶(MDHAR)、脱氢抗坏血酸还原酶(DHAR)、铁氧还蛋白(ferredoxin,Fd)和谷氧还蛋白(GLR)等参与的4种反应源源不断地再生ASC。如ASC 分别利用NAD(P)H 或谷胱甘肽(GSH)作为电子供体,由MDHAR 或DHAR 催化过氧化物酶反应中的氧化产物得以再生,而这2种电子供体又可利用来自类囊体的电子再生[3]。由于ASC在清除活性氧的过程中发挥作用,故在叶绿体中,它与氧的摄入、APX的功能及分子氧还原相关的过程统称为“米勒-抗坏血酸过氧化物酶光呼吸[4]。另外,ASC及类囊体的质子化作用能提高紫黄质脱环氧化酶(VDE)的活性,促进了紫黄质循环,紫黄质循环中的紫黄质与ABA 的合成密切相关,可见植物响应逆境的氧化还原控制途径是一个相互协调的有机整体。
植物抗氧化系统是近30年来植物生理学研究的热门课题之一,目前已经深入到分子水平。人们试图通过基因工程手段改变或增加某种抗氧化物质的含量,或者增强某种抗氧化酶的活性提高逆境条件下植物的抗氧化能力,虽然在某些植物上有一些成 功 的 例 子[5-6],但 与 预 期 相 反 的 结 果 也 时 有 发生[7-8]。其原因是对氧化还原控制途径缺少“宏观”的研究,对氧化还原控制体系中的关键(或重要)成员缺少深入的“微观”探究。本研究以水稻为研究材料通过基因(表达谱)芯片技术,全面了解(扫描)高盐或低温逆境下水稻基因组基因表达情况,根据已有的研究结论将抗氧化体系中(酶类和非酶类物质)相关基因整合在一起,构建水稻响应高盐和低温逆境的氧化还原体系。
1 材料和方法
1.1 实验材料及处理
粳稻品种‘宁粳1号’(j-NJ-1)、籼稻9311(i-93-11)为实验材料。选取健壮饱满的种子,用1%H2O2溶液消毒。充分漂洗后28 ℃浸种48h,后于30 ℃催芽36h。待种子露白后,挑选长势良好的种苗播种于盛有蛭石的白瓷盘中,在植物生长箱(ZSX 1000GS,武汉瑞华仪器设备有限责任公司)中培养。培养温度为30 ℃/22 ℃(昼/夜),光子通量密度为200μmol·m-2·s-1。培养过程中,每隔2d更换1次木村B 培养液[9],培养幼苗至4叶期。然后进行如下处理。(1)对照(CK):水稻苗移入木村B 培养液继续培养,培养温度为30 ℃/22 ℃(昼/夜),光子通量密度为200μmol·m-2·s-1。(2)高盐逆境(SS):水稻苗移入含有NaCl的木村B培养液培养,NaCl浓度逐渐增加,第1、2、3天NaCl浓度分别为50、100和150 mmol/L。培养温度为30 ℃/22 ℃(昼/夜),光子通量密度为200μmol·m-2·s-1。(3)低温处理(LT):水稻苗移入木村B培养液培养,放入植物生长箱中,温度逐渐降低,第1、2、3天的温度分别为20℃、10℃和5℃。光子通量密度为200 μmol·m-2·s-1。
根据上述实验设计,共形成3种处理。第3天,将3种处理材料于200μmol·m-2·s-1PFD 下预处理2h,然后于1 200μmol·m-2·s-1PFD 下处理5h,其它条件不变。于高光处理后0和5h取功能叶片放入液氮中,用于基因表达谱分析。
1.2 RNA样品制备及基因芯片分析
采 用Trizol(Invitrogen,Gaithersburg,MD,USA)一步法提取水稻叶片中的总RNA,通过异丙醇沉淀法浓缩RNA,并进一步采用RNeasy mini spin column 试剂盒(Qiagen,Valencia,CA,USA)对总RNA 进行柱纯化,用分光光度计定量,甲醛变性胶电泳质检。采用NERCBBT 改良的RNA 扩增标记方法合成带生物素标记的cRNA,将纯化后的cRNA 与Affymetrix公司水稻全基因组芯片(该芯片含有48 564个针对粳稻和1 260个针对籼稻基因设计的探针组)42 ℃杂交过夜,然后在芯片工作站Fluidics Station450(Affymetrix)进行芯片洗脱,采用 芯 片 扫 描 仪Gene Chip Scanner 3000(Affymetrix)进行扫描。这些工作均由北京博奥生物有限公司完成,每个样品重复2次。
1.3 芯片图像的采集与数据分析
采用GenePix Pro 4.0图像分析软件(Axon Instruments公司)对芯片图像进行分析,把图像信号转化为数字信号;然后对芯片上的数据用Lowess方法进行归一化;使用芯片分析软件(Significant Analysis of Microarray,SAM)对每种样品处理前后的数据进行分析,差异表达基因筛选标准为表达值≥2倍的变化率(处理/对照)和P≤0.05(FDR adjusted P value)。
结合MAS(Molecular Annotation System)系统(包括Gene Ontology Biological Process,Gene Ontology Cellular Component,Gene Ontology Molecular Function),在 线 (http://www.ricechip.org/)查询相应蛋白质基因所对应的Affymetrix 57K 探针组,查找这些探针组所对应的基因芯片信号表达值,计算高盐/低温处理组与对照组的信号比值,把这些信号比值折算为以2为底的对数值,对这些 对 数 值 利 用Cluster 3.0 和TreeView version 1.60软件对可重复的差异表达基因进行Hierarchical聚类分析。
2 结果与分析
2.1 Affymetrix表达谱平台总RNA 质检和芯片杂交扫描结果
采 用Trizol(Invitrogen,Gaithersburg,MD,USA)一步法提取12 个水稻样本叶片的总RNA,纯化后,紫外分光光度计测定OD260,根据1OD=40 μg/mL RNA 的关系计算得出各RNA 样品的浓度(表1)。总RNA 样品进行1%甲醛变性琼脂糖凝胶电泳,检查总RNA 的完整性(图1),RNA 样品电泳条带清晰,28S比18SrRNA 条带亮度接近1∶1,质量符合表达谱芯片实验要求。

图1 水稻叶片总RNA 琼脂糖凝胶电泳1~12泳道编号同表1Fig.1 Agarose gel electrophoresis of total RNA extracted from leaves of rice 1-12correspond to the sequence number in Table 1

表1 Affymetrix表达谱平台总RNA质检报告Table 1 Evaluation of total RNA for Affymetrix expressional profiling
12个样本纯化后cRNA 产物分别与12张Genechip? Rice Genome Array进行杂交和扫描,芯片杂交扫描结果显示高盐低温下,水稻基因组中所有基因表达的荧光原始信号强度。芯片左上角有一清晰的“GeneChip Rice”字样,四周边界点线均匀一致,四角的点和中间的“+”字清晰,表明芯片质量可靠。信号检测报告表明,样品各项检测参数达到质控要求,Oligo B2、杂交控制探针等阳性对照信号、看家基因信号值正常;平均背景值与噪音值较低;阳性率数值正常。这些结果说明,本组基因芯片的质量和样品RNA 提纯质量都很好,杂交和检测体系亦无问题,芯片检测结果可靠。
2.2 胁迫下水稻叶片差异表达ROS清除酶基因
ROS清除系统包括清除ROS的酶类或蛋白和抗氧化剂。清除ROS 的酶类或蛋白有ROS 清除酶、抗氧化剂再生酶和ROS清除蛋白等3类。抗氧化剂主要有抗坏血酸、谷胱甘肽等[10-12]。

图2 胁迫下水稻叶片差异表达ROS清除酶基因的微阵列谱从左到右各列依次是酶及其催化反应、基因名称、基因ID和实验处理(J-LT,X-LT,J-SS,X-SS代码含义同表1);红色代表基因表达上调,绿色代表基因表达下调,黑色代表基因表达无变化;标尺下方数据表示基因表达量变化倍数,即处理与对照基因信号强度比值;图4和图6与此相同Fig.2 Microarray profile of differentially expressed genes of ROS scavenging enzymes in rice leaves under stresses The map displays the results for a given list of genes,with colour representing relative expression values(fold changes).Columns represent enzymes and catalytic reactions,gene names(Gene symbol),Os GI code/gb,and experimental treatments(J-LT,X-LT,J-SS,X-SS,codes are the same as in Table 1).All gene expression profiles(fold changes)were normalized for colour from red through black to green.Red indicates positive number(treatment vs.control),green indicates negative expression(repressed),and black indicates no change upon salinity or chill stress.Data below the scaleplate indicate fold change of gene expression,namely,the signal intensity ratio of expressed gene in treatment plant to expressed gene in control plant.The color scheme is the same as in Fig 4and Fig.6
ROS清除酶有超氧化物歧化酶(SOD)、抗坏血酸过氧化物酶(APX)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GPX)和过氧还蛋白(PrxR)等[13-14],在水稻中分别由12、12、5、6 和13 个基因编码(图2),图2显示了这些基因在低温或高盐逆境下的差异表达微阵列谱。
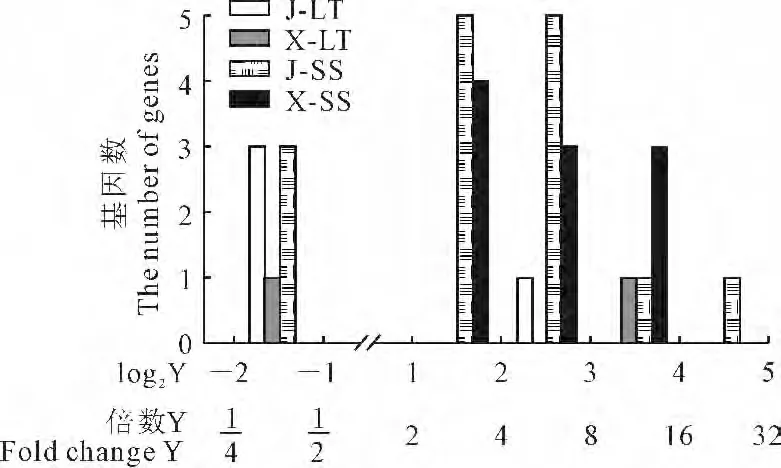
图3 差异表达ROS清除酶基因的统计分析Y 表示处理与对照信号强度比的倍数值,log2Y>或log2Y<-1分别表示基因上调表达或下调表达水平差异显著Fig.3 Statistical analysis of the differentially expressed genes of ROS scavenging enzymes Y represents a multiple value of processing and control signal intensity ratio;log2Y>1or log2Y<-1,respectively upregulated or down-regulated gene expression levels were significantly different

表2 水稻叶片差异表达的ROS清除酶基因Table 2 Differentially expressed genes of ROS scavenging enzymes in rice leaves
从图2、表2可以看出,在粳稻和籼稻中分别检测到19 个和12 个差异表达的ROS 清除酶基因。低温仅诱导1 个SOD 基因(GenBank:Ak104160.1)的表达上调,而高盐胁迫诱导表达上调的基因涉及到ROS清除酶基因的所有种类,如编码CAT 的LOC_Os02g02400和LOC_Os06g51150基因,编码SOD 的LOC_Os06g05110、LOC_Os06g02500和LOC_Os06g02510 基 因,编 码 APX 的LOC_Os08g41090基因,编码PrxR 的LOC_Os06g42000基 因,编码GPX的LOC_Os03g24380基因。逆境下水稻叶片内光呼吸增强,产生的超氧阴离子(O2)经过下列途径被清除:O-·2→H2O2→H2O。该途径的第一步反应由SOD 催化,产生的H2O2可被CAT、或被APX、或被GPX、或被PrxR 催化生成H2O 和其它产物,SOD 是ROS清除途径中的第一个关键酶,CAT、APX、GPX 和PrxR 是该途径的第二个重要酶或关键酶。过氧化物体参与光呼吸作用,位于过氧化物体中的APX4是ROS清除系统中的第二个关键酶,及时清除SOD 催化产生的H2O2,高盐下,APX4 基因表达明显上升。由图3和表2还可见,第一,差异表达的基因数和差异表达倍数(Y 值的大小)在籼、粳稻之间有差异,说明籼、粳稻对高盐或低温逆境的敏感性不同;第二,高盐处理后差异表达的ROS清除酶基因数显著多于低温处理,说明籼粳稻对高盐胁迫更敏感。
2.3 胁迫下水稻叶片差异表达的抗氧化剂再生酶基因

图4 胁迫下水稻叶片差异表达抗氧化剂再生酶基因的微阵列谱Fig.4 Microarray profile of differentially expressed genes of antioxidant regenerating enzymes in rice leaves under stresses
ROS清除系统中的抗氧化剂主要有抗坏血酸、谷胱甘肽等[10-12],在清除ROS 的过程中抗坏血酸(ASC)和谷胱甘肽(GSH)等抗氧化剂脱氢而被氧化成氧化型抗氧化剂如单脱氢抗坏血酸(MDHA)、脱氢抗坏血酸(DHASC)、氧化型谷胱甘肽(GSSG)等,此时需要抗氧化剂再生酶催化抗氧化剂还原。水稻叶片抗氧化剂再生酶有单脱氢抗坏血酸还原酶(MDHAR)、脱氢抗坏血酸还原酶(DHAR)、谷胱甘肽还原酶(GR)和谷氧还蛋白(GLR)等,分别由5个、3个、4个和36个基因编码(图4)。从图4和图5可知,低温对籼粳稻叶片MDHAR 基因、DHAR基因和GR 基因表达影响小,仅诱导极少数GLR 基因表达上调或下调。例如,经低温处理后粳稻叶片中,仅有一个编码GLR 基因表达下调,无表达上调相关基因;籼稻中有2个编码GLR 基因表达上调,分别是LOC_Os12g35340和LOC_Os01g27140基因,无相关表达下调基因。高盐胁迫可诱导籼粳稻许多抗氧化剂再生酶基因的表达变化,包括MDHAR 基 因、DHAR 基 因、GR 基 因 和GLR 基因。经高盐胁迫后粳稻中有7个表达上调的抗氧化剂再生酶基因,9个表达下调的相关基因;籼稻中有11个表达上调相关基因和6个表达下调的相关基因,其中3 个GLR 基因(LOC_Os01g09830,LOC_Os12g35340和LOC_Os01g27140)值得关注(表3)。LOC_Os01g09830基因在J-LT、X-LT、J-SS、X-SS等4 个处理中均下调表达,其Y 比值分别为0.44、0.59、0.08和0.16,说明高盐或低温逆境都会抑制这个基因的表达。LOC_Os12g35340基因仅在籼稻高盐或低温处理(X-LT,X-SS)中表达上调,其Y 值分别为4.14和5.05,而在粳稻高盐或低温处理(J-LT,J-SS)中表达水平无显著变化。LOC_Os01g27140基因在籼稻低温处理(X-LT)或高盐处理(X-SS)下表达均上调,其表达变化值Y 分别为2.79和41.42,而在粳稻低温(J-LT)处理下,表达没有变化,其Y值为0.98,而粳稻高盐(J-SS)处理下表达上调,其Y 值为11.45,体现了籼粳稻对高盐或低温逆境的敏感性差异。

图5 差异表达抗氧化剂再生酶基因的统计Fig.5 Statistical analysis of the differentially expressed genes of antioxidant regenerating enzymes

表3 水稻叶片差异表达的抗氧化剂再生酶基因Table 3 Differently expressed genes of antioxidant regenerating enzymes in rice leaves

表4 水稻叶片差异表达的ROS清除蛋白基因Table 4 Differently expressed genes of ROS scavenging proteins in rice leaves
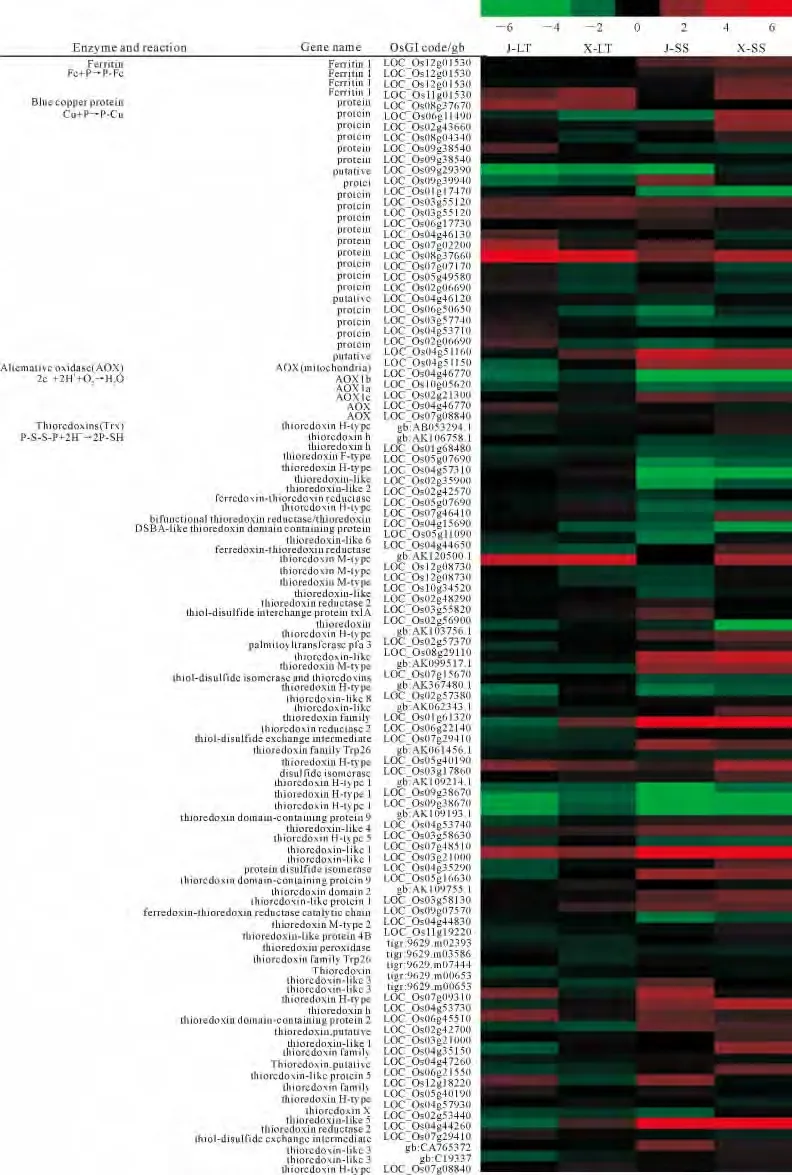
图6 胁迫下水稻叶片差异表达ROS清除蛋白基因的微阵列谱Fig.6 Microarray profile of differentially expressed genes of ROS-scavenging proteins in rice leaves under stresses
2.4 胁迫下水稻叶片差异表达的ROS清除蛋白基因
ROS清除蛋白和酶类主要有铁蛋白(Ferritin)、铜蓝蛋白(blue copper protein,BCP)、交替氧化酶(alternative oxidase,AOX)和硫氧还蛋白(thioredoxin,TRX)等,分别由2、20、5 和64个基因编码,共91个基因(图6)。从图6和图7 可知,低温诱导表达上调或表达下调的ROS清除蛋白基因,粳稻中7个、籼稻中3个,分别占总数(91)的7.7%和3.3%。高盐胁迫诱导表达上调或表达下调的ROS清除蛋白基因,粳稻中19个、籼稻中17个,分别占总数(91)的20.9%和18.7%。可见,低温逆境对籼粳稻叶片ROS清除蛋白基因表达水平的影响小,而高盐胁迫的影响非常明显,这一点与ROS清除酶基因的表达特性相似。上述高盐或低温诱导表达上调或表达下调的基因中有两组基因值得关注(表4)。第一组是高盐胁迫或低温逆境都能诱导表达上调的基因LOC_Os08g37660和LOC_Os07g48510,在JLT、X-LT、J-SS、X-SS处理中LOC_Os08g37660基因的表 达 倍 数 值Y 分 别 是7.93、4.43、1.57 和2.63,LOC_Os07g48510基因的表达倍数值Y分别是2.35、1.65、23.42和12.82,该8 个数据中尽管有2个数据(1.57和1.65)未达到2倍,但能体现基因表达是上调的。换言之,无论在高盐胁迫或低温逆境条件下基因LOC_Os08g37660 和LOC_Os07g48510都能发挥重要作用,这为今后进一步研究奠定了基础。第二组是仅在高盐胁迫下表达上调的基因,LOC_Os04g51160、LOC_Os08g29110、LOC_Os01g61320和LOC_Os02g53400共4个基因,在粳稻中它们的表达倍数Y 值分别是3.60、2.61、7.76和15.52,在籼稻中它们的表达倍数Y 值分别是2.68、3.61、17.50和85.05,它们的表达倍数Y 值高或非常高。LOC_Os04g51160 编码AOX 蛋白,LOC_Os08g29110、LOC_Os01g61320 和LOC_Os02g53400编码TRX 蛋白,它们在水稻响应高盐胁迫过程中有重要作用。

图7 差异表达ROS清除蛋白基因的统计分析Fig.7 Statistical analysis of the differentially expressed genes of ROS-scavenging proteins
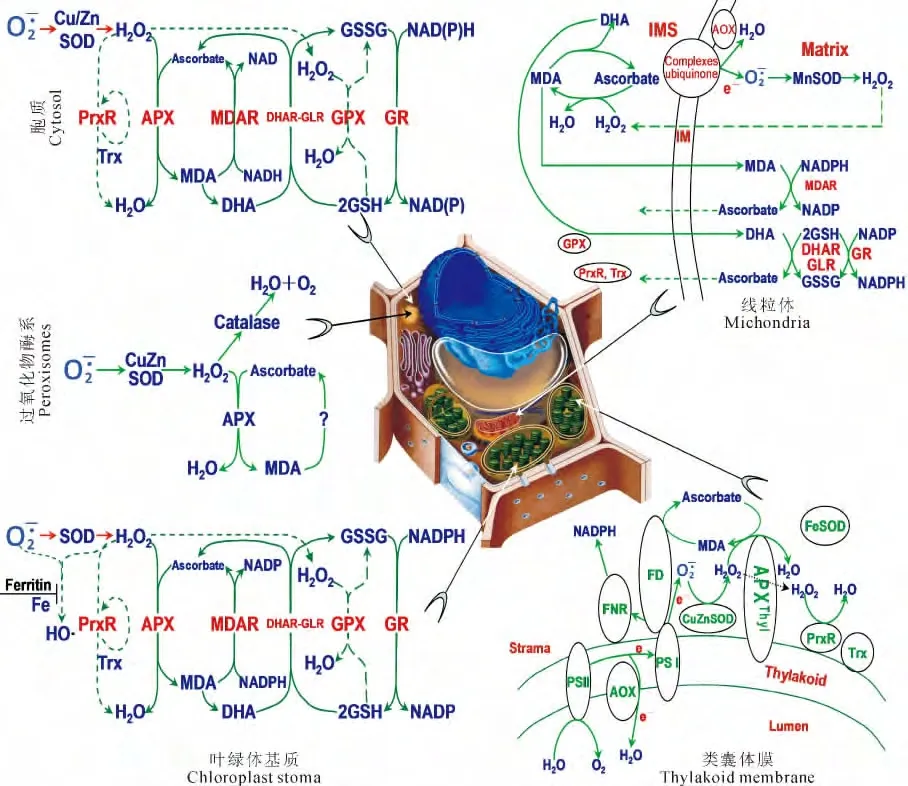
图8 水稻叶细胞内ROS清除途径的分布Fig.8 Distribution of ROS-scavenging pathways in rice leaves
2.5 水稻叶细胞内各区室的ROS清除途径
植物各细胞区室中几乎都存在多种ROS清除酶,且每一区室的不同种类ROS均有多种清除酶。叶绿体类囊体通过“水-水循环”通路清除O-·2和H2O2,叶绿体基质中ROS主要由基质SOD 及抗坏血酸-谷胱甘肽循环来清除。此外,PrxR 和谷胱甘肽过氧化物酶(GPX)也参与基质H2O2的清除。过氧化物酶体中,SOD、CAT 及APX 负责分解光呼吸和脂肪酸氧化产生的ROS。线粒体中同样存在SOD、AOX 及抗坏血酸-谷胱甘肽循环。胞质酶促系统与叶绿体基质基本一致,但两者编码这些酶的基因却不同。
根据芯片杂交结果、MAS(molecular annotation system)系统(包括Gene Ontology Biological Process,Gene Ontology Cellular Component,Gene Ontology Molecular Function)分析得出的结论,共获得了187个相关基因,由这些基因产物(酶)所参加的生化反应构建成水稻叶细胞内ROS清除途径的分布图(图8),主要阐明以下两个方面的原则。第一,基因表达的机动性。基因表达的机动性主要表现在对不同逆境胁迫的响应,同一个基因对不同的逆境有不同的响应,或在相同的逆境下相似功能的一组基因有不同的响应等。例如,水稻Fe-SOD基因(LOC_Os06g05110)低温胁迫5h后其表达略有上调(统计不显著),但经高盐胁迫5h后,其表达上调约10倍。又如,在相同的胁迫条件下(如高盐胁迫5h后),MDHAR(LOC_Os08g05570)基因表达上调2.9倍,而另一个MDHAR基因(LOC_Os09g39380)的表达量无显著变化。第二,基因或功能蛋白的冗余性。水稻响应高盐/低温胁迫的氧化还原控制网络包括SOD、APX、PrxR、GPX、CAT 和Trx等抗氧化酶,非酶促抗氧化剂GSH、ASC、类胡萝卜素等,GSH氧化为GSSG、ASC 氧化为MDHA 或DHA,这些非酶促抗氧化剂构建了细胞内主要的氧化还原缓冲体系。由这些抗氧化酶、非酶促抗氧化剂组成的氧化还原途径具有部分叠加功能,因此,不同氧化还原途径之间有补偿功能,即功能冗余,例如,维生素E缺失的拟南芥突变体中,ASC 和GSH 的含量增加[14]。冗余是生命进化过程中自然选择赋予的一种固有特性,也是生命有机体减少外界环境变化对其生存影响的保险对策,对于生命系统具有重大意义。基因间功能的冗余性就好像细胞为其生化活动的参与因子做了一个备份,一旦某个基因发生异常变化甚至失活,与其冗余的“备份基因”就会激活且发挥功能性作用,使得细胞整体的生命活动得以维系,而这也正是自然选择赋予生命进化的普适策略。
3 讨 论
3.1 氧化还原调控网络相关酶的协同作用
虽然细胞不同区室中的ROS清除路径相互分离,但H2O2等ROS 极 易 跨 膜 扩 散[12],且 抗 坏 血酸、谷胱甘肽等小分子抗氧化剂能在细胞不同区室间跨膜运转[13],因而细胞各区室的清除酶之间是相互协同作用的。对拟南芥的研究表明,ROS清除网络在细胞不同区室间的协同作用模式非常复杂,一般认为强光胁迫导致叶绿体或过氧化物酶体中ROS的过量产生,推测强光胁迫也可能诱导叶绿体中清除酶类基因的表达,但实验却发现强光胁迫诱导的是细胞质而非叶绿体中清除酶类基因的表达[15]。另外,植物体中至少有3 种ROS 清除酶基因可同时在叶绿体及线粒体中表达[16-17],说明这两个细胞器间具有高度协同的防御应答机制。
3.2 叶绿体是氧化还原调控网络的起点及终点
基于O2分子的化学性质、还原力需求状态以及多余光合电子带来的危害,叶绿体作为光合作用的场所与其它细胞器相比更易遭受氧化胁迫的伤害。叶绿体有多种ROS清除系统,至少包括2条完整的H2O2清除通路,即类囊体中的“水-水循环”和基质中的“抗坏血酸-谷胱甘肽循环”。在叶绿体中,H2O2和O-·2的产生与SOD、APX、CAT 等ROS清除酶的活性间存在动态平衡[18]。水稻至少有4种不同的叶绿体APX,即结合类囊体膜的APX8(LOC_Os02g34810)、基质APX5(LOC_Os12g07830)、基质APX6(LOC_Os12g07860)、基 质 APX7(LOC_Os04g35520)。而SOD在水稻叶绿体中有2种不同形式,即Cu/Zn-SOD(LOC_Os08g44770)和Fe-SOD(LOC_Os06g05110)。叶绿体抗坏血酸-谷胱甘肽循环中还存在另外一些清除酶。叶绿体中还有大量抗坏血酸及谷胱甘肽等抗氧化剂的存在,以还原或重新合成被氧化的生物分子。光照下叶绿体需重新修复被氧化的代谢物质,该过程对还原力的需求主要由光合电子传递链提供。伴随光氧化胁迫的增强,几乎全部光合电子被传递到抗氧化防御系统以提供还原力、增强抗氧化胁迫的能力[18]。现有报道表明,叶绿体信号转导由质体醌、硫氧还蛋白系统的氧化还原状态、四吡咯(tetrapyrroles)、碳水化合物及脱落酸等诱发,并进一步调控抗氧化酶和氧化还原调节因子的表达,从而说明叶绿体是氧化还原调控中的起点及终点[19]。
[1] ASADA K.The water-water cycle in chloroplasts:scavenging of active oxygens and dissipation of excess photons[J].Annual Review of Plant Physiology and Plant Molecular Biology,1999,50:601-639.
[2] MULLER-MOULE P,PATRICIA L C,NIYOGI K K.Ascorbate deficiency can limit violaxanthin de-epoxidase activity in vivo[J].Plant Physiology,2002,128(3):970-977.
[3] HOSSAIN M A,ASADA K.Purification of dehydroascorbate reductase from spinach and its characterization as a thiol enzyme[J].Plant Cell Physiology,1984,25(1):85-92.
[4] DSMOND C B,GRACE S C.Perspective on photoinhibition and photorespiration in the field:quintessential inefficiencies of the light and dark reactions of photosynthesis[J].Journal of Experimental Botany,1995,46(special issue):1 351-1 362.
[5] LI Y(李 筠),DENG X P(邓西平),GUO SH ZH(郭尚洙),et al.Drought tolerance of transgenic sweet potato expressing both Cu/Zn superoxide dismutase and ascorbate peroxidase[J].Journal of Plant Physiology and Molecular Biology(植 物 生 理 与 分 子 生 物 学 报),2006,32(4):451-457(in Chinese).
[6] ROSSEL J B,WALTER P B,HENDRICKSON L,et al.A mutation affecting ascorbate peroxidase 2gene expression reveals a link between responses to high light and drought tolerance[J].Plant Cell and Environment,2006,29(2):269-281.
[7] FOYER C H,NOCTOR G.Oxidant and antioxidant signailing in plants:a re-evaluation of the concept of oxidative stress in a physiological context[J].Plant Cell and Environment,2005,28(8):1 056-1 071.
[8] LIGHT G G,MAHAN J R,ROXAS V P,et al.Transgenic cotton(Gossypium hirsutum L.)seedlings expressing a tobacco glutathione stransferase fail to provide improved stress tolerance[J].Planta,2005,222(2):346-354.
[9] 薛应龙.植物生理学实验手册[M].上海:上海科学技术出版社,1985:63-64.
[10] BLOKHINA O,VIROLATINEN E,KURT V F.Antioxidants,oxidative damage and oxygen deprivation stress:a review[J].Annals of Botany,2003,91(2):179-194.
[11] MILLA M A R,MAURER A,HUETE A R,et al.Glutathione peroxidase genes in Arabidopsis are ubiquitous and regulated by abiotic stresses through diverse signaling pathways[J].The Plant Journal,2003,36(5):602-615.
[12] ZHANG M R(张梦如),YANG Y M(杨玉梅),CHENG Y X(成蕴秀),et al.Generation of reactive oxygen species and their functions and deleterious effects in plants[J].Acta Bot.Boreal.-Occident.Sin.(西北植物学报),2014,34(9):1 916-1 926(in Chinese).
[13] DEVLETOVA S,RIZHSKY L,MITTLER R,et al.Cytosolic ascorbate peroxides 1is a central component of the reactive oxygen gene network of Arabidopsis[J].Plant Cell,2005,17(1):268-281.
[14] HENZLER T,STEUDLE E.Transport and metabolic degradation of hydrogen peroxide in Chara corallina:model calculations and measurements with the pressure probe suggest transport of H2O2across water channels[J].Journal of Experimental Botany,2000,51(353):2 053-2 066.
[15] NOCTOR G,FOYER C H.Ascorbate and glutathione:keeping active oxygen under control[J].Annual Review of Plant Physiology and Plant Molecular Biology,1998,49:249-279.
[16] OBARA K,SUMI K,FUKUDA H.The use of multiple transcription starts causes the dual targeting of Arabidopsis putative monodehydroascorbate reductase to both mitochondria and chloroplasts[J].Plant Cell Physiology,2002,43(7):697-705.
[17] APEL K,HIRT H.Reactive oxygen species:Metabolism,oxidative stress,and signal transduction[J].Annual Review Plant Biology,2004,55:373-399.
[18] ASADA K.The water-water cycle as alternative photon and electron sinks[J].Philosophical Transactions of the Royal Society B:Biological Sciences,2000,355(1 402):1 419-1 431.
[19] BAIER M,DIETZ K J.Chloroplasts as source and target of cellular redox regulation:a discussion on chloroplast redox signals in context of plant physiology[J].Journal of Experimental Botany,2005,56(416):1 449-1 462.
