甘蓝型油菜新型细胞质雄性不育类型NRO4270A的鉴定
2015-07-05吴江生
舒 畅,刘 超,吴江生
(华中农业大学 国家油菜工程技术研究中心/农业部油菜遗传育种重点实验室,武汉430070)
利用细胞质雄性不育(cytoplasmic male sterility,CMS)生产杂交种是油菜杂种优势利用的主要途径[1]。CMS现象通常是由于植物线粒体DNA 的重排产生嵌合基因,编码异常多肽,阻碍花粉的正常发育所致[2-8]。国内外已报道的油菜CMS 的细胞质来源可分为两大类:一类是油菜品种间杂交或自然突变产生的雄性不育,即同源细胞质雄性不育,主要包括pol CMS、陕2ACMS和napCMS等;另一类为十字花科植物远缘杂交或原生质体融合产生的雄性不育,即异源细胞质雄性不育,主要包括ogu CMS和kos CMS 等。其中,pol CMS 系统/陕2A CMS是目前中国油菜生产上利用的重要类型,根据其对温度的敏感性,可分为高温不育型、低温不育型和稳定不育型,其中高温不育型较为普遍,在低温条件下易产生微量花粉,影响杂交种制种纯度;尽管ogu系统的不育性稳定,但由于其恢复基因受专利保护限制了其在中国的应用;nap 系统由于存在明显的温度敏感性,因此并不适合油菜的杂交种制种;tour系统由于育性不能被彻底恢复、难以实现三系配套而未能被有效利用[1]。目前在中国杂交油菜生产中,绝大多数应用的是pol CMS,已造成了不育细胞质单一化的局面。因此,选育新型稳定的细胞质雄性不育类型,不仅能克服不育细胞质类型单一化的潜在威胁,扩大油菜杂交种的遗传基础,同时也将有利于减小油菜杂交种的制种风险。
NRO4270A 是以萝卜甘蓝异源四倍体(Raphanus brassica,RRCC)为母本与甘蓝型油菜杂交,通过多代选育获得的稳定甘蓝型油菜不育系。本研究通过育性调查、恢保关系测定、花药发育的显微观察和线粒体DNA 的RFLP分析对该不育系进行鉴定,为该不育系的应用奠定基础。
1 材料和方法
1.1 试验材料
NRO4270A 是以人工合成的萝卜甘蓝异源四倍体[9-11]为母本与甘蓝型油菜杂交,从杂种后代中分离筛选出雄性不育株,通过进一步与甘蓝型油菜连续回交获得的遗传稳定的甘蓝型油菜萝卜甘蓝细胞质雄性不育系,NRO4270B 为其对应的保持系。本研究的主要材料(表1)包括5 种雄性不育材料(pol、ogu、kos、hau和NRO4270A)以及不同的保持系、恢复系,均种植于华中农业大学试验田、湖北省长阳县和甘肃省和政县油菜夏季繁殖基地。

表1 用于本研究的主要试验材料Table 1 Materials used in this study
1.2 育性鉴定
在湖北省武汉市、长阳县和甘肃省和政县,于开花期时对NRO4270A 不育系进行育性调查,并观察其是否存在死蕾现象。
1.3 恢保关系测定
在开花期,取表1 中不同保持系、恢复系以及‘华双4号’的花粉,分别与NRO4270A、pol、ogu、kos和hau 5种不育系进行测交。下一个种植季,分别种植测交后代F1。参考油菜的育性分级标准[12],在开花期对其进行3次育性调查。在F1育性调查过程中,只要有1次调查结果为不育即归为不育类(S);3次调查结果均无完全不育(即部分恢复育性)归为半不育类(PS);3次调查均为完全正常可育即归为恢复类(F)。分别记载不同单株的育性情况,比较不同不育系恢保关系的差异。
1.4 石蜡切片的制作
参考石蜡切片的制作技术[13],取NRO4270A CMS及其保持系NRO4270B 的花蕾制作石蜡切片,对其花粉发育过程进行细胞学观察:(1)取材与固定:在开花期,分别取 NRO4270A CMS 和NRO4270B 的花蕾,根据其长度从小到大分为六级,分别固定于FAA 溶液(70%酒精90 mL,福尔马林5mL,冰醋酸5mL)中24h;(2)染色:用适量的爱氏苏木精染料进行整体染色,3~5d后,用蒸馏水漂洗;(3)脱水:用不同浓度乙醇(30%、50%、70%、85%和95%)对材料进行逐级脱水,每级处理1h,无水乙醇脱水2次,每次1h;(4)透明:用梯度浓度氯仿(20%、40%、60%、80%)逐级透明,每级处理1h后,纯氯仿处理2次,每次1h;(5)浸蜡和包埋:加入等体积碎蜡,置于37℃恒温箱中。温育2d后,将材料转入带滤网的铁盒中,逐级浸蜡:50%石蜡(48 ℃)2h,75%石蜡(53 ℃)2h,纯蜡A(56 ℃)0.5h、纯蜡B(56 ℃)0.5h、纯蜡C(56 ℃)0.5h,然后在包埋盒中包埋材料;(6)切片:用KD-2508轮转式切片机对材料进行横切,蛋清甘油粘片和展片后,37 ℃下烘片3d以上;(7)脱蜡和封片:二甲苯脱蜡0.5~1h后,用树胶封片。37 ℃下烘片3d后,用Ds-Ri1全自动显微镜(Nikon)进行观察。
1.5 不同细胞质类型的RFLP分析
1.5.1 DNA 的提取和酶切 取实验材料新鲜叶片5g,采用CTAB 法[14]提取总DNA。加入200μL TE(Tris-EDTA)溶解DNA 后,检测DNA 质量及浓度。将总DNA分别进行酶切,酶切体系为:5μL10×buffer、15μg DNA、5 U 限 制 性 内 切 酶,加ddH2O 至50μL,37 ℃下酶切24h。

表2 线粒体探针扩增信息Table 2 Information of PCR-amplified mitochondrial probe
1.5.2 探针的制备和标记 根据已公布的甘蓝型油菜线粒体全基因组序列[15],利用软件Primer 5.0设计线粒体探针引物,相关基因包括atp1、atp6、atp9、orf222、cox2和cob(表2)。
PCR 扩增探针并通过凝胶回收后,利用随机引物DNA 标记试剂盒(TAKARA)对探针进行标记,反应体系 为:100ng 探 针DNA、2.0μL 随 机 引 物(9-mer),加ddH2O 至17.0μL,置于沸水中变性5 min后,再加入2.5μL 10×buffer、2.5μL dNTPs(-dCTP,0.2 mmol/L)、1μL Klenow 酶(2 U/μL)、2μLα-32P-dCTP(10Ci/μL),置于37 ℃水浴反应4h,沸水中变性10min后备用。
1.5.3 转膜和探针杂交 酶切产物在1.0%琼脂糖凝胶上电泳(电压30V)18~20h后,将凝胶置于0.25mol/L HCl溶液中10min,使指示剂变为黄色(脱嘌呤);蒸馏水漂洗凝胶后,转移至0.4 mol/L NaOH 溶液中变性10 min;蒸馏水洗净后,将凝胶转移至碱溶液(0.4mol/L NaOH)处理30min。利用0.4 mol/L NaOH 溶液将DNA 转移到尼龙膜上。将晾干的尼龙膜在80 ℃条件下烘烤2h后,保存于2×SSC溶液备用。
预杂交前,将尼龙膜放入杂交袋中。预杂交液和杂交液均为church buffer(0.25mol/L NaPO4缓冲 液pH 7.2、0.7% SDS、1%牛 血 清 蛋 白 和1 mmol/L EDTA),将church buffer预热至65℃,加入终浓度为100ng/μL 的变性鲑精DNA 后,将其加入杂交袋,在65 ℃的杂交箱中预杂交6~12h。将标记好的探针,加入杂交袋中混匀,65 ℃杂交过夜。1.5.4 洗膜和信号检测 杂交完成后,将杂交膜分别于65 ℃预热的洗膜液A(2×SSC、0.1%SDS;5 min)和洗膜液B(0.5×SSC、0.1%SDS;15min)中漂洗2次,检测放射性信号强度。将杂交膜晾干后压磷屏,在FLA-9000 激光检测仪(FUJIFILM)上检测杂交信号。
2 结果与分析
2.1 NRO4270ACMS花器官形态观察和育性鉴定
通过对花器官的形态观察发现,NRO4270A 不育系的花瓣正常,但雄蕊明显短于雌蕊,花药短小干瘪、乳白色,发育不良,呈三角形,无花粉形成,败育彻底(图1,A,C)。相比而言,正常甘蓝型油菜花瓣宽大,雄蕊长度明显高于雌蕊,花药饱满,发育正常,可见大量的花粉(图1,B,D)。
为检测NRO4270A CMS 不育对环境的敏感性,经连续5年(2009-2013)的育性调查。结果表明NRO4270ACMS的不育性稳定,在湖北省武汉市(冬油菜区)、长阳县(高海拔春油菜区)以及甘肃省和政县(高海拔春油菜区)不育度和不育率均为100%,对环境反应不敏感,表现无花粉,且无死蕾现象。
2.2 不同细胞质雄性不育系恢保关系测定

图1 甘蓝型油菜不育系NRO4270A 雄性不育的表现A、B.开放的花器官:A.NRO4270ACMS;B.可育甘蓝型油菜;C、D.去除花萼和花瓣的花器官:C.NRO4270ACMS;D.可育甘蓝型油菜Fig.1 Flower morphology of B.napus NRO4270ACMS A,B.Opening flower:A.NRO4270ACMS;B.Fertile B.napus;C,D.Opening flower with the sepals and petals peeled off:C.NRO4270ACMS;D.Fertile B.napus
8个甘蓝型油菜材料(25cc1、00N269c、9A001C、恢7-5、91-恢5900、恢5148、298033和‘华双4号’)分别与NRO4270ACMS、pol CMS、ogu CMS、kos CMS和hau CMS的恢保关系测定结果表明(表3):(1)25cc1、00N269c和9A001C与5种CMS测交,可以恢复ogu CMS和kos CMS的育性,但不能恢复其他3种CMS的育性,因此ogu CMS和kos CMS具有相同的恢保关系;(2)恢7-5、91-恢5900、恢5148和298033能够恢复pol CMS的育性,却不能恢复其他4种不育系的育性;(3)所有的测验系都是NRO4270ACMS和hau CMS的保持系。Hau CMS是来源于芥菜型油菜的细胞质雄性不育系,未获得恢复系[16]。另外,通过将NRO4270A CMS与大量的国内外甘蓝型、白菜型等油菜品种测交,目前仍未筛选得到可以稳定恢复其育性的材料。因此,NRO4270A CMS 与pol CMS、ogu CMS和kos CMS具有明显不同的恢保关系。
2.3 NRO4270ACMS花药发育的细胞学特性
NRO4270A 与NRO4270B 花药发育的细胞学特性比较结果显示:在造孢细胞时期NRO4270A 和NRO4270B 花粉囊壁形成药室内壁、中层及绒毡层,内层为造孢细胞(图版Ⅰ,A1、B1);造孢细胞进一步发育成花粉母细胞(图版Ⅰ,A2、B2),通过减数分裂形成正常的四分体,四分体被胼胝质包围,NRO4270A 绒毡层较NRO4270B 稍厚(图版Ⅰ,A3、B3)。
在 单 核 期,NRO4270B 和NRO4270A 花 药 发育开始出现明显的差异。(1)单核早期:NRO4270B花粉粒细胞质浓,细胞核居于中央,然而NRO4270A花粉粒的细胞质出现液泡化,无花粉外壁的形成,绒毡层细胞液泡化并逐渐膨大增厚(图版Ⅰ,A4、B4)。(2)单核中期:与NRO4270B相比,NRO4270A花粉粒的细胞质稀薄并继续液泡化,细胞核大多呈不规则形状分布(图版Ⅰ,A5、B5)。(3)单核晚期:NRO4270B花粉细胞质出现大的液泡,细胞核靠近细胞壁的一侧(图版Ⅰ,B6);NRO4270A 花粉粒细胞质彻底消失,细胞核解体,绒毡层细胞也逐渐解体(图版Ⅰ,A6)并最终消失,药室内仅剩下无细胞结构的残留物,并最终成为空腔(图版Ⅰ,A7、A8)。相比之下,NRO4270B 的花粉粒在成熟以后,由花药裂口处散出;绒毡层解体消失,花粉囊壁只剩下表皮和纤维层(图版Ⅰ,B7、B8)。因此,NRO4270A的花粉败育发生在四分体期至单核花粉期。
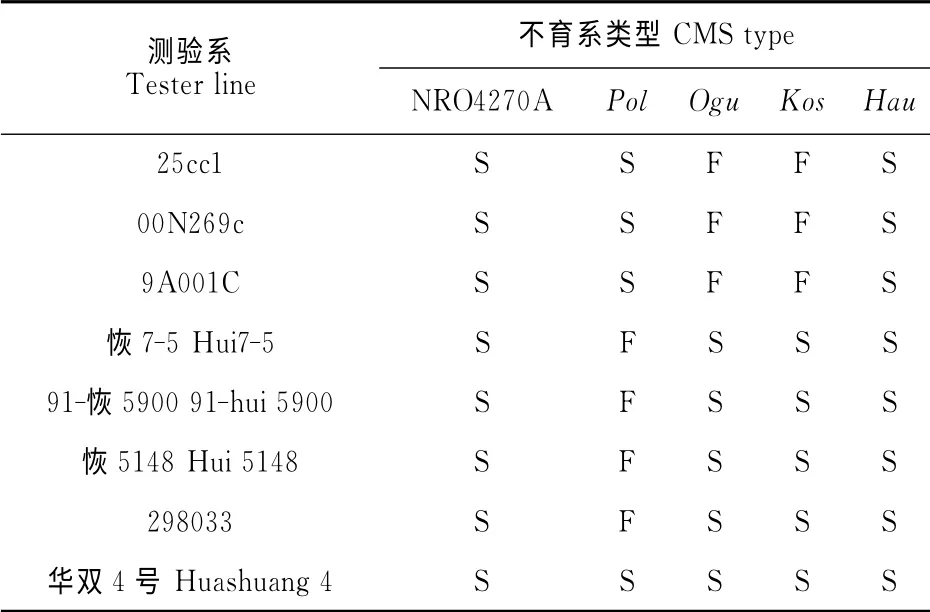
表3 5种不同细胞质雄性不育系的恢保关系测定Table 3 Identification of restorer and maintainer relationships between five different CMS types in B.napus

图2 不同油菜细胞质雄性不育系的RFLP分析1.pol CMS;2.ogu CMS;3.kos CMS;4~6.NRO4270ACMS;7.hau CMS;8.NRO4270B;9.华双5号Fig.2 RFLP analysis of various CMS types in B.napus 1.pol CMS;2.ogu CMS;3.kos CMS;4-6.NRO4270ACMS 7.hau CMS;8.NRO4270B;9.Huashuang 5
2.4 NRO4270ACMS线粒体DNA 的RFLP分析
通过RFLP 对不同油菜不育细胞质类型进行分类。结果显示(图2),在3种限制性内切酶(EcoRⅠ、BamHⅠ和HindⅢ)和6种线粒体探针(atp1、atp6、atp9、orf222、cox2和cob)组成的18个探针/酶组合中,3个cob组合在所有的材料中均未检测到多态性,其他的15个组合均检测到多态性。其中,对 于NRO4270A 不 育 系,cox2/EcoR Ⅰ组 合 在NRO4270A 和hau CMS中未检测到差异;在atp6的3个组合中,未检测到NRO4270A 与ogu CMS或kos CMS 的差异;在其他的11 种探针/酶组合中,NRO4270ACMS 均显示与pol CMS、ogu CMS、kos CMS、hau CMS、保持系NRO4270B和常规品种‘华双5号’有明显不同的带型。因此,结合恢保关系测定及RFLP 分析结果,说明NRO4270A CMS具有与pol CMS、ogu CMS、kos CMS和hau CMS明显不同的不育细胞质,是一种新型不育胞质类型。
3 讨 论
本研究显示,NRO4270A 不育系为典型的无花粉类型,在不同的环境条件下其不育度和不育率均为100%,不育性稳定,而且NRO4270A 农艺性状优良,异交结实率高,有利于繁殖不育系种子和生产杂交种。同时,NRO4270A 与pol CMS、ogu CMS、kos CMS 具有明显不同的恢保关系。由于NRO4270A 和hau CMS尚未发现恢复系,因此我们并不能明确两者恢保关系的差异。但是hau CMS的雄蕊退化为小花瓣,败育彻底,不能产生花粉[16],与NRO4270A 花器官的败育特点存在明显的差异。根据植物雄性不育的理论和实践经验,通过远缘杂交获得的细胞质雄性不育系,一般获得其恢复系较为困难[1]。考虑到NRO4270A 来源于萝卜甘蓝远缘杂交的后代,目前我们正试图从该物种中筛选其恢复源。
细胞学观察结果显示NRO4270A 的花粉败育主要发生在四分体期到单核晚期。前人的研究结果表明,hau CMS 的花药败育发生在雄蕊原基分化期,表现为雄蕊原基不能分化形成花药,败育彻底[16];Pol CMS花药发育在孢原细胞分化时期受阻,不能形成花粉囊;Ogu CMS花药发育受阻于四分体期至单核花粉期,在四分体期以前,其花药的发育与正常可育系相似,但是四分体期小孢子从四分体释放困难,且该时期持续时间较长,释放的小孢子细胞质液泡化,细胞核不分裂,花粉外壁发育不良,导致败育。而且上述不育系绒毡层发育表现为液泡化和延迟退化[17]。比较而言,NRO4270A 的绒毡层在四分体期开始出现液泡化现象,并且随着花药的发育,液泡化现象会逐渐严重,绒毡层也会肥大增厚并提前降解。另外,NRO4270A 的花粉粒不能形成花粉外壁,并且不能进行正常的有丝分裂形成成熟花粉粒。因此,尽管NRO4270A 与ogu CMS 的败育时期相似,然而它们的败育特点仍然存在一定的差异。结合植物雄性不育的相关研究结果[18-19],推测NRO4270A 绒毡层的提前降解可能与其细胞程序性死亡(programmed cell death,PCD)的异常有关,导致其不能为花粉外壁合成提供所需要的营养物质,因此花粉粒出现液泡化,并最终降解。
植物细胞质雄性不育的产生与线粒体DNA 的结构变化密切相关,而且不育区段编码产生异常多肽,最终 导 致 雄 性 不 育 现 象[2-8]。NRO4270A 不 育系是由萝卜甘蓝与甘蓝型油菜远缘杂交后代中选育获得,推测萝卜甘蓝的细胞质置换甘蓝型油菜可育细胞质后,造成细胞质和细胞核的基因功能不协调,导致了NRO4270A 的雄性不育。本研究中,线粒体DNA 的RFLP分析表明,有15个探针/酶组合可以区分不同细胞质。尽管ogu CMS和kos CMS具有相同的恢保关系,但是RFLP 分析表明在一些探针/酶组合(例如atp6/BamHⅠ)中,它们所检测到的带型并不相同,说明二者具有不同的不育机理,这与前人的研究结果一致[6]。另外,NRO4270A 的检测带型明显不同于其他细胞质雄性不育系,表明NRO4270A 为新型的细胞质雄性不育类型。而且进一步对NRO4270A 线粒体DNA 的多态性区段进行序列分析,将为其不育机理的研究提供更多线索。
[1] 傅廷栋.杂交油菜的育种和利用[M].武汉:湖北科学技术出版社,2000.
[2] SINGH M,BROWN G G.Suppression of cytoplasmic male sterility by nuclear genes alters expression of a novel mitochondrial gene region[J].Plant Cell,1991,3:1 349-1 362.
[3] BONHOMME S,BUDAR F,FERAULT M.A 2.5kb NcoI fragment of ogura radish mitochondrial DNA is correlated with cytoplasmic male sterility in Brassic hybrids[J].Current Genetics,1991,19:121-127.
[4] BONHOMME S,BUDAR F,LANCELIN D,et al.Sequence and transcript analysis of the Nco2.5Ogura-specific fragment correlated with cytoplasmic male sterility in Brassica hybrids[J].Molecular and General Genetics,1992,235:340-348.
[5] LANDGREN M,ZETTERSTRAND M,SUNDBERG E,et al.Alloplasmic male-sterile Brassicalines containing B.tournefortii mitochondria express an ORF 3’of the atp6gene and a 32kD protein[J].Plant Molecular Biology,1996,32:879-890.
[6] IWABUCHI M,KOIZUKA N,FUJIMOTO H,et al.Identification and expression of kosena radish(Raphanus sativus cv.Kosena)homologue of the ogura radish CMS-associated gene,orf138[J].Plant Molecular Biology,1999,39:183-188.
[7] L′HOMME Y,BROWN G G.Organization differences between cytoplasmic male sterile and fertile Brassica mitochondrial genomes are confined to a single transposed locus[J].Nucleic Acids Research,1993,21:1 903-1 909.
[8] L’HOMME Y,STAHL R J,LI X Q,et al.Brassica napcytoplasmic male sterility is associated with expression of a mtDNA region containing a chimeric gene similar to the pol CMS-associated orf224gene[J].Current Genetics,1997,31:325-335.
[9] CHEN H G(陈洪高),WU J SH(吴江生),CHENG Y G(程雨贵),et al.Development and GISH analysis of amphidiploid Raphanus brassica between Raphanus sativus and Brassica alboglabra[J].Acta Agronomica Sinica(作物学报).2006,32:1 117-1 120(in Chinese).
[10] CHENG Y G(程雨贵),WU J SH(吴江生),HUA Y W(华玉伟),et al.Genomic in situ hybridization in intergeneric hybrids between Raphanus sativus and Brassica oleracea[J].Hereditas(遗传).2006,28:858-864(in Chinese).
[11] CHEN H G,WU J S.Characterization of fertile amphidiploid between Raphanus sativus and Brassica alboglabra and the crossability with Brassicaspecies[J].Genetic Resource and Crop Evolution,2008,55:143-150.
[12] YANG G SH(杨光圣),FU T D(傅廷栋).A preliminary study on the restoring-maintaining relationship in rapeseed(Brassica napus and Brassica campestris)[J].Acta Agronomica Sinica(作物学报).1991,17:151-156(in Chinese).
[13] 李和平.植物显微技术[M].北京:科学出版社,2009.
[14] DOYLE J J,DOYLE J L.A rapid DNA isolation procedure for small quantities of fresh leaf tissue[J].Phytochemical Bulletin,1987,19:11-15.
[15] HANDA H.The complete nucleotide sequence and RNA editing content of the mitochondrial genome of rapeseed(Brassica napus L.):comparative analysis of the mitochondrial genomes of rapeseed and Arabidopsis thaliana[J].Nucleic Acids Research,2003,31:5 907-5 916.
[16] WAN Z,JING B,TU J,et al.Genetic characterization of a new cytoplasmic male sterility system(hau)in Brassica junceaand its transfer to B.napus[J].Theoretical and Applied Genetics,2008,116:355-362.
[17] YU F Q(余凤群),FU T D(傅廷栋).Cytomorphological research on anther development of several male-sterile lines in Brassica napus L.[J].Journal of Wuhan Botanical Research(武汉植物学研究),1990,8:209-216(in Chinese).
[18] PARISH R W,LI S F.Death of a tapetum:aprogramme of developmental altruism[J].Plant Science,2010,178:73-89.
[19] DUN X,ZHOU Z,XIA S,et al.BnaC.Tic40,aplastid inner membrane translocon originating fromBrassica oleracea,is essential for tapetal function and microspore development in Brassica napus[J].The Plant Journal,2011,68:532-545.

图版Ⅰ 甘蓝型油菜不育系NRO4270A 和保持系NRO4270B的花药发育的显微解剖结构NRO4270A:A1.造孢细胞时期;A2.小孢子母细胞时期;A3.四分体时期;A4.单核早期;A5.单核中期;A6.单核晚期;A7.小孢子和绒毡层细胞降解;A8.空的花粉囊;NRO4270B:B1.造孢细胞时期;B2.小孢子母细胞时期;B3.四分体时期;B4.单核早期;B5.单核中期;B6.单核晚期;B7.二核期;B8.成熟小孢子。PlateⅠ Microscopical structure of anther development in B.napus CMS NRO4270Aand its maintainer line NRO4270B Fig.A1.Sporogenous cell stage;Fig.A2.Microspore mother cell stage;Fig.A3.Tetrad stage;Fig.A4.Early mononucleate stage;Fig.A5.Middle mononucleate stage;Fig.A6.Later mononucleate stage;Fig.A7.Tapetal cells and microspores disappear;Fig.A8.Empty pollen sac;Fig.B1.Sporogenous cell stage;Fig.B2.Microspore mother cell stage;Fig.B3.Tetrad stage;Fig.B4.Early mononucleate stage;Fig.B5.Middle mononucleate stage;Fig.B6.Later mononucleate stage;Fig.B7.Dinucleate stage;Fig.B8.Mature microspore stage.
