三倍体‘银中杨’叶肉原生质体制备的优化
2015-07-04宋少宇张俊琦
宋少宇,张俊琦,王 君*
(1北京林业大学 林木育种国家工程实验室,林木花卉遗传育种教育部重点实验室,生物科学与技术学院,北京100083;2北京林业大学 公共分析测试中心,北京100083)
植物原生质体是获得细胞无性系和选育突变体的优良起始材料,在植物快速繁殖、远缘遗传重组、转基因以及品种改良和创造新类型等方面具有广阔的应用前景[1-2]。利用原生质体可以进行细胞融合和体细胞杂交,能有效克服植物有性杂交不亲和现象,扩大种、属间的基因交流,丰富种质遗传资源,是一种创造远缘杂种,获得同源或异源三倍体、四倍体以及双二倍体的新途径[3-4];同时,原生质体又是植物基因工程的理想受体,可为外源基因、DNA 片段、细胞器、染色体捕获创造一种新方法[5]。
杨树(PopulusL.)作为木本植物生物技术及遗传学研究的模式树种[6-7],有关原生质体的分离与培养已有一定的研究基础。目前,国内外相继报道了毛白杨(P.tomentosa)、胡杨(P.euphratica)、美洲黑杨×欧美杨(P.deltoids×P.euramericana)、欧洲山杨×白杨(P.tremula×P.alba)等树种原生质体的成功游离,认为酶的种类与浓度、渗透压、酶解时间、酶解温度、pH 值、不同材料和取材时间对原生质体的游离有显著影响[8-11]。而且,已在毛白杨、北京杨(P.×beijingensis)、黑杨×大青杨(P.nigra×P.maximowiczii)等树种中通过原生质体培养获 得 了 再 生 植 株[8,12-13]。然 而,这 些 研 究 均 以二倍体树种作为材料,而作为杨树育种的重要产品——三倍体品种,尚未见有关原生质体游离和培养的报道。三倍体杨树通常具有较强的生长能力和抗逆性,以三倍体原生质体为材料开展体细胞融合、基因工程及外源基因瞬时表达等研究对于杨树遗传改良及基因工程研究可能具有重要意义。
‘银中杨’(P.alba×P.berolinensisYinzhong)是以银白杨(P.alba)为母本,中东杨(P.berolinensis)为父本,经人工远缘杂交选育而成的杨树品种,属白杨派与黑杨派派间杂种,并经进一步鉴定为三倍体品种[14]。‘银中杨’树干通直、形态优美、可扦插繁殖、生长迅速、材质优良,适宜作为民用建筑用材和造纸用材;同时,‘银中杨’抗逆性强、适应范围广,且为雄性无性系,具有不飞絮的优良特性。因此,‘银中杨’既是营造速生丰产林的优良树种,也是“三北”防护林、水源涵养林及北方寒冷地区城市绿化的优秀树种[15]。但‘银中杨’扦插较难生根,成活率低,且苗期易受白杨透翅天蛾及青杨天牛的危害,给苗木繁育带来困难[16-17]。本研究以‘银中杨’无菌苗为试验材料,探索了叶肉原生质体分离与纯化条件,为通过细胞工程及基因工程育种等途径开展‘银中杨’遗传改良及品种优化提供了新的途径。
1 材料与方法
1.1 材 料
于内蒙古通辽市采集‘银中杨’1年生枝条,塑料布包裹运至北京林业大学,于温室水培。无菌体系的建立和原生质体分离试验在林木良种繁育技术研究室进行。
1.2 原生质体分离酶种类及浓度筛选
本研究采用四因素三水平正交试验设计[L9(34)]筛选酶的种类及浓度(表1),并采用单因素试验进一步对Cellulase RS浓度进行筛选(表4)。
剪取苗龄为25~30d的无菌苗第2~5片伸展叶片,将叶片切成宽0.5mm 左右的细条置于含0.7 mol/L甘露醇的CPW 盐溶液(pH 5.8)中,于4 ℃黑暗条件下预质壁分离1~1.5h。随后将鲜重1g的叶片放入10mL经过滤灭菌的混合酶液中,酶液为CPW 盐溶液+0.6g/L MES+1g/L 牛血清蛋白+0.6mol/L甘露醇,pH 5.8,28 ℃慢速往复式摇床(40~60r/min)上黑暗酶解7h。
每个处理重复3次,酶解产物依次经200目和400目不锈钢细胞筛过滤,以除去未酶解完全的细胞团或组织,1 000r/min离心3min,用新鲜洗液洗涤3次收集原生质体,稀释到一定体积后统计原生质体产量及活力。
1.3 原生质体分离甘露醇浓度筛选
在由3.0% Cellulase RS+0.5% Macerozyme R-10+0.3%Pectinse Y-23组成的混合酶液中,分别添加0.4、0.5、0.6、0.7、0.8mol/L甘露醇进行渗透压调节,测定不同渗透压下的原生质体分离情况。
1.4 原生质体分离酶解时间筛选
在由3.0% Cellulase RS+0.5% Macerozyme R-10+0.3%Pectinse Y-23+0.6mol/L 甘露醇组成的混合酶液中,对‘银中杨’叶片分别进行2、4、6、8、10、12h黑暗酶解,测定不同酶解时间下原生质体的分离情况。
1.5 原生质体纯化方法筛选
在CPW+3.0% Cellulase RS+0.5% Macerozyme R-10+0.3%Pectinse Y-23+0.6mol/L 甘露醇的混合酶液中,对‘银中杨’叶片进行酶解,酶解时间为8h。酶解完成后,酶解产物依次经200目和400目不锈钢细胞筛过滤,分别使用上浮法和下沉法对‘银中杨’叶肉原生质体进行纯化,测定不同纯化方法下原生质体的纯化效果。
(1)上浮法。将滤液经1 000r/min 离心3 min,收集沉淀并将之悬浮在蔗糖含量分别为30%、35%、40%、45%CPW+0.6 mol/L 甘露醇溶液中。在其上缓缓加入适量CPW+0.6 mol/L 甘露醇溶液,1 000r/min离心5min,在蔗糖-甘露醇界面上收集原生质体。原生质体用CPW+0.6 mol/L 甘露醇溶液洗涤2次。
(2)下沉法。将滤液经1 000r/min离心3min,收集沉淀并将之悬浮在CPW+0.6mol/L甘露醇溶液中。在离心管中加入蔗糖含量分别为30%、35%、40%、45%CPW+0.6mol/L甘露醇溶液,将原生质体混合液缓缓铺于其上方,1 000r/min离心5min,在蔗糖-甘露醇界面上收集原生质体。原生质体用CPW+0.6mol/L甘露醇溶液洗涤2次。
1.6 原生质体的产量与活力测定
用血球计数板统计原生质体产量,每个样品重复计数5次,取平均值,最后计算原生质体产量。
原生质体数(个/mL)=5个大格内原生质体总数×5×10 000×稀释倍数;
原生质体产量(个/g)=[原生质体数(个/mL)×稀释后体积(mL)]/叶片总质量(g);
对获得的原生质体产量试验数据进行开平方根转换后,用Excel进行统计分析。
用0.01%二乙酸荧光素(FDA)染色进行原生质体活力测定,每个样品观测5次,取平均值。
原生质体活力=(发绿色荧光的原生质体数÷原生质体总数)×100%。
2 结果与分析
2.1 不同酶浓度组合对原生质体分离的影响
本试验采用L9(34)正交试验设计,对‘银中杨’原生质体分离所需的酶种及最佳处理浓度进行筛选。由极差分析(表1)可知,Cellulase RS的R值最大为572.98,表明Cellulase RS对‘银中杨’原生质体分离的影响最大;Hemicellulase的R值最小为164.93,表明其影响最小。各因素对‘银中杨’原生质体产量的影响顺序为:Cellulase RS>Pectinse Y-23>Macerozyme R-10>Hemicellulase。本试验中第7个处理组合原生质体产量最高,最接近最优组合。
方差分析(表2)发现,Macerozyme R-10 和Hemicellulase各个水平间差异不显著,应选择最低浓度,而Cellulase RS和Pectinse Y-23各个水平间差异极显著。采用最小显著差数法(LSD)对Cellulase RS 和Pectinse Y-23 各个水平进行多重比较(表3),Cellulase RS第3水平最好,与第1、2水平差异极显著。由于最好的结果出现在Cellulase RS最高水平上,不能肯定是否为最佳处理浓度,因此需要通过单因素试验进一步筛选其最佳处理浓度(表4)。Pectinse Y-23第2水平处理效果最好,且与第1、3水平差异极显著,水平2、3间差异不显著,因此Pectinse Y-23最佳处理浓度为第2水平,即0.3%。

表1 不同酶种类及其浓度处理‘银中杨’叶肉原生质体产量及分析Table1 Range analysis of enzyme solution for Populus alba×P.berolinensis Yinzhong mesophyll protoplast yields

表2 方差分析表Table2 Analysis of variation
Cellulase RS单因素试验(表4)结果表明,Cellulase RS的各处理间原生质体产量差异极显著,Cellulase RS浓度为第1 水平(3.0%)时原生质体产量极显著性高于其他处理,第2、3水平之间原生质体产量差异不显著,且随着Cellulase RS浓度的升高原生质体产量下降,而原生质体活力差异不显著。因此,‘银中杨’叶片原生质体分离最佳酶浓度组合为3%Cellulase RS+0.5% Macerozyme R-10+0.3%Pectolase Y-23。
2.2 不同甘露醇浓度对原生质体分离的影响
在各种酶浓度一定的条件下,使用不同浓度甘露醇调节渗透压。结果(图1)表明,甘露醇浓度对原生质体的产量和活力有极显著性影响。当甘露醇浓度在0.4~0.6mol/L范围内逐渐升高时,原生质体产量和活力也随之升高;当甘露醇浓度达到0.6 mol/L时,原生质体产量和活力均达到最高值,且显著性高于其他处理,分别为1.84×107个/g 和83.28%(图3,A、C);当甘露醇浓度为0.6~0.8 mol/L 时,原生质体产量和活力都随着甘露醇浓度的升高而降低。因此,‘银中杨’原生质体游离最佳甘露醇浓度为0.6mol/L。

表3 Cellulase RS和Pectinse Y-23各个水平之间的多重比较Table3 Multiple comparisons among levels of Cellulase RS and Pectinase Y-23

表4 Cellulase RS处理浓度对原生质体产量和活力的影响Table4 Effects of Cellulase RS on protoplast yields and viability
2.3 不同酶解时间对原生质体分离的影响
在酶浓度和渗透压一定的条件下,设置酶解时间分别为2、4、6、8、10、12h。结果(图2)表明,酶解时间对‘银中杨’原生质体的产量和活力有极显著性影响。随着酶解时间的增长,原生质体产量会有所提高,但原生质体的活力逐步降低(图2)。酶解时间为2~8h时,原生质体产量随着酶解时间的增长而逐渐增加,且在酶解8h时达到最高;酶解时间超过8h后,原生质体产量随着酶解时间的增长而减少,在12h时原生质体产量高于10h但差异不显著,这可能是由试验误差等因素引起的;当酶解时间为8h时,原生质体的产量极显著性高于其他酶解时间,达2.13×107个/g。原生质体的活力随酶解时间的增长而逐渐降低,酶解时间为4~8 h时,原生质体活力差异不显著;酶解时间为10~12h时原生质体活力降低的幅度加大,且极显著性低于酶解时间为8h时的原生质体活力。因此,‘银中杨’叶肉原生质体最佳游离时间为8h。

图1 甘露醇浓度对原生质体产量和活力的影响Fig.1 Effects of mannitol concentration on protoplast yield and viability

图2 酶解时间对原生质体分离的影响Fig.2 Effects of enzymolytic time on protoplast isolation
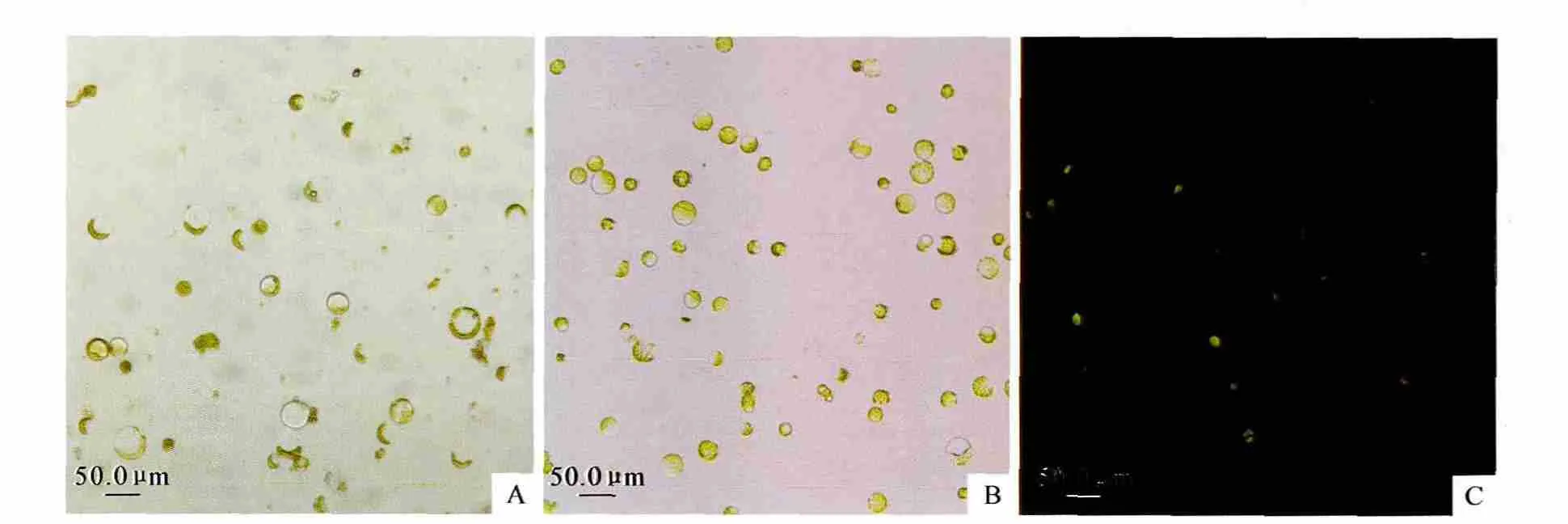
图3 ‘银中杨’叶肉原生质体分离与纯化Fig.3 Isolation and purification of mesophyll protoplasts of P.alba×P.berolinensis Yinzhong
2.4 蔗糖浓度和纯化方法对原生质体纯化的影响
酶解完成后分别采用不同浓度的蔗糖对酶解产物进行等密度离心纯化,并对比上浮法和下沉法的纯化效果(表5)。由表5可知,上浮法的纯化效果明显优于下沉法。随着蔗糖浓度的增加,纯化后原生质体产量逐渐增加,到45%时产量达到最大,但杂质含量也达到最大;而蔗糖浓度为40%时原生质体产量也很高,为1.06×107个/g,且杂质含量较低,为19.05%。因此,采用上浮法用40%蔗糖,在1000r/min下离心5min,原生质体产量较高,杂质含量较少,纯化效果较好(图3,B)。
3 讨 论
原生质体分离时,材料本身的性质和生理状态对原生质体分离甚至培养有着重要影响[18],组织培养的无菌苗生长整齐,生理状态比较一致,成苗期短,经过继代培养,可保持树木的幼态特征,是分离原生质体比较理想的材料,能提高试验的重复性[19]。Park和Son从黑杨×大青杨杂种叶片分离获得大量有活力的原生质体,产量为1.04×107个/g[13];而蔡肖和康向阳以小青杨无菌苗叶片为材料,游离原生质体的产量达到2.44×107个/g[20]。可见,不同树种叶肉原生质体分离效果有所差异,这可能与其叶片结构及细胞壁组成有关。本研究采用‘银中杨’培养约30d的无菌苗叶片分离原生质体,原生质体活力为80.18%,产量为2.13×107个/g,可以满足进一步进行原生质体培养的要求。

表5 蔗糖浓度及纯化方法对原生质体纯化效果的影响Table5 Effects of different sucrose concentration and purification methods on protoplast purification
影响原生质体分离效果的因素有很多,酶的种类与浓度影响最大。Conde和Santos对比了Cellulase RS 和Cellulase R-10 对小叶榆(UlmusminorMill.)叶肉原生质体分离的影响,发现Cellulase RS分离效率更高[19]。景艳春等进行新疆杨(P.albaL.var.pyramidalis)叶肉原生质体游离时酶液中添加了0.5% Hemicellulase,产量可达1.57×107个/g[21],而本研究中‘银中杨’叶肉原生质体分离在未添加Hemicellulase情况下,产量远高于前者,达2.13×107个/g。可见,不同酶种类对原生质体分离效果影响不同,不同树种原生质体分离所需要的酶种类及浓度也有所差异,这可能与其细胞壁组成成分有关。本研究通过正交试验设计和单因素简单试验设计,筛选出最佳酶组合为3%Cellulase RS+0.5% Macerozyme R-10+0.3%Pectinse Y-23。
为保持原生质体膜稳定性,常常在酶液中加入甘露醇作为渗透压调节剂。不同植物原生质体分离时采用的甘露醇浓度也有所差异,一般浓度为0.3~0.8mol/L。拟南芥(Arabidopsisthaliana)叶肉原生质体分离时甘露醇浓度为0.4mol/L[22],王善平等在分离毛白杨原生质时甘露醇浓度则为0.5 mol/L[8]。而本研究中‘银中杨’叶肉原生质体分离适宜的甘露醇浓度为0.6mol/L,与王善平所采用的甘露醇浓度有所不同,这可能是由于不同植物细胞质浓度有所差异。
酶解时间的长短对于获得原生质体的产量和活力影响很大。酶解时间短,则酶解不够充分,原生质体产量低;酶解时间过长,对原生质体有毒害作用,导致原生质体产量和活力降低[23]。百合(Lilium ledebouriiBioss.)叶片原生质体分离需要24h[23],毛白杨叶肉原生质体分离需要12~14h[8],而本研究中‘银中杨’叶肉原生质体分离最佳酶解时间则为8h。可见,不同植物和材料对酶解时间的需求有所差异。酶解时间可能与起始材料、酶的种类和浓度等因素有关,应根据具体情况进行探索。另外,在本研究中酶解12h原生质体产量高于酶解10h,但差异不显著,在他人的研究结果中未发现类似情况,这可能是由试验误差等因素引起的数据小幅度波动。
原生质体纯化方法是影响原生质体产量和活力的重要因素之一。景艳春等进行新疆杨原生质体纯化时,采用上浮法蔗糖浓度为30%时纯化效果最好[21]。然而,在‘银中杨’叶肉原生质体纯化时,上浮法蔗糖浓度为40%时,纯化效果最好,产量达1.06×107个/g。可见,不同树种原生质体纯化方法有所不同,这可能是因为其细胞大小、密度等有所差异,纯化过程中细胞所受的离心力不同。
许多杨树品种都是三倍体,杨树三倍体生殖能力降低,材积的增益更大,在速生性、材质、抗逆性以及对病虫害的防御能力方面具有明显优势[24]。原生质体是理想的基因工程受体,利用转基因技术对三倍体进行遗传改良有可能极大地提高抗性和木材品质等。三倍体原生质体的获得有利于通过功能基因瞬时表达分析进行多倍体数量性状表达相关研究,以及三倍体细胞内信号通路等研究。同时,三倍体与二倍体或三倍体细胞进行融合可获得五、六倍体杂种,为育种工作提供遗传材料。加强对三倍体杨树的细胞工程及基因工程育种技术研究,可以为育种工作提供新的途径和遗传材料,具有重要意义。
[1] PUITE K J.Progress in plant protoplast research[J].PhysiologiaPlantarum,1992,85(2):403-410.
[2] PENG SH F(彭邵峰),LU J(陆 佳),CHEN Y ZH(陈永忠),etal.Research progress of protoplast culture in woody plants[J].Chinese AgriculturalScienceBulletin(中国农学通报),2013,29(1):1-6(in Chinese).
[3] EECKHAYT T,LAKSHMANAN P S,DERYCKERE D,etal.Progress in plant protoplast research[J].Planta,2013,328(6):991-1 003.
[4] GROSSER J W,GMITTER F G J.Protoplast fusion for production of tetraploids and triploids:applications for scion and rootstock breeding in citrus[J].PlantCell,TissueandOrganCulture,2011,104(3):343-357.
[6] BRADSHAW H D,CEULEMANS R,DAVIS J,etal.Emerging model systems in plant biology:poplar(Populus)as a model forest tree[J].JournalofPlantGrowthRegulation,2000,19(3):306-313.
[7] TUSKAN G A,DIFAZIOS S,JANSSON S,etal.The genome of black cottonwood,Populustrichocarpa(Torr.& Gray)[J].Science,2006,313(5 793):1 596-1 604.
[8] WANG SH P,XU ZH H,etal.Culture and regeneration of poplar mesophyll protoplasts[J].ScienceinChina(Chemistry),1991,34(5):587-592.
[9] GAO ZH,DAI S X,CHEN SH L,etal.Isolation of protoplast from callus ofPopuluseuphraticaand H+fluxes across plasma membrane under NaCl stress[J].ForestryStudiesinChina,2007,9(3):198-202.
[10] GUO J J,MORRELL-FALVEY J L,LABBJ L,etal.Highly efficient isolation ofPopulusmesophyll protoplasts and its application in transient expression assays[J].PlosOne,2012,7(9):e44908.
[11] TAN B Y,XU M,CHEN Y,etal.Transient expression for functional gene analysis usingPopulusprotoplasts[J].PlantCell,Tissue andOrganCulture,2013,114(1):11-18.
[12] CAI X,KANG X Y.Plant regeneration from cell suspension-derived protoplasts ofPopulus×beijingenisis[J].InVitroCellular&DevelopmentalBiology-Plant,2014,50(1):92-98.
[13] PARK Y G,SON S H.Invitroshoot regeneration from leaf mesophyll protoplasts of hybrid poplar(Populusnigra×P.maximowiczii)[J].PlantCellReports,1992,11(1):2-6.
[14] CHEN CH B(陈成彬),QI L W(齐力旺),ZHANG SH G(张守攻),etal.The karyotype analysis of triploid poplar[J].JournalofWuhanBotanicalResearch(武汉植物学研究),2004,22(6):565-567(in Chinese).
[15] XU H W(徐洪伟),GAO F(高 峰),YANG W X(杨伟新),etal.Leafinvitroregeneration andGt5GT7genetic transformation inPopulusalba×P.berolinensis.[J].GuangdongAgriculturalSciences(广东农业科学),2014,(13):144-146(in Chinese).
[16] ZHOU L J(周丽君),KANG ZH X(康忠信),GENG L Y(耿丽英),etal.The breeding and use ofPopulusalba×P.berolinensisYinzhong[J].ProtectionForestScienceandTechnology(防护林科技),1992,(1):23-27(in Chinese).
[17] ZHANG CH H(张春晖),NAN H T(南海涛),etal.The urban and rural greening application prospect ofPopulusalba×P.berolinensisYinzhong[J].InnerMongoliaForestryInvestigationandDesign(内蒙古林业调查设计),2005,(1):63-64(in Chinese).
[18] RAIKAR S V,BRAUN R H,BRYANT C,etal.Efficient isolation,culture and regeneration ofLotuscorniculatusprotoplasts[J].Plant BiotechnologyReports,2008,2(3):171-177.
[19] CONDE P,SANTOS C.An efficient protocol forUlmusminorMill.protoplast isolation and culture in agarose droplets[J].PlantCell,TissueandOrganCulture,2006,86(3):359-366.
[20] CAI X(蔡 肖),KANG X Y(康向阳).Isolation of mesophyll protoplasts fromPopuluspseudo-simoniiKitag.[J].ChineseAgricultural ScienceBulletin(中国农学通报),2011,27(10):18-22(in Chinese).
[21] JING Y CH(景艳春),KANG X Y(康向阳),WANG J(王 君),etal.Isolation and purification of mesophyll protoplasts ofPopulusalbaL.var.pyramidalis[J].ActaBotanicaBoreali-OccidentaliaSinica(西北植物学报),2007,27(3):509-514(in Chinese).
[22] WU F H,SHEN SH CH,LEE L Y,etal.Tape-ArabidopsisSandwich——a simplerArabidopsisprotoplast isolation method[J].Plant Methods,2009,5(1):16.
[23] CHAMANI E,TAHAMI S K,ZARE N,etal.Effect of different cellulase and pectinase enzyme treatments on protoplast isolation and viability inLiliumledebeouriiBioss.[J].NotulaeBotanicaeHortiAgrobotaniciCluj-Napoca,2012,40(2):123-128.
[24] LI Y(李 云).Advances in studies of triploid poplar breeding[J].ChineseBulletinofBotany(植物学通报),2001,18(4):451-458(in Chinese).
