遮荫对‘保佳红’桃树叶片快速叶绿素荧光诱导动力学曲线的影响
2015-07-05郝建博曹洪波陈海江
贾 浩,郝建博,曹洪波,韩 艳,李 丹,陈海江
(河北农业大学 园艺学院,河北保定071000)
叶绿素荧光技术是在无损情况下研究叶片光合机构的有效工具,已广泛应用于植物逆境生理研究。快速叶绿素荧光技术可记录下1s内植物荧光的瞬间变化,并呈现出OJIP曲线形式。Strasser等[1]通过对生物膜能量流动原理[2]的研究,建立了针对快速叶绿素荧光诱导曲线的数据分析和处理方法——JIP-测定(JIP-test),这使得在光系统Ⅱ(PSⅡ)供体侧和受体侧电子传递方面的研究变得更为便捷。目前,关 于 植 物 在 高 温[3-5]、低 温[6]、干 旱[7]、盐 胁迫[8-9]、缺素[10]和重金属污染[11]等逆境条件下快速叶绿素荧光诱导动力学特征的研究已有相关报道,并且发现在不同的环境条件下,OJIP曲线呈现出不同的变化特点。
桃[Prunus persica(L.)Batsch]属蔷薇科落叶乔木果树,原产于海拔高、日照长的地区,形成了喜光的特性,对光照不足极为敏感。但喜光的桃树在应对不同的光照条件时叶绿素荧光曲线的特征仍未有报道。当光强发生变化时,叶绿素荧光的变化可以在一定程度上反映光强对植物的影响,通过对不同光强下快速叶绿素荧光诱导动力学曲线的分析,可深入了解光照强弱对植物光合机构主要是PSⅡ的影响以及光合机构对环境的适应机制。因此,本试验以喜光植物桃树为研究对象,探讨桃树在遮荫形成的不同光照环境下的叶绿素荧光曲线及其参数的变化特征和响应机制,旨在依据桃树的喜光特性制定适宜的修剪管理技术提供理论依据。
1 材料和方法
1.1 试材与处理
试验于2014年在河北省保定市顺平县南台鱼村与满城县坨南村交界地带的桃园中进行,试材为3年生‘保佳红’桃品种,株行距2m×5 m,树形为Y 字形。植株生长正常,常规管理。选择生长势一致的桃树45棵,分别在桃树生长Ⅰ期(展叶后30~60d)、Ⅱ期(展叶后60~90d)、Ⅲ期(展叶后90~120d)搭棚架,每个时期用透光率分别为80%、60%、40%、20%(用T1、T2、T3、T4表示)的遮阳网进行遮阴处理,以各时期自然光下的桃树作对照(CK)。各处理桃树间留2株做保护株,单株小区,3次重复。
1.2 测定方法
1.2.1 快速叶绿素荧光诱导动力学曲线的测定 在各时期各遮阴处理20d后,利用Pocket PEA 植物效率仪(Hansatech,HK),选择晴朗无风天气,每个处理选取3棵树,每棵树选取3个新梢顶端起第5片完全展开叶为测定对象,在上午10:00 左右测定叶片快速叶绿素荧光诱导动力学曲线。将获得的OJIP荧光诱导曲线进行JIP-test分析,可得到以下荧光参数:最大光化学效率(Fv/Fm或φPo);捕获的激子将电子传递到电子传递链中超过QA的其它电子受体的概率(ψo);反应中心吸收的光能用于电子传递的量子产额(φEo);用于热耗散的量子比率(φDo);单位反应中心吸收的光能(ABS/RC);单位反应中心捕获的用于还原QA的能量(TRo/RC);单位反应中心捕获的用于电子传递的能量(ETo/RC);单位反应中心耗散掉的能量(DIo/RC)。测定前先将叶片在黑暗中充分适应15min,然后测定。
1.2.2 荧光参数Fv/Fm日变化的测定 在测定快速叶绿素荧光诱导动力学曲线的当天,采用同样方法于6:00~18:00每隔2h测定PSⅡ最大光化学效率Fv/Fm的日变化。
1.3 数据处理
采用Excel 2003 进行数据处理及绘图,并用DPS 7.05版软件Duncans新复极差法作差异显著性比较。
2 结果与分析
2.1 遮荫对桃树叶片快速叶绿素荧光诱导动力学曲线的影响
植物快速叶绿素荧光诱导动力学曲线(OJIP)可以反映出大量关于PSⅡ反应中心原初光化学反应的信息。由图1,A~C 可以看出,各时期各处理的OJIP曲线在O 点差异不大。在J点处(2 ms),Ⅰ期T4处理的荧光值高于该时期其他处理的荧光值,而该时期其他处理的荧光值差异不大;Ⅱ期T3、T4处理的荧光值差异不大,但都高于T1、T2处理,而CK 的荧光值最低;Ⅲ期T4处理的荧光值偏高于T3处理,并且都高于CK、T1、T2处理,而后三者间差异不大。在1点处(30ms),Ⅰ期T4处理的荧光值明显高于T1~T3处理,而CK 的荧光值明显低于其他处理;Ⅱ期除T2和T3处理差异不大外,其他处理间差异较大,荧光值大小表现为:T4>T3、T2>T1>CK;Ⅲ期除T1和T2处理差异不大外,其他处理间差异较大,荧光值大小表现为:T4>T3>T2、T1>CK。在最大荧光P 点处,Ⅰ、Ⅱ、Ⅲ期的荧光值变化规律一致,均随着遮阴程度的增加(CK>T1>T2>T3>T4)而依次升高。总体观察分析可知,各遮阴处理桃树叶片的OJIP曲线从O 点变化差异不大,经过J、I点差异的积累,到达P点时,差异逐渐增大;Ⅰ、Ⅱ、Ⅲ期的OJIP曲线变化规律大体相同。

图1 各时期遮荫条件桃树叶片快速叶绿素荧光诱导动力学曲线的变化A.Ⅰ期,展叶后30~60d;B.Ⅱ期,展叶后60~90d;C.Ⅲ期,展叶后90~120d;CK、T1、T2、T3、T4 分别为100%、80%、60%、40%、20%的自然光照处理;下同Fig.1 Effects of shading on fast chlorophyll fluorescence induction dynamics of peach leaves at different period A.First period,30-60days after leaves unfolding;B.Second period,60-90days after leaves unfolding;C.Third period,90-120days after leaves unfolding;CK,T1,T2,T3,T4indicate 100%,80%,60%,40%and 20%of full sunlight;The same as below.
2.2 遮阴对桃树叶片能量分配比率的影响
φPo反映了吸收的光能被反应中心捕获的量子产额,其实际上意义与Fv/Fm相同。由图2,A 可知,Ⅰ、Ⅱ、Ⅲ期的φPo均随遮阴程度的加深而呈现先上升后下降的变化规律,并在T3处理最高,比同期CK 分别显著升高了10.2%、8.3%、4.0%;T4处理各时期的φPo比同期T3处理有所降低,但差异不显著。由此说明,随着遮阴程度的增加,叶片吸收的光能被反应中心捕获的概率逐渐提高。
ψo反映了激子被反应中心捕获后,用于推动电子传递到电子传递链中超过QA的其他电子受体的激子占用于推动QA还原激子的比率。由图2,B可知,ψo 在Ⅰ期从CK 到T4处理而依次升高,并与CK 的差异均达显著水平;ψo 在Ⅱ、Ⅲ期从CK 到T3处理逐渐升高,到T4处理开始下降,且显著低于同期T3处理。由此说明,随着遮阴程度的增加,电子传递到电子传递链中QA-下游的电子受体的概率逐渐提高,但该概率在相对光强降低到20%时反而有所下降。
φEo反映了反应中心吸收的光能用于电子传递的量子产额。由图2,C 可知,随着遮阴程度的加强,φEo在Ⅰ期逐渐升高,并与CK 的差异均达显著水平,而在Ⅱ、Ⅲ期表现出先升高后下降的趋势。其中,φEo在Ⅱ期以T3处理最高,并与T1、T2处理的差异不显著,而与CK、T4处理的差异显著;在Ⅲ期则以T2处理最高,除与T3处理的差异不显著外,均显著高于其他处理。由此说明,当光强降低较少时,反应中心吸收的光能将电子传递到电子传递链中超过QA的其他电子受体的概率逐渐升高,而当光强降低较多时,φEo会有所降低。
φDo反映了用于热耗散的量子比率。图2,D 显示,φDo在Ⅰ、Ⅱ、Ⅲ期均随遮阴程度的增强而呈依次下降的变化规律;虽然T4处理的φDo比T3处理的有所升高,但同时期两处理间差异不显著。可见,在遮阴条件下,桃树叶片吸收的光能用于热耗散的比率减少。
2.3 遮阴对桃树叶片PSⅡ反应中心活性参数影响
通过快速叶绿素荧光诱导动力学曲线OJIP可以分析出PSⅡ反应中心的活性,具体体现于4个活性参数:单位有活性反应中心吸收的光能ABS/RC、捕获的光能TRo/RC、用于电子传递的能量ETo/RC 和热耗散的光能DIo/RC。
首先,ABS/RC 在Ⅰ、Ⅱ、Ⅲ期的CK、T1、T2、T3处理下,随着遮阴程度的增加而依次降低;除了Ⅲ期的T1和T2处理间差异不显著外,同时期的其他处理间差异均达到显著性水平。T4处理的ABS/RC 在Ⅰ期虽然显著低于CK,但却显著高于同时期的T3处理;其在Ⅱ期也高于同时期的T3处理,但其差异不显著;在Ⅲ期与T3处理相近(图3,A)。
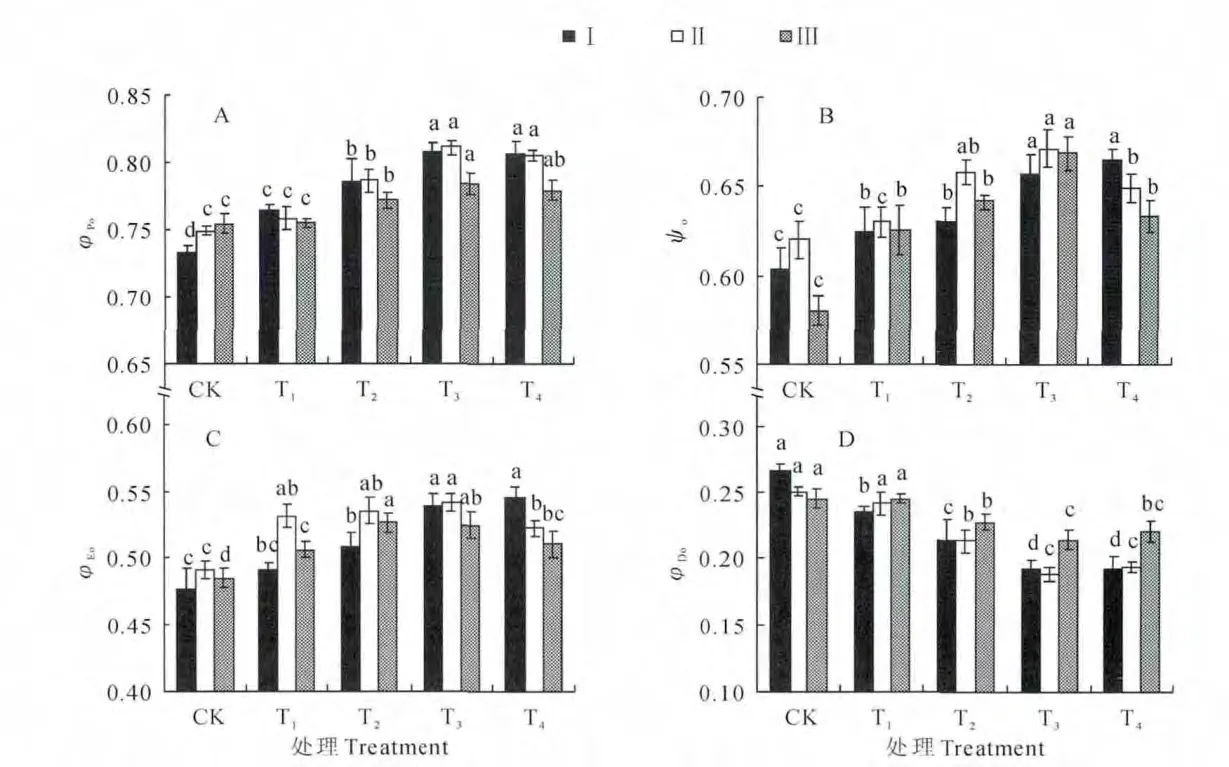
图2 遮荫条件下桃树叶片φPo、ψo、φEo和φDo的变化同时期不同字母表示不同遮阴处理之间在0.05 水平上有显著性差异;下同Fig.2 TheφPo,ψo,φEoandφDoof peach leaves under shading condition The different normal letters within the same period indicate significant difference among shading treatments at 0.05level;The same as below.

图3 遮荫条件下桃树叶片ABS/RC、TRo/RC、ETo/RC和DIo/RC的变化Fig.3 The ABS/RC,TRo/RC,ETo/RC and DIo/RC of peach leaves under shading condition
其次,随着遮阴程度的增加,TRo/RC 在Ⅰ、Ⅱ期呈现先降低后升高的变化趋势,而在Ⅲ期表现出逐渐降低的趋势(图3,B)。其中,TRo/RC 在Ⅰ期的T3处理下最低,并显著低于其他处理,比同期CK 显著降低了11.0%;TRo/RC 在Ⅱ期的T2处理下最低,与同期T3处理无显著差异,而显著低于其他处理,比同期的CK 显著降低了10.5%;TRo/RC在Ⅲ期的T4处理下最低,与同期T3处理无显著差异,而显著低于其他处理,比同期的CK 显著降低了11.2%。
再次,Ⅰ、Ⅱ、Ⅲ期的ETo/RC 均随着遮阴程度的增加呈现逐渐降低的变化趋势(图3,C)。其中,Ⅰ期的ETo/RC 在T1、T2、T3、T4处理下分别比同期CK 显著降低了5.5%、7.2%、11.9%、17.7%;Ⅱ、Ⅲ期的ETo/RC 在T1处理下与CK 差异不显著,但T2、T3、T4处理下均显著低于CK。同时,各时期CK、T1、T2处理的DIo/RC 依次下降,且差异达显著性水平,其中T1、T2各时期的DIo/RC 平均值分别比CK 降低了13.8%、25.5%;各期T3、T4处理间的DIo/RC 均无显著差异,但它们在Ⅰ期显著低于T2处理,而在Ⅱ、Ⅲ期均与T2无显著差异(图3,D)。
通过以上分析可以看出,桃叶PSⅡ单位反应中心吸收的光能(ABS/RC)和捕获的光能(TRo/RC)在不同光强条件下均会随着遮阴程度的增加而逐渐降低,但当降低到20%相对光强时该能力会有所提升,以适应其遮阴环境;同时,PSⅡ单位反应中心用于电子传递的能量(ETo/RC)随着逐渐降低的光强而明显降低;PSⅡ单位反应中心用于热耗散的能量在遮阴条件下减少,而自然光或强光下相对增加。
2.4 遮阴对桃树叶片荧光参数Fv/Fm 日变化影响
叶绿素荧光参数Fv/Fm是指开放的PSⅡ反映中心捕获激发能的效率,即最大光化学效率。由图4可知,Ⅰ期各处理的Fv/Fm日变化均呈现先降低后升高的变化趋势,即Fv/Fm在6:00开始下降,在12:00降到一天中的最低值,而在18:00时又恢复到与6:00 大致相同的水平。各处理的Fv/Fm在10:00~14:00时下降幅度较大,且降幅的大小与光照的强弱呈现相同的变化规律,即“光强越高,降幅越大”,如CK、T1、T2、T3、T4的Fv/Fm在12:00分别比6:00 下 降 了12.5%、9.7%、7.9%、4.6%、4.2%。Ⅱ、Ⅲ期各处理的Fv/Fm日变化有与Ⅰ期相似的变化规律。所不同的是,Ⅱ、Ⅲ期各处理Fv/Fm在10:00和14:00的降幅比Ⅰ期各处理相应时间点的降幅要大;Ⅲ期各处理Fv/Fm在8:00 和16:00也有较大的降幅,同时也表现为“光强越高,降幅越大”。
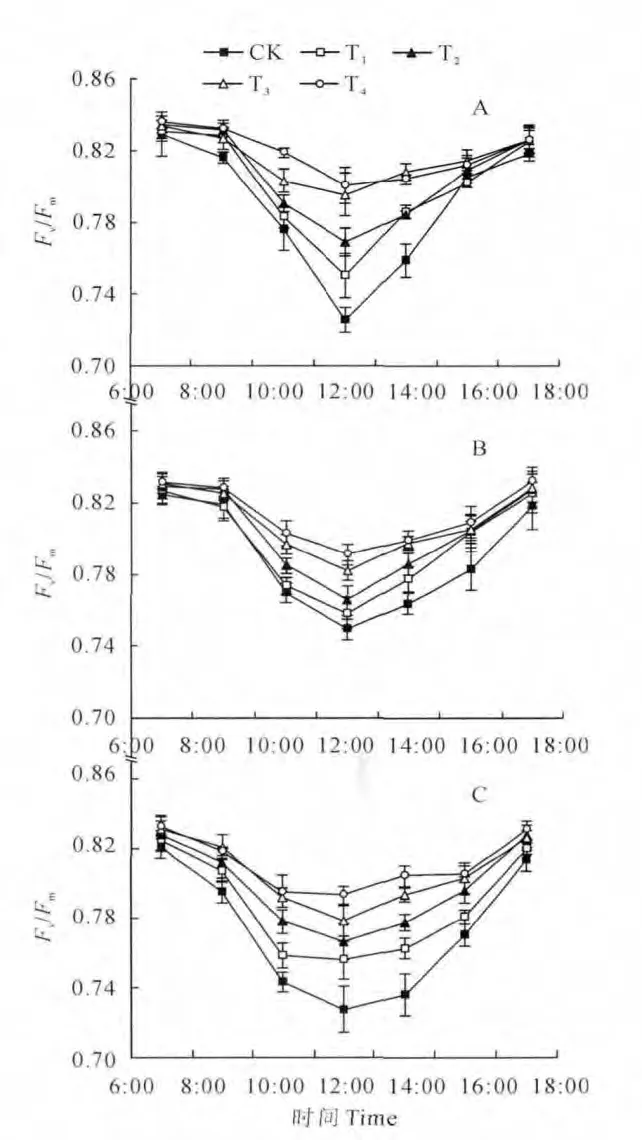
图4 各时期遮荫条件下桃树叶片最大光化学效率(Fv/Fm)日变化A.Ⅰ期,展叶后30~60d;B.Ⅱ期,展叶后60~90d;C.Ⅲ期,展叶后90~120dFig.4 The diurnal variations of the maximum photochemical efficiency(Fv/Fm)peach leaves under shading condition at different periods A.First period,30-60days after leaves unfolding;B.Second period,60-90days after leaves unfolding;C.Third period,90-120days after leaves unfolding
以上结果说明,Ⅲ期各处理Fv/Fm在一天中出现大幅下降的时间提前,恢复的时间推迟,即下降持续时间较长。同时,各时期各处理Fv/Fm的日变化曲线之所以呈“单谷”曲线型,是因为叶片吸收的光能在光强较弱的早晨和傍晚可最大限度地用于光化学反应,但随着光强的增加叶片把光能较多地分配到热耗散中。同理,中午时遮阴处理的Fv/Fm大于自然光或强光下的Fv/Fm,也是因为遮阴下的叶片尽可能的吸收光能进行光化学反应,而强光下的叶片虽然吸收的光能较多,但分配到光化学反应的能量比例减少。
3 讨 论
典型的快速叶绿素荧光动力学曲线在荧光上升阶段有O、J、I、P 相,对应光化学反应阶段,并对植物生长的光强要求特别敏感[12]。光强对叶绿素荧光曲线的改变主要反映的是对QA的影响[13-14]。曲线J点处的荧光强度升高,通常反映了PSⅡ反应中心受体侧QA-瞬时大量积累[15]。J-I阶段和I-P 阶段荧光强度的变化则与QB和PQ 库的还原情况有关[16]。本研究中Ⅰ、Ⅱ、Ⅲ期20%的相对遮阴使桃叶荧光动力学曲线J点荧光强度升高,说明电子在PSⅡ受体侧的传递受到阻碍;而各时期遮阴下的J-I阶段和I-P阶段的荧光强度随着光强减弱而依次升高,又说明遮阴使得桃叶PSⅡ的QB 和PQ 被还原的能力受到限制。
φPo、ψo、φEo和φDo是4 个与能量分配比率相关的荧光参数。本实验中遮阴下的φPo、ψo、φEo有所升高,而φDo有所下降,这说明桃叶在不同光强下调整了能量在PSⅡ反应中心的分配比率,即提高了用于电子传递的量子比率,降低了用于热耗散的的量子比率。这可能也是桃树叶片在遮阴下的一种适应性调节机制。ABS/RC、TRo/RC、ETo/RC 和DIo/RC 反映了在QA可还原的状态时,单位PSⅡ反应中心的活性。ABS/RC 可以作为衡量天线色素的大小的指标,当该值和TRo/RC 均减小时,说明天线色素尺寸减小[17]。本试验遮阴下ABS/RC 和TRo/RC 均下降说明桃叶片天线色素吸收和捕获的光能减少,从而导致用于电子传递的能量较少。同时,与自然光相比,遮阴下的叶片也减少了热耗散的能量损失。
Fv/Fm下降是植物受到光抑制的重要指标[18]。本试验的研究表明,Ⅰ、Ⅱ、Ⅲ期桃叶各处理的Fv/Fm在中午会出现不同程度的下降,且光照越强下降幅度越大。有研究发现,植物在强光下发生的光抑制可能与D1 蛋白的净损失和光合器官的损伤有关,也可能与PSⅡ对吸收的光能的分配有关[19]。植物在受到光胁迫时,会加剧D1蛋白的降解,导致电子传递体,特别是QB容易从蛋白复合体上脱落下来,造成受体库的减少[20]。同时,一些PSⅡ反应中心失去活性可以耗散掉多余的能量,从而使其他PSⅡ反应中心免受到光损害[21-22]。这些损害光合机构功能的行为都会降低光能转化效率,最终限制光合作用的正常进行。
综上可知,20%的相对遮阴会在一定程度上降低桃树叶片电子在PSⅡ受体侧的传递能力,而不同程度地遮阴会限制PSⅡ的QB和PQ 被还原的能力;遮阴下生长的桃叶由于天线色素含量的减少,导致所吸收的、捕获的光能和电子传递的能量都随之减少;但是植物为适应遮阴环境,通过提高电子传递的量子比率和降低热耗散的量子比率的方式调整能量分配,以充分实现对光能的利用。桃树叶片各时期中午时段的强光会引起光抑制现象的发生,从而影响了其光合作用的顺利进行。
[1] STRASSER R J,STRASSER B J.Measuring Fast Fluorescence Transients to Address Environmental Questions:the JIP Test.[C]//:MATHIS P.Photosynthesis:from Light to Biosphere.Dordrecht:KAP Press,1995,5:977-980.
[2] STRASSER R J.The grouping Model of Plant Photosynthesis:heterogeneity of Photosynthetic Units in Thylakoids[M]//AKOYUNOGLOU G.PhotosynthesisⅡ.Structure and Molecular Organization of the Photosynthetic Apparatus.Philadelphia:BISS Press,1981:727-737.
[3] LIU CH Y(刘春英),CHEN D Y(陈大印),GAI SH P(盖树鹏),et al.Effects of high-and low temperature stress on the leaf PSⅡfunctions and physiological charac-teristics of tree peony[J].Chinese Journal of Applied Ecology(应用生态学报),2012,23(1):133-139(in Chinese).
[4] SU X Q(苏晓琼),WANG M Y(王美月),SHU SH(束 胜),et al.Effects of exogenous Spd on the fast chlorophyll fluorescence induction dynamics in tomato seedlings under high temperature stress[J].Acta Horticulturae Sinica(园艺学报),2013,40(12):2 409-2 418(in Chinese).
[5] ZHANG M(张 谧),WANG H J(王慧娟),YU CH Q(于长青).The examination of high temperature stress of Ammopiptanthus mon-golicusby chlorophyll fluorescence induction parametersJ.Ecology and Environmental Sciences生态环境学报20091862 272-2 277(in Chinese).
[6] SUN Y P(孙永平),ZHANG ZH P(张治平),XU CH X(徐呈祥),et al.Effect of ALA on fast chlorophyll fluorescence induction dynamics of watermelon leaves under chilling stress[J].Acta Horticulturae Sinica(园艺学报),2009,36(5):671-678(in Chinese).
[7] OUKARROUMA A,MADIDI S,SCHANSKER G,et al.Probing the responses of barley cultivars(Hordeum vulgare L.)by chlorophyll a fluorescence OLKJIP under drought stress and rewatering[J].Environmental and Experimental Botany,2007,60:438-446.
[8] YAO G(姚 广),WANG X(王 鑫),GAO H Y(高辉远).Effects of salt-stress on photosystem activity in leaves of Festuca arundinacea[J].Chinese Journal of Grassland(中国草地学报),2009,31(2):46-52(in Chinese).
[9] LI X X(李旭新),LIU B X(刘炳响),GUO ZH T(郭智涛),et al.Effects of NaCl stress on photosynthesis characteristics and fast chlorophyll fluorescence in-duction dynamics of Pistacia chinensis leaves[J].Chinese Journal of Applied Ecology(应用生 态 学 报).2013,24(9):2 479-2 484(in Chinese).
[10] LIN ZH H(林郑和),ZHONG Q SH(钟秋生),CHEN CH S(陈常颂),et al.Effect of potassium deficiency on chlorophyll fluorescence in leaves of tea seedlings[J].Plant Nutrition and Fertilizer Science(植物营养与肥料学报).2012,18(4):974-980(in Chinese).
[11] XIA J R,TIAN Q R.Early stage toxicity of excess copper to photosystem Ⅱof Chlorella pyrenoidosa-OJIP chlorophyll a fluorescence analysis[J].Journal of Environmental Sciences,2009,21:1 569-1 574.
[12] STRASSER R J,STRYVASTAVA A,GOVINDGEE.Polyphasic chlorophyll a fluorescence transient in plants and cyanobacteria[J].Photochemistry and Photobiology,1995,61:32-42.
[13] SAMSON G,PRASIL O,YAAKOUBD B.Photochemical and thermal phases of chlorophyll a fluorescence[J].Photosynthetica,1999,37:163-182.
[14] LAZAR D.The polyphonic chlorophylls a fluorescence rise measured under high intensity of exciting light[J].Functional Plant Biology,2006,33:9-30.
[15] STRASSER R J,SRIVASTAVA A,TSIMILLI-MICHAEL M.The Fluorescence Transient as a Tool to Characterize and Screen Photosynthetic Samples[M]//YUNUS M,PATHRE U,MOHANTY P.Probing Photosynthesis:Mechanism,Regulation and Adaptation.London:Taylor and Francis Press,2000:445-483.
[16] LI P M(李鹏民),GAO H Y(高辉远),STRASSER R J.Application of the fast chlorophyll fluorescence induction dynamics analysis in photosynthesis study[J].Journal of Plant Physiology and Molecular Biology(植物生理与分子生物学学报),2005,31(6):559-566(in Chinese).
[17] BRESTIC M,ZIVCAK M,KALAJI H M,et al.Photosystem Ⅱthermostability in situ:environmentally induced acclimation and genotype-specific reactions in Triticum aestivum L.[J].Plant Physiology and Biochemistry,2012,57:93-105.
[18] WANG B L(汪炳良),XU M(徐 敏),SHI Q H(史庆华),et al.Effect of temperature stress on antioxidant systems chlorophyll and chlorophyll fluorescence parameters in early cauliflower leaves[J].Sceientia Agriultura Sinicea(中国农业科学),2004,37(8):1 245-1 250(in Chinese).
[19] SONG T(宋 婷),ZHANG M(张 谧),GAO J X(高吉喜),et al.Fast chlorophyll fluorescence kinetics and its application in plant physiology research[J].Journal of Biology(生物学杂志),2011,28(6):81-86(in Chinese)
[20] JIANG C D,JIANG G M,WANG X Z,et al.Increased photosynthetic activities and thermostability of photosystem Ⅱwith leaf development of elm seedlings(Ulmus pumila)probed by the fast fluorescence rise OJIP[J].Environmental and Experimental Botany,2006,58:261-268.
[21] CAI S Q,XU D Q.Light intensity-dependent reversible down regulation and irreversible damage of PSⅡin soybean leaves[J].Plant Science,2002,163:847-853.
[22] STRASSER R J,STRIVASTAVA A,GOVINDGEE.Polyphasic chlorophyll a fluorescence transients[J].Photosynthesis Research,1997,52:147-155.
