辽河原油好氧生物降解模拟过程中化学组成及其碳同位素值的变化
2015-07-02潘银华廖玉宏彭先芝
潘银华, 廖玉宏, 彭先芝
(1. 中国科学院 广州地球化学研究所 有机地球化学国家重点实验室, 广东 广州 510640; 2. 中国科学院大学, 北京 100049)
0 引 言
原油的生物降解作用是一种发生在油藏中的重要的次生蚀变作用, 能够改变原油的诸多物理和化学性质, 是原油稠化的主要机制之一[1–2]。世界上绝大多数原油都遭受了不同程度的生物降解, 包括地表和近地表微生物对烃类的降解[3–4]。生物降解有机化合物的难易程度首先取决于微生物本身的特性,同时也与有机物的结构特征有关。一般地, 结构简单的有机物先降解, 结构复杂的有机物后降解, 如正构烷烃优先于异构烷烃被降解消耗, 而异构烷烃又优先于环烷烃被降解; 并且在同一类化合物中, 低分子量化合物往往优先于高分子量化合物被消耗[5–7]。
目前对原油中的烃类化合物的生物降解机理的研究已经比较多[7–12]。室内模拟实验被广泛应用于研究原油的生物降解过程和降解机理[13–18]。一般地,油藏中发生的主要是厌氧降解[2,11], 而 da-Cruz et al.[18]认为油藏中原油的生物降解更可能是好氧菌和厌氧菌共同作用的结果, 因此原油的好氧降解模拟实验在一定程度上能够还原油藏中原油的生物降解过程。生物降解作用对原油单体化合物的稳定碳同位素组成的影响在近十几年来都有报道[19–22]。Sun et al.[22]认为在轻度至中度生物降解时正构烷烃没有发生明显的碳同位素分馏; 但在严重生物降解时, 较低分子量的正构烷烃(C15~C18)的δ13C值有明显的变重(~4‰), 而较高分子量的正构烷烃(C≥18)没有发生明显的碳同位素分馏。一些原油的生物降解模拟实验同样论证了正构烷烃的稳定碳同位素组成在生物降解过程中并没有明显的变化[19,21,23]。因此, 通过生物降解模拟实验来研究原油的化学组成和稳定碳同位素组成的变化规律, 能够为揭示原油的生物降解过程和机理提供证据, 对于深刻认识有关油气地球化学、石油的开采与加工以及石油类污染的修复等诸多方面的问题都具有十分重要的意义。本研究通过室内模拟实验模拟辽河原油在好氧条件下的生物降解过程, 探讨辽河原油在生物降解过程中化学组成和稳定碳同位素值的变化, 试图揭示原油尤其是正构烷烃的生物降解途径和机理, 为开展油气生产和理论研究等相关工作提供更多的依据。
1 样品与实验
1.1 原油样品和菌种来源
原油样品取自辽河盆地中央凸起南部潜山赵古1井(深度3164~3191 m), 为未遭受生物降解的原油,含蜡量较高, 饱和烃组分含量约78.5%。菌种来自内蒙古扎赉特旗的油浸土壤, 以原油为唯一碳源, 经富集和选择性培养获得原油降解菌。降解菌经划平板分离获得 3株纯菌种, 初步鉴定分别为施氏假单胞菌(Pseudomonas stutzeri), 蜡状芽孢杆菌(Bacillus cereus)和伯克霍尔德氏菌属(Burkholderia sp., 种未明)。菌种富集和选择性培养所使用的培养基分别如下:
(1) 富集培养基 蛋白胨10 g, 牛肉膏10 g,NaCl 5 g, 无菌水1 L, pH 7.0;
(2) 无机盐培养基 K2HPO4·3H2O 1.0 g,KH2PO41.0 g, MgSO4·7H2O 0.5 g, NH4NO31.0 g,CaCl20.02 g, FeCl3痕量, 无菌水 1 L, pH 7.0~7.2。所用试剂均为分析纯。
1.2 生物降解模拟实验
降解原油所用的培养基与选择性培养基一致。每100 mL实验培养基中加入未降解原油1.0 g, 菌液2 mL(吸光度OD600nm= 2.2), 放置入恒温摇床内恒温(30 ℃)培养, 转速 180 转/min。降解模拟时间共 8周, 每隔一周取样一次, 取出后加入适量二氯甲烷进行灭菌处理以及有机相(原油)的萃取。萃取获得的降解油旋转蒸发后收集, 并取部分油样沉淀沥青质, 之后使用氧化铝-硅胶层析柱分离成饱和烃、芳烃和胶质组分。其中, 饱和烃组分用于GC-MS和GC-FID分析, 所有族组分均进行稳定碳同位素分析。
1.3 GC-MS、GC-FID和GC-IRMS分析
饱和烃的 GC-MS分析采用 Thermo Scientific Trace GC Ultra气相色谱与DSQ II质谱联用系统。色谱条件: 色谱柱为 HP-1型毛细管色谱柱(30 m×0.25 mm×0.25 μm); 升温程序为初始温度 40 ℃, 恒温2 min, 以4 ℃/min升至290 ℃并恒温20 min; 载气为氦气, 流量 1.2 mL/min。质谱条件: 电子轰击(EI)离子源(70 eV); 离子源温度260 ℃, 传输线温度280 ℃; 质量扫描范围m/z 50~650, 扫描周期80 ms。
饱和烃组分中的化合物定量使用C15D32作为内标物, 所用仪器为Thermo Scientific Trace GC Ultra气相色谱。色谱柱为HP-1型毛细管色谱柱(60 m ×0.32 mm × 0.25 μm)。柱温箱升温程序与 GC-MS 分析一致。载气为氮气, 流量1.0 mL/min; FID检测器温度295 ℃。
饱和烃组分首先进行尿素络合以分离出正构烷烃, 正构烷烃单体碳同位素值测定采用 Isoprime GC-IRMS型气相色谱-同位素比值质谱仪, 色谱柱采用 DB-1(60 m × 0.32 mm × 0.25 μm); 升温程序为初始温度70 ℃ , 恒温2 min, 以4 ℃/min升至290 ℃并恒温20 min。GC-IRMS测定的正构烷烃单体碳同位素值误差范围为±0.3‰。
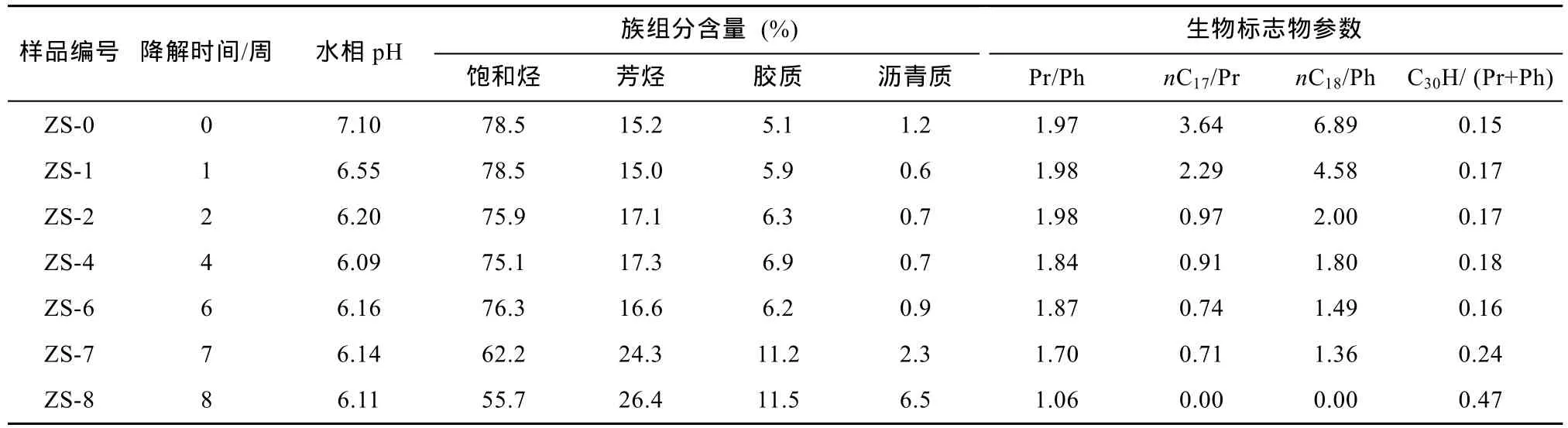
表1 降解油样的族组分含量及部分生物标志物参数Table 1 The contents of group fractions and some biomarker parameters
1.4 族组分的稳定碳同位素分析
使用Flash 2000型有机元素分析仪(EA)对原油各族组分的稳定碳同位素值进行分析。通过EA-IRMS连线分析技术测定碳同位素。用氦气作为载气, 燃烧瞬间通入 99.99%的纯氧气, 样品通过高温燃烧完全反应(氧化管本底温度950 ℃, 燃烧瞬间可达 1800 ℃以上), 转变为 CO2, 分流后(分流比为90)进入质谱仪测定。IRMS为 Thermo Scientific Delta V Advantage型同位素比值质谱仪。所测样品的δ13C值误差绝对值小于0.3‰, 稳定碳同位素值相对于V-PDB标准。每个样品至少测试两次, 误差范围内取两次分析结果的平均值。
2 结果和讨论
2.1 原油化学组分的变化
原油的最长降解时间为 8周, 根据降解时间尺度选取了不同降解程度的降解油样。表1展示了降解油样族组分的含量及部分生物标志物参数。通过对比各族组分在生物降解过程中的相对含量可以发现, 饱和烃组分消耗的速率最快, 导致饱和烃组分的含量逐步下降, 饱和烃组分的相对含量由降解前的78.5%降至第8周(ZS-8)时的55.7%; 而其他族组分的含量则相对增加, 其中芳烃由降解前的 15.2%升至第8周时的26.4%, 胶质由降解前的5.1%升至第8周时的11.5%, 沥青质由降解前的1.2%升至第8周时的6.5%。
细菌在生长代谢过程中利用原油烃类化合物作为电子供体时, 对饱和烃组分中化合物的分子结构亦有选择性, 表现为优先降解直链结构的正烷烃,随后是支链结构的烷烃(如姥鲛烷和植烷), 最后才是复杂环状结构的环烷烃(如甾烷和萜烷)。如图 1所示, 饱和烃组分中正构烷烃系列的相对丰度在第1周后(ZS-1)明显地下降, 在第 4周(ZS-4)和第 6周(ZS-6)时C17和C18正构烷烃分别与姥鲛烷和植烷含量相当(nC17/Pr和nC18/Ph比值分别为0.91和1.49),至第 8周(ZS-8)较低碳数的正构烷烃(C≤18)基本被消耗, 仅较高碳数的正构烷烃(C>18)得以部分保留,而支链烷烃如姥鲛烷和植烷也部分保留。姥鲛烷和植烷的比值(Pr/Ph)在第 7周前变化较小, 而在第 8周时由1.98降至1.06, 除此之外, 由于C30藿烷较姥鲛烷和植烷更抗生物降解, 在第 8周时它们的比值C30H/(Pr+Ph)比值由降解前的0.15增至0.47, 充分说明了姥鲛烷和植烷也遭受了生物降解作用, 并且姥鲛烷较植烷更易降解。这与包建平等[15]和向廷生等[16]对原油进行生物降解模拟实验所得出的结论一致,即在生物降解的早期阶段, Pr/Ph几乎不受生物降解作用的影响; 但随着正构烷烃接近消耗完毕, 细菌便开始降解相对浓度高得多的Pr和Ph。
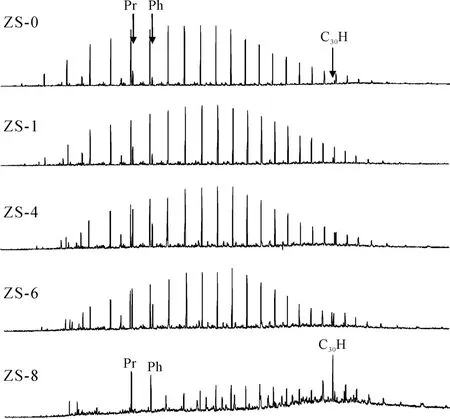
图1 降解油的饱和烃组分的GC-MS谱图(总离子流图)Fig.1 Total ion chromatograms of saturated hydrocarbon fractions in the biodegraded oil samples
对降解油中正构烷烃系列化合物的定量分析结果显示, 随着生物降解程度的增加, 不同碳数的正构烷烃的浓度均逐渐下降(图2), 总浓度由降解前的276.4 mg/g (ZS-0)最后降至15.0 mg/g (ZS-8), 降解率达94.6%。从图2中可以看出, 在降解第1周(ZS-1)和第2周(ZS-2)时C < 23的低碳数部分正构烷烃大幅度被降解, 随后降解速率有所减缓; C ≥ 23的高碳数部分正构烷烃在第 2周后才开始快速降解; 在第 8周时, 低碳数部分几乎被消耗殆尽, 仅残余少量高碳数部分正构烷烃。这说明细菌对不同碳数的正构烷烃亦有选择性, 总体表现为优先降解低碳数部分, 但当低碳数部分的相对浓度低于高碳数部分时, 便开始快速降解高碳数部分。从第 7周至第 8周正构烷烃的整体大幅度降解, 可能与某一高效利用正构烷烃的菌种的生物量急剧上升有关, 这种竞争现象尤其在细菌生长后期更为明显。由于混合菌中不同降解菌对烃类化合物具有不同的降解特性[24–26],并且混合菌对培养基中营养物质的相互竞争会造成营养短缺, 其新陈代谢和生长的速度减缓, 影响微生物对原油的降解[27–28]。因此, 当环境中高浓度的正构烷烃顺应某一高效利用正构烷烃的菌种的竞争优势时, 其生物量会迅速上升, 从而加快对正构烷烃的降解。
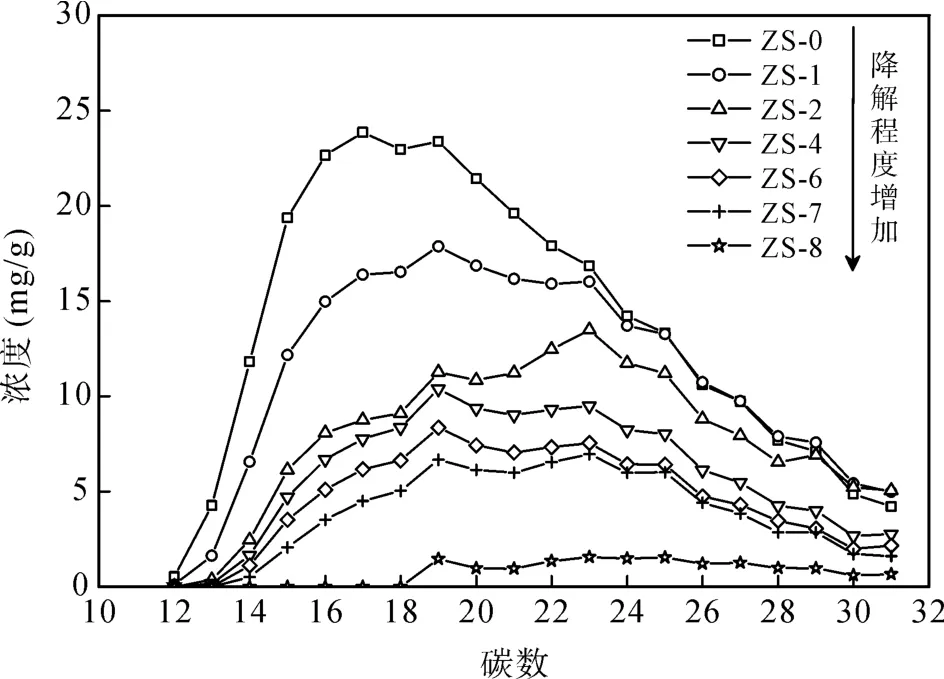
图2 降解油中不同碳数正构烷烃的浓度变化Fig.2 Variation in concentrations of the n-alkanes with different carbon numbers in the biodegraded oil samples
图 3亦展示了随生物降解程度的加剧, 不同碳数的正构烷烃在原油中的残余量, 可以看出, 不同碳数的正构烷烃的降解速率是随碳数而异的。C12正构烷烃的消耗最快, 在第 1周(ZS-1)时仅残留约20%, 而在第2周(ZS-2)时已完全被降解消耗; 随着碳数的增加, C12~C23正构烷烃的降解速率逐渐下降,即正构烷烃的抗降解性随碳数依次增强(图 3a)。而C24~C31正构烷烃的降解速率则十分接近(图3b); C31正构烷烃降解最慢, 在第 2周后才开始被降解, 至第8周时残余量也最多。这说明细菌优先利用较低碳数正构烷烃可能与各正构烷烃单体的相对浓度和链的长短有关。对于正构烷烃的好氧生物降解过程, 一般认为主要是末端氧化和次末端氧化, 其降解产物主要是羧酸和醇, 其中醇又可以继续氧化成酸[29–33]; 脂肪酸继而通过β位氧化导致碳链不断缩短[34–37], 而不断减少的二碳单元(乙酰辅酶a)最终氧化成为CO2。
实际油藏中, 大多数原油是圈闭在具有渗透性的沉积岩(如砂岩和灰岩)构成的储层中, 在具有连续流体相的油柱中, 约 80%的孔隙是由不同盐度的水填充的; 油水界面提供了微生物活动的有利环境,油柱不断带来的烃类化合物提供了大量的电子供体,而溶解于水的无机盐则为微生物生长提供了所需的营养盐[1]。因此油水界面既是适宜微生物生长活动的场所, 也是原油遭受生物降解的主要场所。另外,细菌是生长在水相中而不是油相中, 它们是通过产生表面活性剂而使得自身更容易接近和利用疏水的烃类化合物[7]。Erstad et al.[38]认为在油水界面上的表面张力是影响酸类化合物形成的主要因素之一,即正构烷烃的疏水性随分子大小而不同, 低碳数的正构烷烃由于其在油水界面上的表面张力较小而被细菌产生的表面活性剂优先捕获并被细菌利用。在这个过程中, 烃类化合物被降解成相应的脂肪酸,更便于被细菌所利用, 从而导致低碳数正构烷烃比高碳数正构烷烃消耗更快。
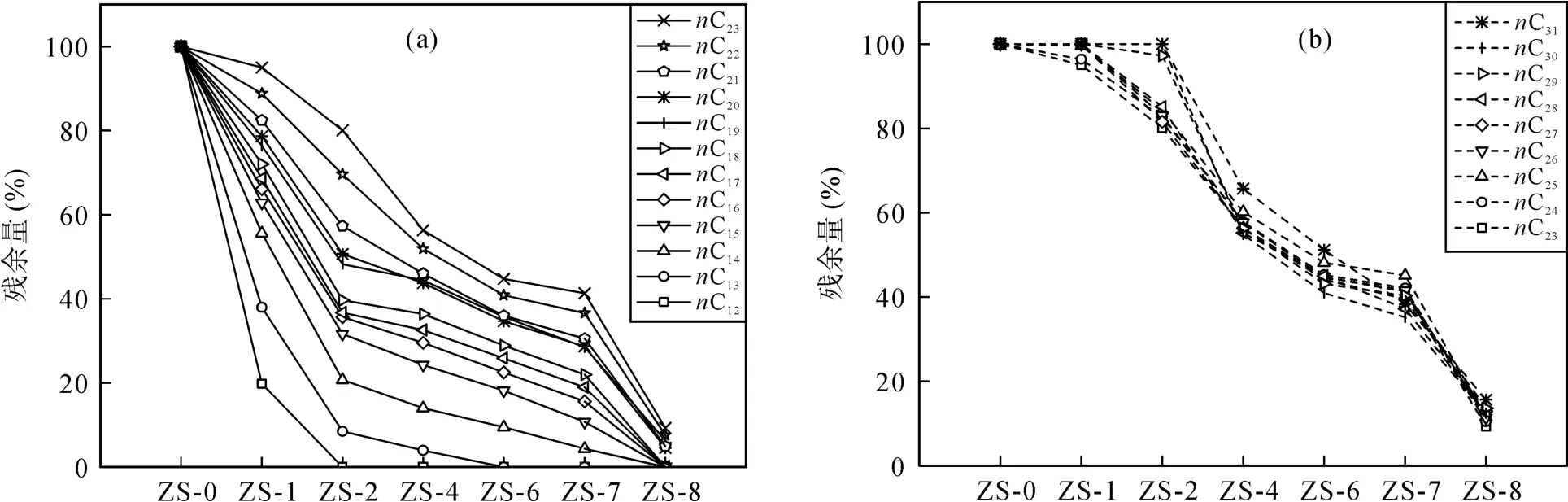
图3 不同生物降解程度的降解油中正构烷烃的残余量Fig.3 Residual percentage of individual n-alkanes in various biodegraded oil samples relative to those in the initial oil sample

图4 降解油中正构烷烃单体的稳定碳同位素组成Fig.4 The δ13C values of individual n-alkanes in the biodegraded oil samples
表 1展示了随生物降解程度的增加, 培养基水相的 pH值逐渐下降, 这种变化主要是由细菌代谢活动产生的表面活性剂和代谢产物饱和脂肪酸引起的。已有的研究[10,12,38–39]表明无论是在好氧条件还是厌氧条件下, 原油中酸性化合物的含量都会随着生物降解程度的增加而增加, 尤其是羧酸类化合物。与原油中原始的含氧化合物(以酚类为主)所不同的是, 这些新形成的含氧化合物以羧酸类化合物为主, 它们被认为是生物降解的产物。在轻度–中度生物降解阶段, 这些羧酸类化合物与烃类化合物的降解消耗有着直接的联系。Liao et al.[40]的ESI FT-ICR MS研究结果也显示, 在轻度–中度生物降解阶段, 胶质和沥青质组分中的酸性组分主要为饱和脂肪酸。
2.2 生物降解过程中原油δ13C值的变化
由生物降解作用所引起的同位素分馏效应一直吸引着地球化学家的兴趣。本研究对降解油进行了正构烷烃单体碳同位素分析。图4展示了随生物降解程度的增加, C14~C30正构烷烃的稳定碳同位素值的分布情况。C14~C17正构烷烃的 δ13C值在–23.5‰~–24.5‰之间, C18~C30正构烷烃的 δ13C 值在–25.0‰~–26.0‰之间; 随着生物降解程度的增加, 正构烷烃的δ13C值变化基本在仪器的测量误差范围内, 缺乏明显的变化规律, 这与彭先芝等[23]在对正构烷烃标样进行好氧生物降解模拟实验中所获得的结果是一致的。Mazeas et al.[21]的好氧生物降解模拟实验结果也显示饱和烃与多环芳烃的稳定碳同位素组成在生物降解过程中是稳定的。因此, 烃类化合物在好氧生物降解过程中不存在碳同位素分馏效应。
原油中的烃类化合物尤其是正构烷烃系列的生物降解作用不会发生明显的碳同位素分馏, 因而烃类化合物的碳同位素组成可用于示踪降解产物以及分析降解途径等, 例如可用于环境中石油类污染物的来源识别以及环境修复评价等[22–23]。图5展示了本研究中轻度–中度生物降解程度下的原油及其族组分的碳同位素值的变化。未降解原油(ZS-0)的饱和烃和芳烃组分具有相似的较重的 δ13C 值(–26.2‰),而胶质和沥青质组分的δ13C值较轻, 分别为–26.8‰和–27.3‰。由于未降解原油中饱和烃组分的含量最高(78.5%), 因此全油的δ13C值(–26.3‰)接近于饱和烃组分的δ13C值。与全油及其饱和烃组分相比, 正构烷烃的 δ13C 值较重(–24.0‰~ –26.0‰), 随着生物降解程度的增加, 正构烷烃逐渐被消耗, 造成饱和烃组分的δ13C值逐渐变轻(最终变为–27.5‰, ZS-8),且全油的 δ13C 值也相应变轻(最终变为–27.0‰,ZS-8); 由于芳烃的相对含量在整个降解过程中变化很小, 因而芳烃组分的δ13C值基本无变化。值得注意的是, 胶质和沥青质组分的δ13C值则是逐渐变重的, 与饱和烃的逐渐变轻的趋势恰好相反, 这种原油各组分δ13C值的相反变化趋势不仅在以往的模拟实验中被发现过[8], 在对油藏的生物降解油的研究中也有报道[22,41]。如Sun et al.[22]发现随着生物降解程度的增加, 辽河盆地茨榆坨油田原油的胶质和沥青质组分的δ13C值逐渐变重, 而饱和烃组分的δ13C值逐渐变轻, 变化趋势完全相反。Liao et al.[41]也在辽河盆地冷东油田生物降解油砂中发现了类似的现象。Barth et al.[39]的研究表明, 未降解的原油中含氧极性化合物以酚为主, 而生物降解油中含氧极性化合物以羧酸类为主。Watson et al.[10]的好氧生物降解模拟实验进一步表明, 在轻度–中度生物降解阶段正构烷烃的消耗非常快, 产生了大量的脂肪酸进入胶质组分。晏德福模型[42]认为原油是一种以沥青质为分散相(即胶束相), 胶质为胶溶剂, 油分(即饱和分+芳香分)为分散介质的胶体。沥青质处在胶束中心, 胶质分子吸附在沥青质表面, 对沥青质起保护作用, 胶质周围又吸附相对芳香性较低的较小分子,并逐渐地过渡到作为分散介质的饱和烃类, 中间没有相界面; 只有当沥青质、胶质、芳香烃以及饱和烃的特性和含量相匹配时, 上述这种呈梯度的胶体结构才能稳定存在。作为轻度–中度生物降解阶段主要降解产物的脂肪酸, 继承了正构烷烃偏重的 δ13C值。在生物降解过程中, 脂肪酸含量越来越高, 也更多地作为沥青质的胶溶剂, 并与沥青质的核心结构通过形成氢键和酯键的方式相互结合[41], 使沥青质的整体δ13C值也发生相应的变化。这种烃类化合物的降解产物如酸、醇和酚类等可以通过各种形式结合到胶质和沥青质组分中, 从而影响沥青质组分的δ13C值的现象被 Liao et al.[41]称为生物降解产物对沥青质的 δ13C值的“拉动效应”。因此, “拉动效应”既存在于油藏的厌氧降解过程中, 也存在于好氧降解模拟实验中。此外, 在本模拟实验中, 全油的δ13C值随着正构烷烃的消耗而逐渐变轻, 说明正构烷烃的降解产物并未完全停留在降解油中, 一部分降解产物(如低碳数烷基酸和 CO2)可能由于水溶性较强而无法被萃取回收, 这从培养基水相 pH值由降解前的7.10逐渐下降至6.11获得了证实(表1)。在好氧条件下, 这些通过形成具水溶性的降解产物(如烷基酸和CO2)而造成的含较重δ13C化合物的损失会导致本模拟实验中全油的δ13C值随生物降解程度的增加而逐渐下降。
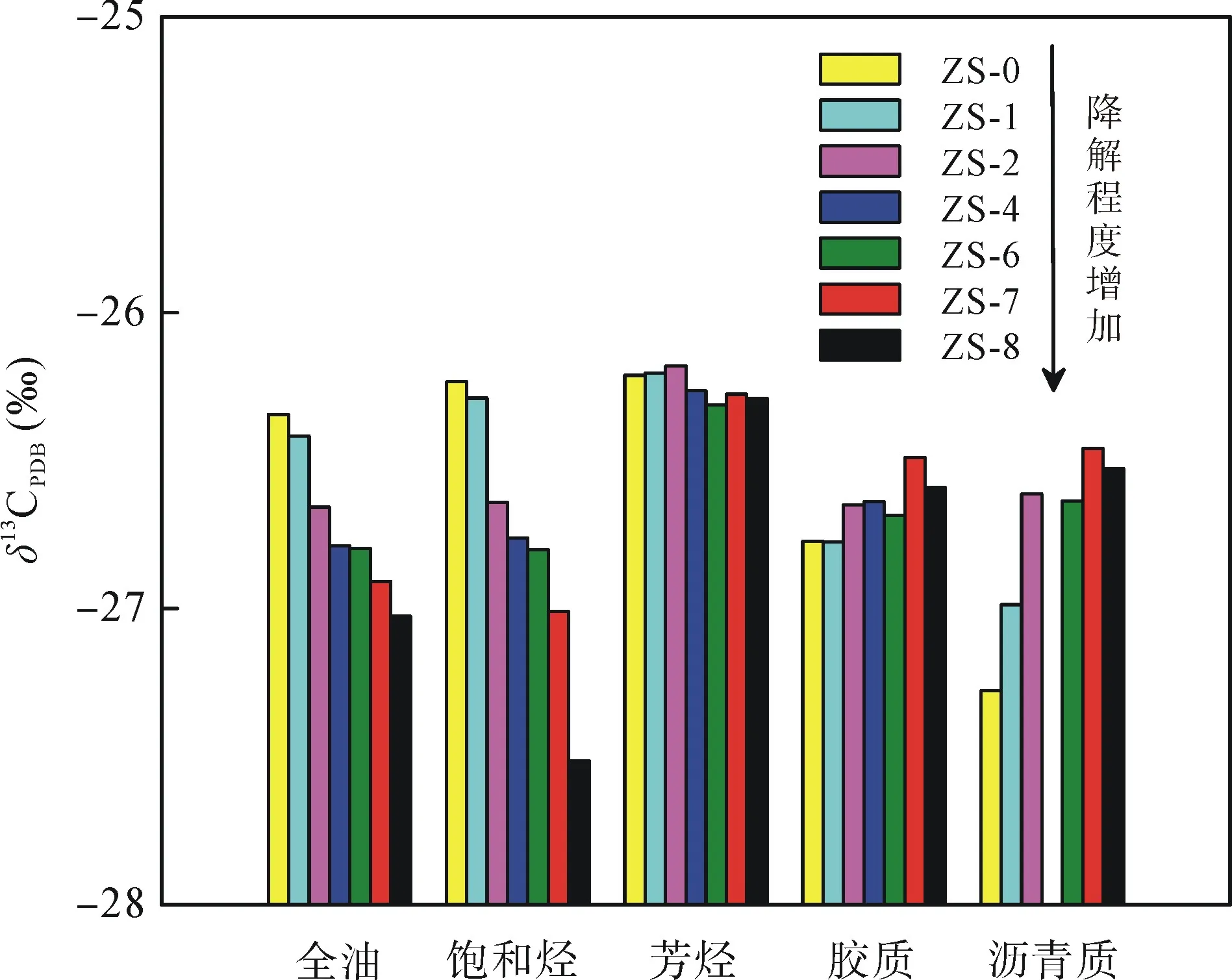
图5 降解油全油及其族组分的稳定碳同位素组成Fig.5 The δ13C values of bulk oils and oil groups for the biodegraded oils ZS-4降解油样沥青质组分样品量过低, 无法分析。
综上所述, 原油中正构烷烃的生物降解产物的赋存状态推测起来至少有如下3种形式(图6): 正构烷烃的好氧降解产物中一部分较高碳数的酸和醇由于水溶性较弱而进入降解油的胶质和沥青质组分中;一部分较低碳数的酸和醇, 包括通过脂肪酸的 β位氧化形成的低碳数脂肪酸, 由于水溶性较强而进入水相中; 另外, 在脂肪酸的β位氧化过程中, 不断减少的二碳单元(乙酰辅酶a)最终氧化成为CO2。由于正构烷烃的δ13C值较其他组分偏重, 通过形成水溶性降解产物和挥发性的CO2而造成的损失会造成全油的δ13C值变轻, 而其形成的酸和醇进入到胶质和沥青质组分中则会造成胶质和沥青质组分的δ13C值逐渐变重, 即具有相对较重的δ13C值的酸和醇会对胶质和沥青质的δ13C值形成“拉动效应”[41], 但这部分酸和醇不会改变全油的δ13C值。
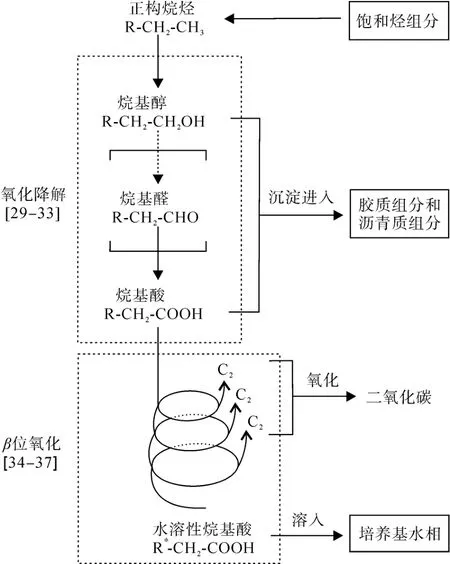
图6 原油的好氧生物降解过程中正构烷烃的可能的降解途径和产物去处Fig.6 Possible biodegradation pathway and products of n-alkanes during the aerobic biodegradation of crude oil
3 结 论
(1) 好氧条件下, 原油的饱和烃组分要先于其他组分发生生物降解, 饱和烃组分的优先降解消耗会造成其他原油组分(芳烃、胶质和沥青质)的相对含量逐渐增加; 正构烷烃先于异构烷烃被降解, C12+正构烷烃的抗降解性随碳数的增加而依次增强, 低碳数的正构烷烃先于高碳数的正构烷烃被降解。
(2) 好氧生物降解过程中, 正构烷烃(C14~C30)未发生明显的碳同位素分馏。因此, 微生物选择性地好氧降解正构烷烃可能更依据其相对浓度和疏水程度, 而并非不同的碳核素组成。
(3) 在正构烷烃系列的好氧生物降解产物一部分具水溶性的酸、醇和 CO2溶入水相中, 使原油的δ13C值发生变化; 降解产物中大量水溶性较差的高碳数酸和醇进入到胶质和沥青质组分中, 部分化合物通过氢键缔合和形成氢键等方式结合到沥青质结构中而对沥青质组分的δ13C值产生“拉动效应”。
由衷感谢中国科学院广州地球化学研究所陈华山高级工程师和郑益军博士在模拟实验和分析中给予的帮助。
:
[1] Head I M, Jones D M, Larter S R. Biological activity in the deep subsurface and the origin of heavy oil [J]. Nature, 2003,426(6964): 344–352.
[2] Larter S, Wilhelms A, Head I, Koopmans M, Aplin A,Di-Primio R, Zwach C, Erdmann M, Telnaes N. The controls on the composition of biodegraded oils in the deep subsurface–part 1: Biodegradation rates in petroleum reservoirs [J].Org Geochem, 2003, 34(4): 601–613.
[3] Roadifer R E. Size distribution of world’s largest known oil and tar accumulation [C]//Meyer R F. Exploration for Heavy Oil and Natural Bitumen (Abstract Volume). Tulsa: AAPG Studies in Geology 25, American Association of Petroleum Geologists, 1987: 3–23.
[4] Kim S, Stanford L A, Rodgers R P, Marshall A G, Walters C C,Qian K, Wenger L M, Mankiewicz P. Microbial alteration of the acidic and neutral polar NSO compounds revealed by Fourier transform ion cyclotron resonance mass spectrometry [J]. Org Geochem, 2005, 36(8): 1117–1134.
[5] Phillippi G T. On the depth, time and mechanism of origin of the heavy to medium gravity naphthenic crude oils [J]. Geochim Cosmochim Acta, 1977, 41(1): 33–35.
[6] Magoon L B, Claypool G E. Two oil types on North Slope of Alaska — Implications for exploration [J]. AAPG Bulletin,1981, 65(4): 644–652.
[7] Peters K E, Walters C C, Moldowan J M. The Biomarker Guide, biomarkers and isotopes in petroleum exploration and earth history [M]. New York: Cambridge University Press,2005: 645–708.
[8] Stahl W J. Compositional changes and13C/12C fractionations during the degradation of hydrocarbons by bacteria [J]. Geochim Cosmochim Acta, 1980, 44(11): 1903–1907.
[9] Palmer S E. Effects of biodegradation and water washing on crude oil composition [J]. Org Geochem, 1993, 11(1):511–533.
[10] Watson J S, Jones D M, Swannell R P J, van-Duin A C T.Formation of carboxylic acids during aerobic biodegradation of crude oil and evidence of microbial oxidation of hopanes [J].Org Geochem, 2002, 33(10): 1153–1169.
[11] Aitken C M, Jones D M, Larter S R. Anaerobic hydrocarbon biodegradation in deep subsurface oil reservoirs [J]. Nature,2004, 431(7006): 291–294.
[12] Grossi V, Cravo-Laureau C, Guyoneaud R, Ranchou-Peyruse A, Hirschler-Réa A. Metabolism of n-alkanes and n-alkenes by anaerobic bacteria: A summary [J]. Org Geochem, 2008,39(8): 1197–1203.
[13] 陈传平, 梅博文, 易绍金, 王大华, 金迪威, 张春明. 砂岩储层中原油微生物降解的模拟实验研究[J]. 沉积学报,1997, 15(1): 135–140.Chen Chuan-ping, Mei Bo-wen, Yi Shao-jing, Wang Da-hua,Jin Di-wei, Zhang Chun-ming. Simulated experiment research on oil biodegradation in sand reservoir [J]. Acta Sedimentol Sinica, 1997, 15(1): 135–140 (in Chinese with English abstract).
[14] 张渠, 梁舒, 张志荣, 把立强, 郑伦举. 原油模拟生物降解的饱和烃色谱分析[J]. 石油实验地质, 2005, 27(1): 81–84.Zhang Qu, Liang Shu, Zhang Zhi-rong, Ba Li-qiang, Zheng Lun-ju. Gas chromatographic analysis of simulated biodegraded saturated hydrocarbon [J]. Petrol Geol Exp, 2005,27(1): 81–84 (in Chinese with English abstract).
[15] 包建平, 朱俊章, 朱翠山, 易绍兴, 倪春华. 原油生物降解模拟实验[J]. 石油勘探与开发, 2007, 34(1): 43–47.Bao Jian-ping, Zhu Jun-zhang, Zhu Cui-shan, Yi Shao-xing,Ni Chun-hua. A biodegradation experiment of crude oils in laboratory [J]. Petrol Explor Develop, 2007, 34(1): 43–47 (in Chinese with English abstract).
[16] 向廷生, 黑花丽. 原油生物降解模拟实验及其定量化评价[J].现代地质, 2010, 24(2): 259–267.Xiang Ting-sheng, Hei Hua-li. A biodegradation experiment of crude oils in laboratory and quantitative evaluation [J].Geoscience, 2010, 24(2): 259–267 (in Chinese with English abstract).
[17] Townsend G T, Prince R C, Suflita J M. Anaerobic oxidation of crude oil hydrocarbons by the resident microorganisms of a contaminated anoxic aquifer [J]. Environ Sci Technol, 2003,37(22): 5213–5218.
[18] da-Cruz G F, de-Vasconcellos S P, Angolini C F F, Dellagnezze B M, Garcia I N S, de-Oliveira V M, dos-Santos-Neto E V, Marsaioli A J. Could petroleum biodegradation be a joint achievement of aerobic and anaerobic microrganisms in deep sea reservoirs? [J]. AMB Express, 2011, 1: 47.
[19] Huang Y, Eglinton G, Ineson P, Latter P M, Bol R, Harkness D D. Absence of carbon isotope fractionation of individual n-alkanes in a 23-year field decomposition experiment with Calluna vulgaris [J]. Org Geochem, 1997, 26(7–8): 497–501.
[20] Masterson W D, Dzou L I P, Holba A G, Fincannon A L, Ellis L. Evidence for biodegradation and evaporative fractionation in West Sak, Kuparuk and Prudhoe Bay field areas, North Slope, Alaska [J]. Org Geochem, 2001, 32(3): 411–441.
[21] Mazeas L, Budzinski H, Raymond N. Absence of stable carbon isotope fractionation of saturated and polycyclic aromatic hydrocarbons during aerobic bacterial biodegradation [J]. Org Geochem, 2002, 33(11): 1259–1272.
[22] Sun Y G, Chen Z Y, Xu S P, Cai P X. Stable carbon and hydrogen isotopic fractionation of individual n-alkanes accompanying biodegradation: Evidence from a group of progressively biodegraded oils [J]. Org Geochem, 2005, 36(2):225–238.
[23] 彭先芝, 张干, 陈繁忠, 刘国卿. 好氧生物降解中烷烃单体稳定同位素分馏及其环境意义[J]. 科学通报, 2004, 49(24):2605–2611.Peng Xianzhi, Zhang Gan, Chen Fanzhong, Liu Guoqing.Stable isotope fractionation of individual n-alkanes during aerobic bacterial biodegradation and its environmental significance [J]. Chinese Sci Bull, 2004, 49(24): 2605–2611 (in Chinese).
[24] 丁明宇, 黄健, 李永祺. 海洋微生物降解石油的研究[J]. 环境科学学报, 2001, 21(1): 84–88.Ding Ming-yu, Huang Jian, Li Yong-qi. The degradation of crude oil by marine microorganisms [J]. Acta Sci Circum,2001, 21(1): 84–88 (in Chinese with English abstract).
[25] 李慧, 陈冠雄, 张颖, 徐慧, 金寰宇, 张成刚. 高效石油烃降解菌的分离鉴定及降解特性[J]. 哈尔滨工业大学学报,2007, 39(10): 1664–1669.Li Hui, Chen Guan-xiong, Zhang Ying, Xu Hui, Jin Huan-yu,Zhang Cheng-gang. Isolation and identification of high-efficiency petroleum-degrading bacteria and their degradation characteristics [J]. J Harbin Inst Technol, 2007,39(10): 1664–1669 (in Chinese with English abstract).
[26] 孔淑琼, 佘跃惠, 易绍金, 王正良, 黄晓武. 七个泉油田原油的生物降解及配伍条件选择[J]. 石油天然气学报, 2011,33(1): 48–52.Kong Shu-qiong, She Yue-hui, Yi Shao-jin, Wang Zheng-liang, Huang Xiao-wu. Evaluating microbial degradation properties and compatibility of crude oil from Qigequan oilfield [J]. J Oil Gas Technol, 2011, 33(1): 48–52 (in Chinese with English abstract).
[27] 白洁, 崔爱玲, 吕艳华. 石油降解菌对石油烃的降解能力及影响因素研究[J]. 海洋湖沼通报, 2007 (3): 41–48.Bai Jie, Cui Ai-ling, Lü Yan-hua. The degradation capability of crude oil degrading strains and the impacting factors [J].Trans Oceanol Limnol, 2007 (3): 41–48 (in Chinese with English abstract).
[28] 何丽媛, 党志, 唐霞, 卢桂宁, 郭楚玲, 吴平霄, 刘丛强.混合菌对原油的降解及其降解性能的研究[J]. 环境科学学报, 2010, 30(6): 1220–1227.He Li-yuan, Dang Zhi, Tang Xia, Lu Gui-ning, Guo Chu-ling,Wu Ping-xiao, Liu Cong-qiang. Biodegradation characteristics of crude oil by mixed bacterial strains [J]. Acta Sci Circum,2010, 30(6): 1220–1227 (in Chinese with English abstract).
[29] Markovetz A J. Subterminal oxidation of aliphatic hydrocarbons by microorganism [J]. Crit Rev Microbiol, 1971, 1(2):225–237.
[30] Fennewald M, Shapiro J. Regulatory mutations of the Pseudomonas plasmid alk regulon [J]. J Bacteriol, 1977, 132(2):622–627.
[31] Fennewald M, Benson S, Oppici M, Shapiro J. Insertion element analysis and mapping of the Pseudomonas plasmid alk regulon [J]. J Bacteriol, 1979, 139(3): 940–952.
[32] Lee N R, Hwang M O, Jung G H, Kim Y S, Min K H. Physical structure and expression of alkBA encoding alkane hydroxylase and rubredoxin reductase from Pseudomonas maltophilia [J].Biochem Biophys Res Commun, 1996, 218(1): 17–21.
[33] Whyte L, Bourbonniere L, Greer C W. Biodegradation of petroleum hydrocarbon by psychrotrophic Pseudomonas strains possessing both alkane (alk) and naphthalene (nah) catabolic pathways [J]. Appl Environ Microbiol, 1997, 63(9):3719–3723.
[34] Kennedy E P, Lehninger A L. Oxidation of fatty acids and tricarboxylic acid cycle intermediates by isolated rat liver mitochondria [J]. J Biol Chem, 1949, 179(2): 957–972.
[35] Kennedy E P, Lehninger A L. The products of oxidation of fatty acids by isolated rat liver mitochondria [J]. J Biol Chem,1950, 185(1): 275–285.
[36] Kennedy E P, Lehninger A L. Activation of fatty acid oxidation by dihydrodiphosphopyridine nucleotide [J]. J Biol Chem,1951, 190(1): 361–368.
[37] Singer M E, Finnerty W R. Microbial metabolism of straight-chain and branched alkanes [M]//Atlas R M. Petroleum Microbiology. New York: Macmillan Publishing, 1984:1–60.
[38] Erstad K, Hvidsten I V, Askvik K M, Barth T. Changes in crude oil composition during laboratory biodegradation: Acids and oil-water, oil-hydrate interfacial properties [J]. Energ Fuel,2009, 23(8): 4068–4076.
[39] Barth T, Høiland S, Fotland P, Askvik K M, Pedersen B S,Borgund A E. Acidic compounds in biodegraded petroleum [J].Org Geochem, 2004, 35(11/12): 1513–1525.
[40] Liao Y H, Shi Q, Hsu C S, Pan Y H, Zhang Y H. Distribution of acids and nitrogen-containing compounds in biodegraded oils of the Liaohe Basin by negative ion ESI FT-ICR MS [J].Org Geochem, 2012, 47: 51–65.
[41] Liao Y H, Geng A S, Huang H P. The influence of biodegradation on resins and asphaltenes in the Liaohe Basin [J]. Org Geochem, 2009, 40(3): 312–320.
[42] Yen T F. The colloidal aspects of a macrostructure of petroleum asphalt [J]. Pet Sci Technol, 1992, 10(4/6): 723–733.
