持续蒸发与补给蒸发过程中水体咸化及同位素分馏的实验研究
2015-07-02李静,王聪,梁杏,马斌,葛勤
李 静, 王 聪, 梁 杏, 马 斌, 葛 勤
(1. 中国地质大学(武汉) 环境学院, 湖北 武汉 430074; 2. 国土资源部 地裂缝地质灾害重点实验室, 江苏 南京 210018; 3. 湖北省 环境科学研究院, 湖北 武汉 430072; 4. 生物地质与环境地质国家重点实验室, 中国地质大学(武汉), 湖北 武汉 430074)
0 引 言
华北平原浅层广泛分布的咸水体[1–2], 是在 12 ka前后干旱的气候环境下, 受蒸发浓缩作用形成, 即大陆盐化咸水层[3]。查明蒸发过程中水体的咸化及氢氧同位素分馏机制, 对于揭示地表水或地下水的成因与演化规律具有重要意义[4–5]。很多学者已开展蒸发实验研究了水体在咸化过程中水化学及同位素的演变机制, 得出了蒸发过程中的蒸发结晶路线、析盐规律[6–8]、氢氧同位素的分馏效应及湿度和温度对其的影响[9–11]。自然界中水体处于不断的水文循环当中, 通常大陆盐化作用涉及水的(迁移)流动和蒸发(排泄)两个方面。而前人[12–15]对蒸发过程的实验研究大多采用持续蒸发的实验方式, 未考虑蒸发过程中水流补给的影响。在实际水文循环系统中,蒸发排泄和水的侧向径流补给(或大气降水补给)同时存在, 这种条件下的水化学和同位素演变鲜见报道,有待进一步研究。本文拟利用唐山和衡水地下水样品,通过设计持续蒸发和补水蒸发两种模式开展蒸发实验研究, 旨在查明在有水源补给条件下蒸发过程中水化学和同位素富集规律及其与纯蒸发的差异。
1 实验方案及测试
1.1 持续蒸发实验
分别采用唐山地下淡水(TDS = 0.7 g/L)和衡水地下微咸水(TDS = 1.9 g/L)进行实验, 蒸发温度均为60 ℃。实验设计: 唐山水样取450 mL盛放在烧杯中, 利用电热板加热。实验过程分4个蒸发阶段,利用量筒测量蒸发前后水体积变化, 即蒸发量。每阶段蒸发量控制为50 mL, 采取表层水体50 mL进行测试, 总蒸发时长约216 h。衡水水样采用了6个盛放250 mL水样的烧杯和2个盛放500 mL水样的烧杯进行加热, 不同烧杯加热不同时长, 即分 8个蒸发阶段, 测量每个烧杯的蒸发量, 采集表层水体进行测试, 最大蒸发时长约134 h。所取唐山水样测试水化学组分, 衡水水样测试水化学组分和氢氧同位素。
1.2 补给蒸发实验
分别把盛放唐山水样 500 mL的烧杯和衡水水样300 mL的烧杯放在电热板加热。分7个蒸发阶段,测量每一阶段的蒸发量, 设计补水量等于蒸发量(水体总量保持不变, 除了取样损失)。每次取样前, 先使用原始水样补充蒸发的水量, 使其混合均匀。唐山水样蒸发率控制为20%, 蒸发总时长469 h, 每次取样 50 mL, 测试水化学组成。衡水水样蒸发率约50%, 蒸发总时长 191 h, 每次取样 25 mL, 测试水化学组成和氢氧同位素。
1.3 测试项目与方法
所采水样水化学测试包括pH、电导率、阴阳离子。其中pH和电导率采用哈希便携式水质分析参数仪(仪器型号: HQ30d)测试; 碱度(HCO3–计)采用滴定法测试; 阴阳离子分别采用离子色谱仪(仪器型号: DIONEX-120)和 ICP-AES(仪器型号:IRIS Intrepid Ⅱ X SP 型)测试, 精度分别为 0.1和0.01。
氢氧同位素的分析仪器为 Mat253气体同位素质谱仪, 氢同位素测试精度优于2‰, 氧同位素测试精度优于0.2‰。
2 结果与讨论
实验水样的原始组成及蒸发水样的测试结果如表1和表2所示。其中唐山水样主要用来分析两种蒸发实验中水化学演变差异, 衡水水样主要用来分析同位素富集的差异。
2.1 化学组分演化差异
在持续蒸发与补给蒸发实验中, 水样的电导率(EC)和pH随着蒸发时间总体上呈增大的趋势(图1)。EC的升高表明盐分的浓缩, pH的升高是由于水中CO2的释出造成的。但两种蒸发过程中, EC和pH变化曲线表现出明显分离: 持续蒸发条件下, 蒸发约200 h, 水样电导率由原始的1107 μS/cm增加到1881 μS/cm, pH由7.8增加到9.0, 浓缩速率逐渐增大。补给蒸发条件下, 盐分的浓缩速率明显较低, 蒸发约 500 h, 电导率由原始的 1107 μS/cm 增加到1865 μS/cm, pH由7.8增加到8.9。这是因为在有淡水补给过程中, 蒸发和稀释作用同时存在, 抵消了部分蒸发效果。因此在干旱气候环境中, 水体浓度的高低不仅取决于蒸发强度, 还与水的径流(循环)密切相关。
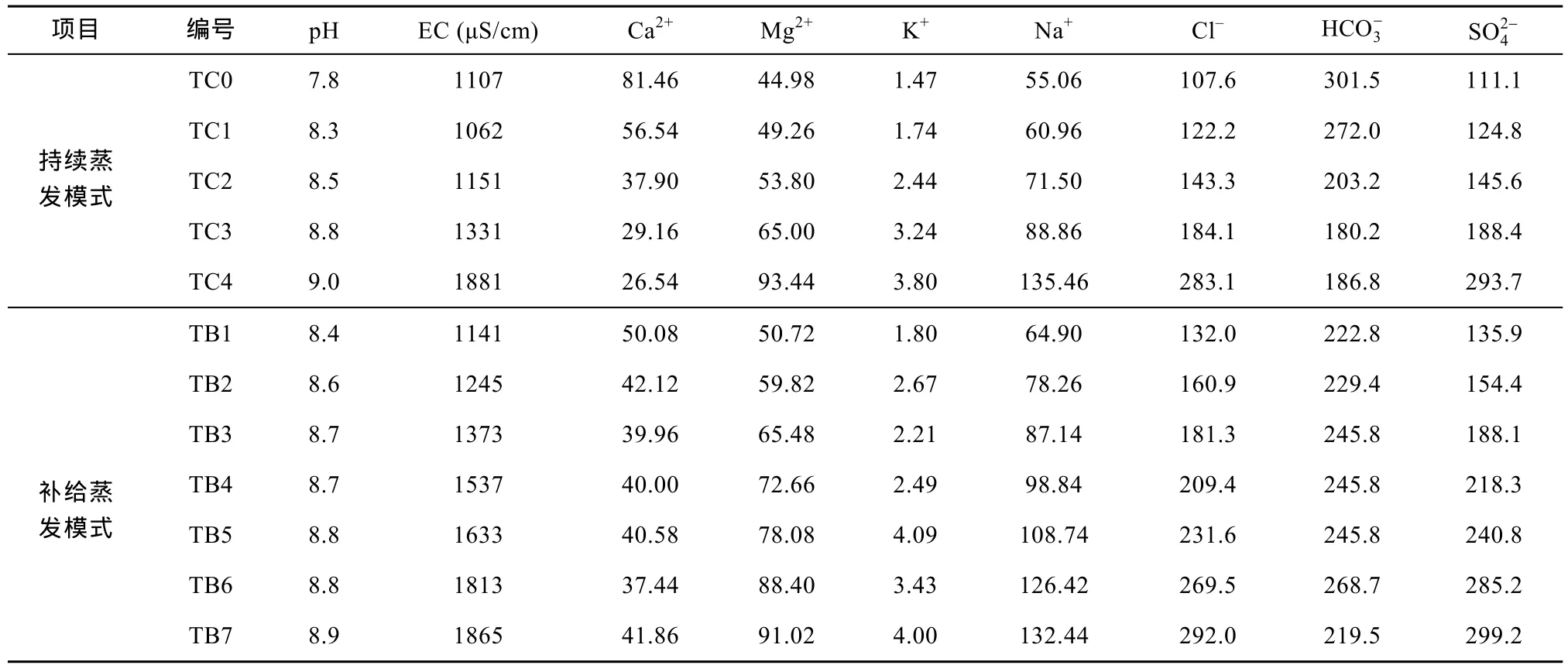
表1 唐山原始水样(TC0)及蒸发样品水化学测试结果(mg/L)Table 1 Chemistry data (mg/L) for original water (TC0) and evaporation water samples of Tangshan

表2 衡水原始水样(HB0)和蒸发样品同位素测试结果(‰)Table 2 Isotopic data (‰) for original water (HB0) and evaporation water samples of Hengshui
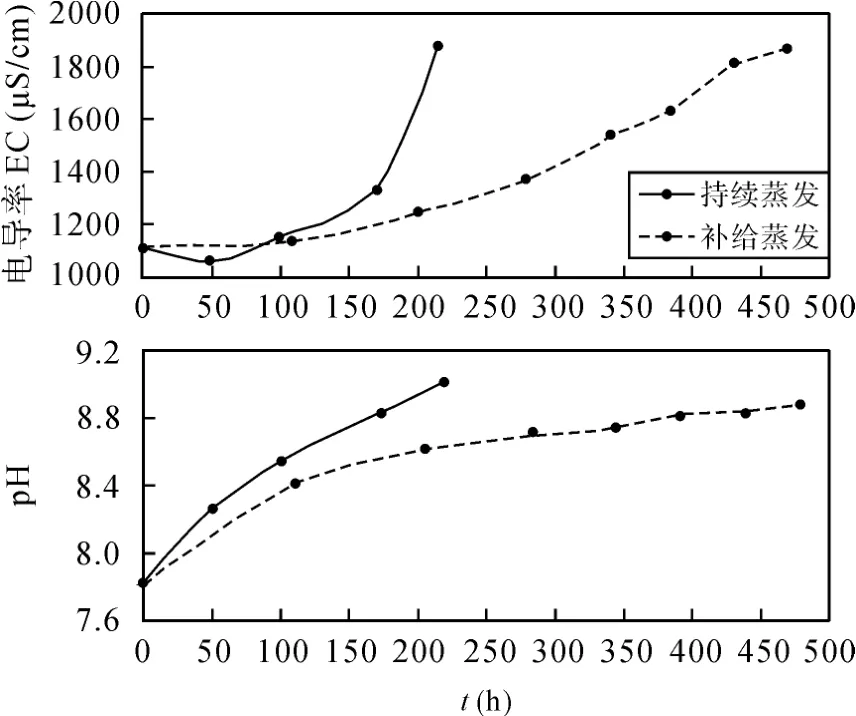
图1 唐山淡水持续蒸发和补给蒸发模式下电导率和pH变化规律Fig.1 Diagrams showing electrical conductivity and pH variation trends with time under continuous evaporation and recharge evaporation for Tangshan freshwater samples
仔细观察图 1可以发现, 持续蒸发过程中水样的电导率在蒸发初期(0~100 h)存在下降过程, 蒸发实验中浓度一般不会出现降低现象。本情况的发生可能与唐山水样有关, 实验水样的水化学类型为HCO3·Cl·SO4-Ca·Mg·Na 型水。以 H CO3-、Ca2+为主的水样, 在蒸发过程中水温增加, 极易发生如下化学反应(1)而生成 CaCO3, 溶解度大大减小, 发生沉淀。在蒸发初期当该反应产生的沉淀量大于其他离子浓缩程度时, 造成了电导率的下降。
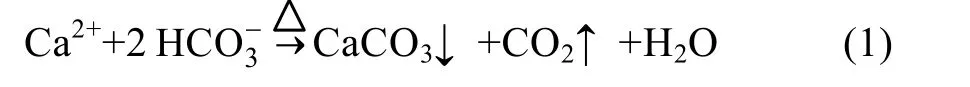
各离子的变化过程可进一步说明这一点。如图2所示, 持续蒸发过程中Ca2+和 H CO3-含量在蒸发初期浓度下降, 一旦 CaCO3沉淀存在于水样中, 此水环境中则 Ca2+达到饱和, 如图 2所示后期 Ca2+保持稳定。H CO3-离子在蒸发过程中可继续分解为 C O32-,可与Mg2+结合生成MgCO3微溶沉淀, 但从图2中可以看出Mg2+处于持续缓慢增加的过程中, 而 H CO3-含量并未持续下降, 而是相对稳定, 表明在蒸发过程中基本不存在MgCO3的析出或含量甚少。在补水蒸发过程中, 虽然存在 Ca2+和 H CO3-下降过程, 但降低值较小, 主要与受到淡水补给有关, 电导率并未显示出下降值。
其他各离子(S O24-、Mg2+、Na+、Cl–和 K+)与电导率同步变化, 两种蒸发过程离子与电导率关系曲线基本吻合(K+含量较低, 在误差范围内波动)。说明在实验设计蒸发程度下, 水中矿物在蒸发早期以方解石(CaCO3)沉淀为主, 其他盐分以浓缩作用为主。李亚文等[8]所做的南海蒸发实验得出在海水蒸发了80%后, 才开始析出石膏。在整个蒸发过程中, 方解石的动态溶解-沉淀平衡和盐分的浓缩作用共存。持续蒸发过程中, 早期以方解石析出作用为主, 引起电导率下降, 后期以盐分的浓缩为主; 在补水蒸发过程中, 方解石早期的析出作用较小, 如 Ca2+和HCO3-含量高于持续蒸发实验, 以盐分的浓缩为主。
综上可知, 持续蒸发与补水蒸发过程中水化学变化的差异主要为浓缩速率的不同。同时 Ca2+和HCO3-浓度在两种蒸发过程中差异明显, 是由于这两种离子参与了化学反应; 当溶液中离子的矿物未饱和时, 如 Na+、K+、 S O24-、Cl–以蒸发浓缩作用为主。其离子变化主要受水样盐度控制, 与是否有水源补给影响不大。两种蒸发方式下, 水化学类型也发生规律性的变化。持续蒸发: 水型变化,HCO3·Cl·SO4-Ca·Mg·Na → HCO3·Cl·SO4-Mg ·Ca·Na →HCO3·Cl·SO4-Mg·Na → Cl·SO4·HCO3-Mg·Na → Cl·SO4-Mg·Na; 补 给 蒸 发 : HCO3·Cl·SO4-Ca·Mg·Na →Cl·HCO3·SO4-Mg·Na·Ca → Cl·HCO3·SO4-Mg·Na →Cl·SO4·HCO3-Mg·Na → Cl·SO4-Mg·Na。水型由复杂向简单转化, H CO3-和Ca2+由主要离子逐渐退出水型组成。
2.2 氢氧同位素的富集过程
2.2.1 氢氧同位素与剩余水关系
持续蒸发实验与前人实验方法相似[9], 假定温度和湿度都不变的情况下, 每次挥发出的水汽即刻分离出系统, 剩余水的同位素逐渐富集, 此过程符合瑞利平衡蒸发模型。瑞利蒸发模型是英国科学家瑞利(Rayleigh)讨论液体混合物蒸发过程时提出来的一种模型[12]。在瑞利过程中, 体系中的两相物质处于一种瞬时平衡状态, 其过程可用下式来描述:

式中: Rl为任一瞬间反应物(剩余水体)的同位素比值;R0为蒸发水体初始同位素比值; f为剩余水体体积比;α 为液-气间分馏系数。利用公式 δ = (R样品/R标准– 1)转化可得δ形式下的瑞利分馏模型:

可以看出在瑞利分馏模式下, 剩余水体同位素δ与剩余水体积比f呈指数关系[13]。
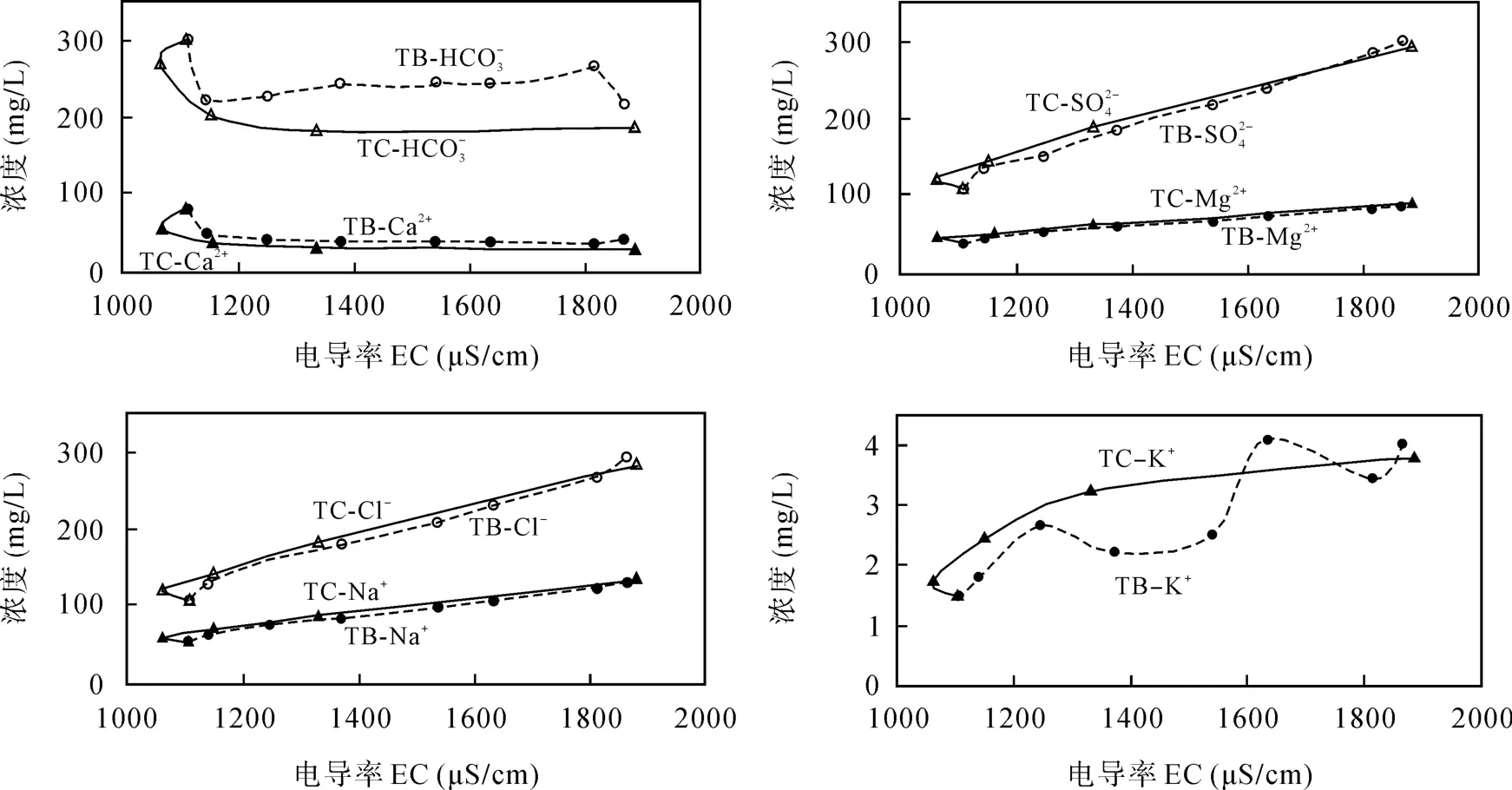
图2 唐山淡水不同蒸发过程中水样各离子浓度与电导率关系Fig.2 Diagrams showing relationships between ion content and electrical conductivity under the two evaporation experiments for Tangshan freshwater samples TC–持续蒸发; TB–补给蒸发。TC–continuous evaporation; TB–recharge evaporation.
持续蒸发过程中, 剩余水氢氧同位素含量随着剩余水体积比的减少而呈指数富集, 这与原有的瑞利平衡分馏模型结果一致(图3实线)。实验设计蒸发温度为60 ℃ , 平衡蒸发模型的分馏系数α只与温度相关, 据文献[16]可知: α18O= 1.0061, αD= 1.046,由公式(2)可得平衡分馏模型的剩余水同位素富集曲线(图3中虚线)。由图3可知, 实验测试剩余水同位素值高于平衡分馏模型趋势线, 说明实验在蒸发过程中同位素分馏不仅与温度有关, 还受到湿度的影响, 如存在水-汽间同位素交换等非平衡条件下的动力分馏。其次, 在蒸发过程中, 水体的氧同位素值还会受到方解石析出的影响。一般岩石及矿物的 δ18O值要比水的δ18O值大得多[16], 如发生矿物与水的同位素交换反应, 会明显增大水溶液的δ18O值。周根陶等[17]指出碳酸钙缓慢沉淀过程中, 碳酸钙与溶液中之间有足够的时间进行同位素交换, 而碳酸钙快速沉淀, 则继承溶液中碳酸根离子的同位素组成。本实验中碳酸钙持续沉淀, 可能与水体发生同位素交换反应。但受温度影响(< 60°)水与岩石矿物发生氢氧同位素交换的反应速度十分缓慢, 一般很难达到交换平衡[16]。
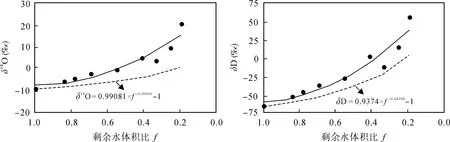
图3 衡水微咸水持续蒸发实验中剩余水氢氧同位素与剩余水体积比关系Fig.3 Diagrams showing relationships between stable isotopic value in residual water and residual water ratio under continuous evaporation experiment for Hengshui brackish water samples实线–实测数据趋势线; 虚线–瑞利平衡模型趋势线。Solid line – trend line of measured data; Dotted line – trend line of Rayleigh balance mode.
从数值来看, 随着蒸发率的增大, δ18O 由–9.19‰增加到 20.81‰, 变化值为 30‰; δD 由–62.6‰增加到56.9‰, 变化值为119.5‰, 同等条件下, D的富集速率约是18O的4倍, 说明氢同位素在富集过程中更为敏感, 这是由于H218O和DHO蒸汽压的差别使他们在蒸发过程中在水相的富集不成比例[18]。在 δD-δ18O 关系图中, 蒸发线斜率的大小主要取决于相对湿度, 其大小通常介于 4~6之间[19],如图 5所示, 蒸发水样点均落在全球雨水线的右下方, 并呈线性关系 δD = 4.11δ18O – 25.23 (R2= 0.99),斜率为 4.11, 即为持续蒸发实验条件下的蒸发线方程(图 5)。
2.2.2 氢氧同位素富集与盐分的关系
在持续蒸发模式下, 原始水样由初始 TDS为1.9 g/L增加到11.7 g/L。在含盐的溶液中, 氢氧同位素的分馏系数不仅是温度的函数, 而且也是盐度的函数, 在离子水合作用影响下, 含盐溶液中的重同位素水分子的活度系数与轻同位素水分子的活度系数之比不等于 1, 从而影响了盐水蒸发过程中氢氧同位素的分馏系数, 使盐水的蒸发不同于淡水的蒸发[19]。
如图4所示, 在蒸发过程中, δ18O值随着阴阳离子含量的升高呈现两段式富集: 在低盐水中, 氢氧同位素随着离子含量升高, 富集速率较快, 当盐度增加到一定程度时, 氢氧同位素富集速率变慢。以Na+为例, 在Na+含量小于500 mg/L时, δ18O与Na+关系方程为 δ18O = 0.09 × Na – 31.9 (R2= 0.99), 在Na+含量大于 500 mg/L时, δ18O与 Na+关系方程为δ18O = 0.01 × Na – 4.08 (R2= 0.96)。Mg2+、Cl–、S O24-与 Na+相似, 在蒸发过程中均与 δ18O成两段式线性关系。
随着盐度增加, 水体相对纯水18O富集的现象,即为盐效应。Horita[19]研究得出盐水(矿化度大于海水, 50~150 g/L)中阴离子(Cl–, S O24-)对 D和 δ18O 的分馏具有重要影响, 随着温度增加, 盐效应降低。如蒸发温度从10 ℃增加到150 ℃, D同位素的盐效应由2.4‰/mol降低到1‰/mol。其次, 碱土金属(Ca2+、Mg2+)对D和18O产生的盐效应具有方向上的差别[20]。而本实验中未设置相应条件下淡水蒸发实验, 无法比对盐度对氢氧同位素分馏的影响, 但从实验结果看阴阳离子与δ18O的关系一致, 可能是由于该水样浓度较低(< 2 g/L), 对氢氧同位素的分馏未产生显著影响。
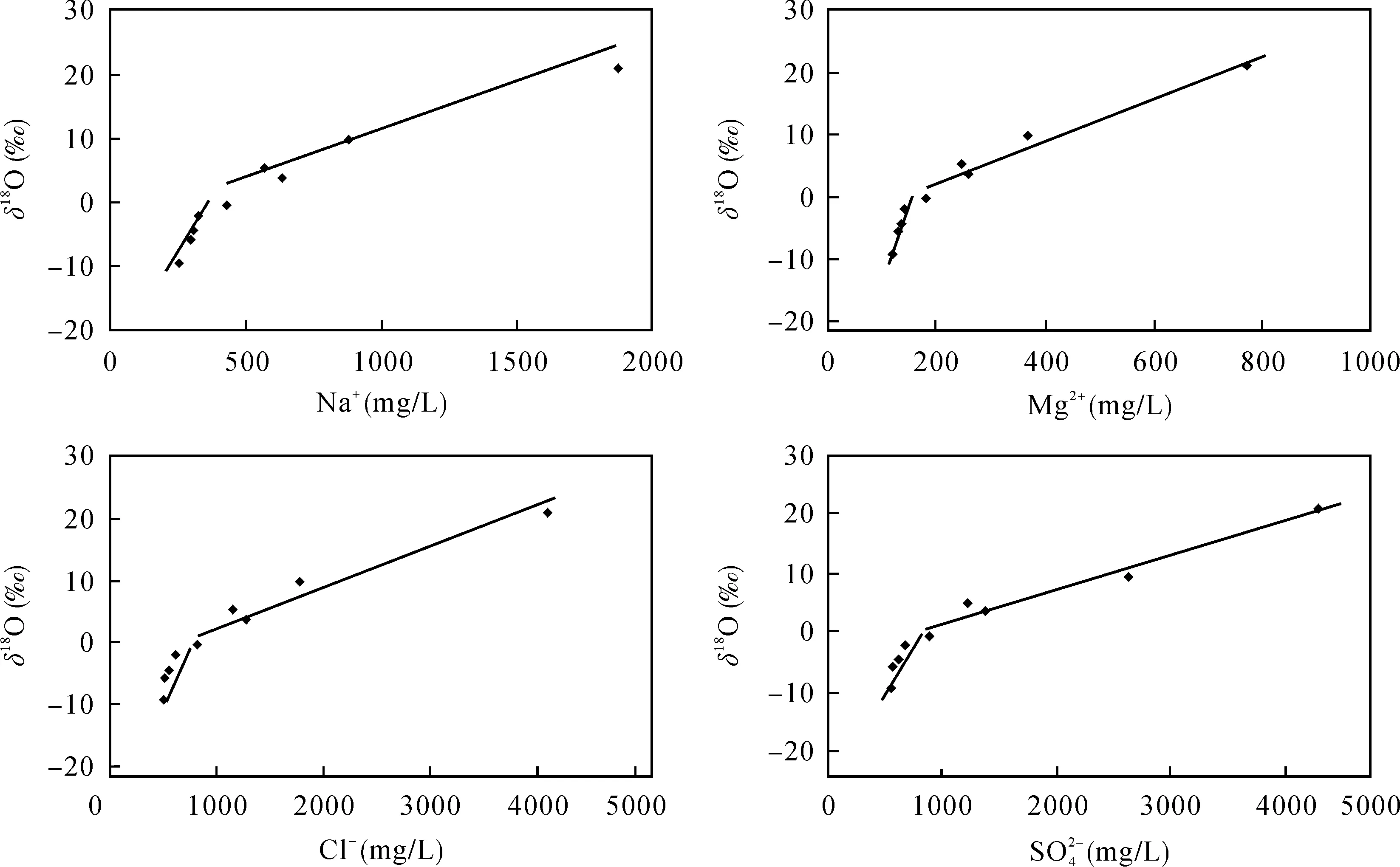
图4 衡水微咸水阴阳离子与δ18O关系Fig.4 Diagrams showing relationships of ions content vs. δ18O for Hengshui brackish water samples
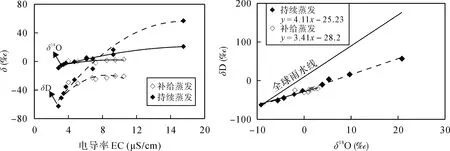
图5 衡水微咸水不同蒸发实验模式下水的电导率与氢氧同位素关系(a)及水的蒸发线方程(b)Fig.5 Diagrams showing relationships between stable isotopic value for residual water and electrical conductivity (a) and evaporation lines (b)under the two evaporation experiments of Hengshui brackish water samples
2.2.3 持续蒸发与补给蒸发过程中同位素富集差异
如图 5a所示, 在持续蒸发与补给蒸发过程中,随着蒸发的进行, 水的盐度(电导率)逐渐增大, δD的变化范围明显大于δ18O的变化范围, 进一步说明D同位素在蒸发过程中富集速率大于氧同位素。对比两种蒸发实验可以发现, 达到相同的盐度(电导率), 持续蒸发模式下氢氧同位素值相对补给蒸发模式明显偏正。这是由于持续蒸发情况下, 轻同位素逐渐挥发出系统, 重同位素持续富集; 而补给蒸发模式下, 由于存在原水的补给, 同位素不断受到混合, 减弱了重同位素的富集程度。
其次, 持续蒸发模式下, 同位素随着盐度(电导率)的增大持续增加, δ18O最大值达20.81‰, 而补给蒸发模式下, 水样的电导率在后期缓慢增加, 氧同位素趋于稳定, δ18O最大值达2.9‰。Gonfiantini[20]指出受限盆地在过度蒸发的条件下δ18O将会增大趋近于一个稳定值, 该值由补给水的流入和相对湿度控制。补给蒸发模式控制蒸发率为 50%, 每蒸发近一半水体积, 则进行补给, 在这种蒸发条件下, 氧同位素的富集由补给水源和气象因素(温度、湿度)共同控制。
由氢氧同位素关系曲线可知(图 5b), 不同蒸发过程, 蒸发线方程也不同。持续蒸发模式蒸发线斜率为4.11大于补给蒸发模式蒸发线斜率3.41。王永森等[13]研究得出自由水体蒸发线斜率主要受温度和湿度控制。在温度不变的情况下, 蒸发线线斜率随湿度的增加而增加; 在湿度不变的情况下, 斜率随温度的升高而减低。补给蒸发模式蒸发线斜率较低主要受同位素混合作用和相对更强的非平衡动力分馏影响。在有补给源存在的情况下, 打破原始的水环境状态, 如水-汽的平衡及水温的变化, 水分子扩散运动相对强烈等。
综上可知, 补给蒸发方式下水同位素的富集过程更接近实际情况, 在有其他水补给情况下, 氢氧同位素在蒸发过程中不会持续富集, 且蒸发线斜率小于持续蒸发实验值。
3 结 论
(1) 在持续蒸发和补给蒸发两种模式下, 水化学演化的相同点表现为: 逐渐咸化和弱碱性化。水中Ca2+、 H CO3-浓度在初期存在瞬时降低并保持稳定, Mg+、Na+、Cl–、 S O24-浓度逐渐升高, 该水样水化学类型由复杂向简单型转变; 不同点表现为持续蒸发过程中水体浓缩速率较快, 蒸发初期水体以方解石沉淀作用为主, 引起电导率下降, 后期方解石处于动态平衡中, 其他组分以浓缩为主; 补给蒸发过程中水体浓缩速率明显减慢, 水中Ca2+、H CO3-含量较高, 盐分浓缩掩盖了方解石早期析出, 电导率持续升高。
(2) 蒸发过程中, 氢氧同位素逐渐偏正, 氢同位素相对氧同位素更为敏感。氢氧同位素富集与剩余水比例呈指数关系, 符合瑞利分馏模型, 同时也受到界面处水-汽非平衡分馏与水岩同位素交换的影响; 与水中阴阳离子呈两段式线性关系, 离子在低浓度段增加时, 氢氧同位素富集较快。
(3) 得出了两种蒸发过程中衡水地区的蒸发线方程: 持续蒸发条件下, 氢氧同位素的富集随着电导率的增加持续偏正, 蒸发方程为δD = 4.11δ18O –25.23; 补水蒸发条件下, 氢氧同位素随着电导率的增加, 富集速率较慢, 在后期相对稳定, 同位素分馏程度小于持续蒸发, 蒸发线方程为 δD = 3.41δ18O – 28.2。
:
[1] 张光辉, 刘春华, 严明疆, 王金哲, 周在明. 环渤海平原土壤盐分不同聚形的的水动力学特征[J]. 吉林大学学报(地球科学版), 2012, 42(6): 1873–1879.Zhang Guang-hui, Liu Chun-hua, Yan Ming-jiang, Wang Jin-zhe, Zhou Zai-ming. Moisture dynamics characteristics of the soils profile of different salinity poly types in the Bohai Sea Plain [J]. J Jilin Univ (Earth Sci Ed), 2012, 42(6):1873–1879 (in Chinese with English abstract).
[2] 张宗祜, 施德鸿, 任福弘, 殷正宙, 孙继朝, 张翠云. 论华北平原第四系地下水系统之演化[J]. 中国科学(D辑), 1997,27(2): 168–173.Zhang Zonghu, Shi Dehong, Ren Fuhong, Yin Zhengzhou,Sun Jichao, Zhang Cuiyun. Evolution of Quaternary groundwater system in North China Plain [J]. Sci China (D), 1997,27(2): 168–173 (in Chinese with English abstract).
[3] 张人权, 梁杏, 靳孟贵. 末次盛冰期以来河北平原第四系地下水流系统的演变[J]. 地学前缘, 2013, 20(3): 217–226.Zhang Ren-quan, Liang Xing, Jin Meng-gui. The evolution of groundwater flow systems in the Quaternary of Hebei Plain [J].Earth Sci Front, 2013, 20(3): 217–226 (in Chinese with English abstract).
[4] Horita J, Wesolowski D J, Cole D R. The activity-composition relationship of oxygen and hydrogen isotopes in aqueous salt solution:Ⅰ. Vapor-liquid water equilibration of single salt solution from 50 to 100 ℃[J]. Geochim Cosmochim Acta,1993, 57 (12): 2797–2817.
[5] Horita J, Wesolowski D J. Liquid-vapor fractionation of oxygen and hydrogen isotopes of water from the freezing to the critical temperature [J]. Geochim Cosmochim Acta, 1994,58(16): 3425–3437.
[6] 赵文玉, 王启山, 吴国平, 吴立波, 孙增峰, 郑力燕. 引黄水在北大港水库蓄存期水质咸化的研究[J]. 水科学进展,2005, 16(6): 763–766.Zhao Wen-yu, Wang Qi-shan, Wu Guo-ping, Wu Li-bo, Sun Zeng-feng, Zheng Li-yan. Study on salinization of water channeled from Yellow River in Beidagang reservoir during the stored period [J]. Adv Water Sci, 2005, 16(6): 763–766 (in Chinese with English abstract).
[7] Gremillion P, Wanielista M. Effects of evaporative enrichment on the stable isotope hydrology of a central Florida(USA) river [J]. Hydrol Process, 2000, 14: 1465–1484.
[8] 李亚文, 韩蔚田. 南海海水 25 ℃等温蒸发实验研究[J]. 地质科学, 1995, 30(3): 233–239.Li Ya-wen, Han Wei-tian. Experimental study of 25 ℃ isothermal evaporation of sea water from the South China Sea [J].Sci Geol Sinica, 1995, 30(3): 233–239 (in Chinese with English abstract).
[9] Hu H Y, Bao W M, Wang T, Qu S M. Experimental study on stable isotopic fractionation of evaporating water under varying temperature [J]. Water Sci Eng, 2009, 2(2): 11–18.
[10] Zhang X P, Tian L, Liu J M. Fractionation mechanism of stable isotope in evaporating water body [J]. J Geogr Sci, 2005,15(3): 375–384.
[11] Cappa C D, Hendricks M B, DePaolo D J, Cohen R C. Isotopic fractionation of water during evaporation [J]. J Geophys Res, 2003, 108 (D16): 1–10, doi:10.1029/2003JD003597
[12] 包为民, 胡海英, 王涛, 瞿思敏. 蒸发皿中水面蒸发氢氧同位素分馏的实验研究[J]. 水科学进展, 2008, 19(6): 780–785.Bao Wei-min, Hu Hai-ying, Wang Tao, Qu Si-min. Experimental study on the fractionation mechanism of hydrogen and oxygen stable isotopes in evaporation from water surface of evaporation pans [J]. Adv Water Sci, 2008, 19( 6): 780–785(in Chinese with English abstract).
[13] 王永森, 马振民, 徐征和. 基于瑞利分馏模式的水体蒸发线斜率模型[J]. 水科学进展, 2011, 22(6): 795–800.Wang Yong-sen, Ma Zhen-min, Xu Zheng-he. Slope of evaporation lines in a model based on Rayleigh fractionation formula [J]. Adv Water Sci, 2011, 22(6): 795–800 (in Chinese with English abstract).
[14] 王君波, 朱立平, 鞠建廷, 汪勇. 西藏纳木错东部湖水及入湖河流水化学特征初步研究[J]. 地理科学, 2009, 29(2):288–293.Wang Jun-bo, Zhu Li-ping, Ju Jian-ting, Wang Yong. Water chemistry of Eastern Nam Lake Area and inflowing rivers in Tibet [J]. Sci Geogr Sinica, 2009, 29(2): 288–293 (in Chinese with English abstract).
[15] 王海雷, 郑绵平. 青藏高原湖泊水化学与盐度的相关性初步研究[J]. 地质学报, 2010, 84(10): 1517–1522.Wang Hai-lei, Zheng Mian-ping. Preliminary study of the correlation between hydrochemistry and salinity of lakes in the Qinghai-Tibetan Plateau [J]. Acta Geol Sinica, 2010,84(10): 1517–1522 (in Chinese with English abstract).
[16] 王恒纯. 同位素水文地质概论[M]. 北京: 地质出版社,1991: 1–191.Wang Heng-chun. Introduction to Isotope Hydrogeology [M].Beijing: Geological Publishing House, 1991: 1–191 (in Chinese)
[17] 周根陶, 郑永飞. 碳酸钙水体系氧同位素分馏系数的低温实验研究[J]. 地学前缘, 2000, 7(2): 321–338.Zhou Gen-tao, Zheng Yong-fei. Experimental studies of oxygen isotope fraction ions between CaCO3and H2O at low temperatures [J]. Earth Sci Front, 2000, 7(2): 321–338.
[18] 张继习, 刘耘. 稳定同位素分馏蒸汽压效应的计算方法[J].地球化学, 2014, 43(1): 1–10.Zhang Ji-xi, Liu Yun. Theoretical estimation of vapor pressure isotope effects [J]. Geochimica, 2014, 43(1): 1–10 (in Chinese with English abstract).
[19] Horita J. Saline waters [M]//Aggarwal P K, Gat J R, Froehlich F O. Isotopes in the Water Cycle. Vienna: IAEA, 2005:271–287.
[20] 顾慰祖, 庞忠和, 王全九, 宋献方. 同位素水文学[M]. 北京: 科学出版社, 2011: 53–80.Gu Wei-zu, Pang Zhong-he, Wang Quan-jiu, Song Xian-fang.Isotope Hydrology [M]. Beijing: Science Publishing House,2011: 53–80 (in Chinese).
