辽西下白垩统义县组单体烃碳同位素组成变化的物源及环境意义
2015-07-02宋之光曹新星
李 艳 , 宋之光, 曹新星, 王 丽
(1. 中国科学院 广州地球化学研究所 有机地球化学国家重点实验室, 广东 广州 510640; 2. 中国科学院大学, 北京100049)
0 引 言
早白垩世是地球气候环境剧烈变化的时期并伴随着大规模生物种群的变化, 是研究地球环境、生物演化的一个典型地质历史时期。中国东北地区是白垩纪陆相沉积地层发育的地区, 蕴含大量典型的古生物化石, 是研究早白垩世陆相古气候环境变化、生物演化的重要地区。自20世纪中叶以来, 古生物学家在辽西四合屯地区出露的早白垩世义县组地层中相继发现大量保存完好的古生物化石, 包括著名的早期鸟类化石“圣贤孔子鸟”、辽宁古果和小型兽脚类恐龙“原始中华龙鸟”等, 构成数量庞大的热河生物群[1–3]。同时, 该地区在早白垩世又经历频繁的火山活动影响, 形成了典型的火山-沉积地层[4]。因此, 四合屯地区的早白垩系地层被称之为白垩纪古生物化石和火山活动的博物馆[4–5], 受到国内外地质古生物学家的高度关注, 在古生物地层、区域火山地质学以及古气候环境方面已有非常深入的研究。前人所提供的植物学证据表明, 义县组沉积时期古气候环境整体上为适宜动植物大量生长的温暖湿润气候, 但可能由于受频繁、多期次火山活动影响, 存在明显的干旱、半干旱性的气候波动[6–7]。显然, 现有的这些研究为了解热河生物群繁盛时期的古气候环境提供了重要的沉积学、古生物学以及地层年代学依据。而详细的有机地球化学分析将为研究早白垩世火山活动对辽西热河生物群发育时期的古气候环境、碳循环机制的影响等提供分子水平科学依据。这也正是目前这一地区所缺乏的研究工作。
有机地球化学是研究地质体中有机质组成分布和来源演化的学科, 尤其是生物标志化合物作为地质历史时期记录保存生物体特征的分子化石, 在判别有机母质来源、重建古沉积环境方面有重要作用[8–9]。另一方面, 由于有机质来源以及后生演化的复杂性,仅根据生物标志化合物组成分布进行生源环境判识存在一定的不确定性。而单体烃类稳定碳同位素组成研究极大地提高了生物标志物在生源环境判识方面的准确性[10], 且在古气候环境重建方面具有重要意义。因此本文拟对辽西早白垩系义县组三段四合屯剖面沉积岩有机质丰度、生物标志物特征以及单体烃稳定碳同位素组成等进行分析, 旨在研究生物标志物及正构烷烃碳同位素组成所反映的有机质来源信息和古气候环境意义, 并探讨其与火山活动之间的关系。
1 样品地质背景与实验分析
1.1 样品地质背景
北票四合屯地区位于中生代环太平洋板块的边缘活动带, 经历了早白垩世时期强烈的构造-火山活动, 在盆地内沉积了巨厚的火山—沉积地层[11]。所研究的义县组地层代表早白垩世时期火山活动和沉积作用的产物, 自下而上依次可分为四段(表1), 即砂砾岩段、中—基性火山岩段、砂页岩段和橄榄玄武岩段, 其中义县组三段又名“尖山沟含化石沉积岩层”, 沉积于四合屯火山口湖的形成和发展期[12–13]。义县组三段主要是由泥岩、页岩、火山灰层和砂岩组成, 水平层理普遍发育, 其中大部分砂页岩中含火山灰、钙质结核。该层段含大量腹足类、双壳类、介形类、脊椎动物和植物化石, 其中大部分保存完好的恐龙、鸟类化石主要发掘于该层段中下部含火山灰的泥岩和页岩之中, 前人研究认为火山活动是造成该区生物集群死亡的主要原因[14–15]。

表1 义县组地层划分Table 1 Stratum division of the Yixian Formation
近年来众多地质学家应用放射性同位素测年法对四合屯地区义县组地层进行地质年龄测定, 特别是尖山沟含化石层段。Swisher et al.[16–17]先后对四合屯义县组三段(即尖山沟层)富含恐龙化石层的凝灰岩中的透长石和黑云母的激光 Ar-Ar定年结果分别为(124.6±0.1) Ma、(124.6±0.25) Ma和(125.0±0.1) Ma,与王松山等[18]和Yang et al.[19]对相同层位的U/Pb测年结果接近(分别为(125.2±0.9) Ma 和(124.7±2.7) Ma)。此外, Zhu et al.[20]对义县组三段湖相沉积底部和顶部相邻火山岩的Ar-Ar定年结果分别为(125.7±2.6) Ma和(124.2±2.5) Ma, 通过与古地磁证据相结合, 认为义县组三段湖相沉积的地层应形成于 124.7~124.0 Ma之间。据国际地层年代表, 义县组三段(尖山沟层)应主要为晚巴雷母阶—早阿普第阶。
本文所分析的 14个沉积岩样品均采自义县组三段四合屯剖面。样品采集地点(图1)位于辽宁省北票四合屯西部、中国四合屯古生物化石展览馆西侧人工开挖的露头剖面, 该剖面高约6 m(图2和表2)。样品采集时先剥除表层风化面, 再取风化程度低的新鲜样品。样品以灰色、灰黑色泥岩和页岩为主, 夹多层浅黄、黄褐色薄层火山灰层, 水平纹理发育, 亦可见波痕, 富含丰富的生物化石。粉砂岩与泥页岩交替发育, 其中富含生物化石的层位颜色较深呈深灰或黑色。
1.2 实验分析方法
野外露头采集的块状样品用乙醇清洗表面(以去除可能的人为污染)后, 粉碎至100目备用。用于总有机碳(TOC)分析的粉末样品先用5 mol/L盐酸溶液进行酸解处理(12 h, 80 ℃), 以去除碳酸盐矿物中的无机碳; 随后用去离子水清洗至少 3遍, 以除去氯化钙, 并置于烘箱中干燥(12 h, 80 ℃)。TOC分析所使用的仪器为LECO公司生产的 C320碳元素分析仪。

图1 义县组四合屯剖面采样位置图Fig.1 Map showing the location of the Sihetun profile of Yixian Formation
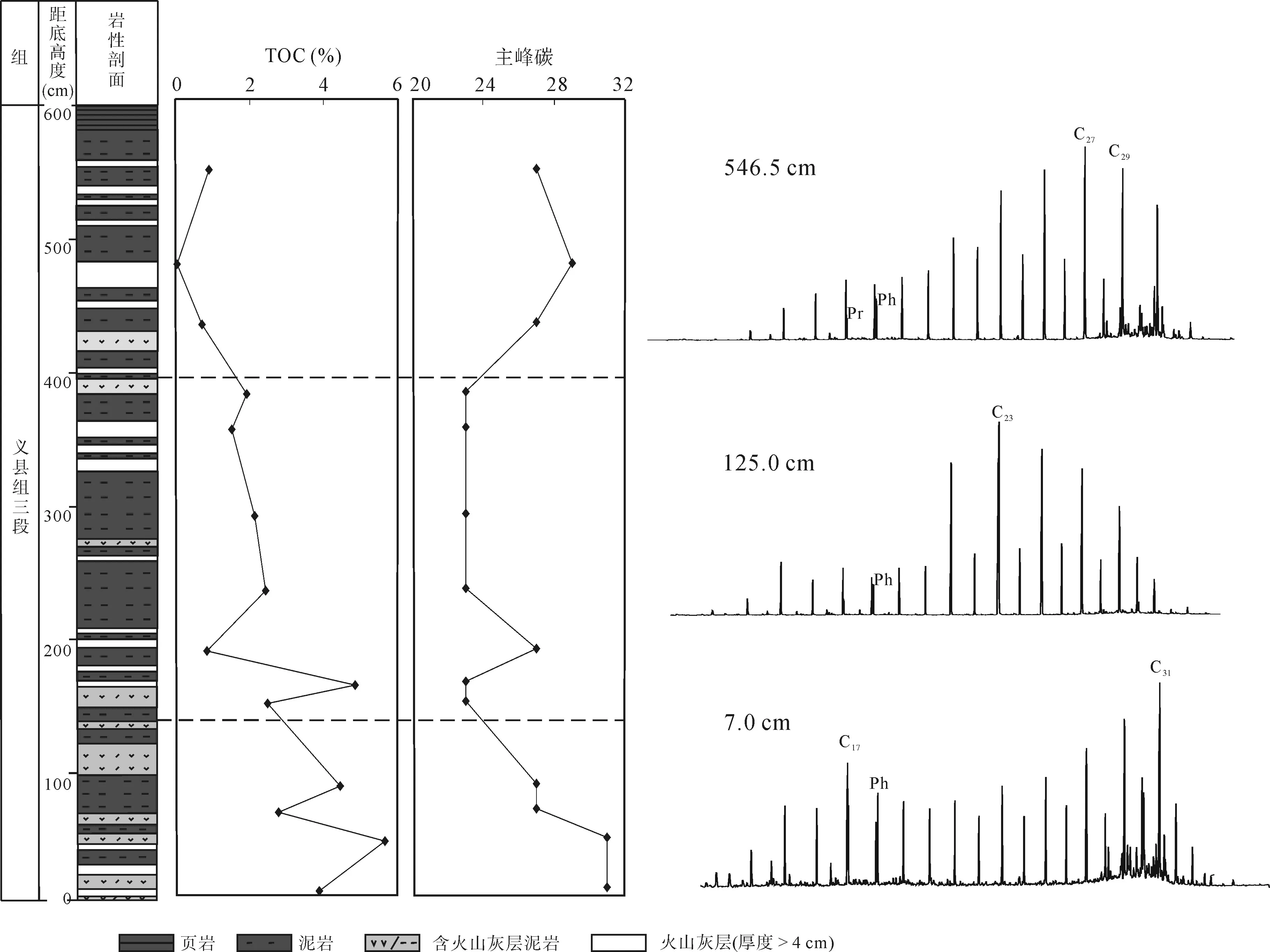
图2 饱和烃质量色谱图与TOC含量和主峰碳数剖面变化Fig.2 The profile variation in TOC content, peak carbon number of n-alkanes and mass chromatograms of aliphatic hydrocarbons

表2 样品基本地质信息Table 2 Geological information of the samples from Yixian Formation of the Sihetun profile
可溶有机质的萃取使用索氏抽提法, 即称取适量粉末样品进行72 h索氏萃取, 并在萃取时加入适量经活化处理的铜片以脱除可能萃取出来的元素硫。萃取所获得的可溶有机质经定容恒重后用正己烷沉淀分离沥青质; 去除沥青质后的可溶烃类定容恒重后进行柱色谱分离, 分别得到饱和烃、芳烃和非烃馏分, 并分别进行定容恒重。所有饱和烃馏分分别进行气相色谱、色谱-质谱分析。再选取样品的饱和烃馏分进行尿素络合, 以分离出正构烷烃与支链环烷烃。方法如下: 将1 mL饱和烃馏分溶于3 mL正己烷/丙醇(体积比为 2∶1)溶液中, 再将该溶液边摇晃边滴入4 mL甲醇尿素饱和溶液中, 静置过夜使正构烷烃充分络合; 然后用氮气吹干, 吹干后加入5 mL的正己烷, 充分洗涤沉淀物质, 然后离心取出上清液, 重复此步骤 3次; 然后加入去离子水溶解尿素络合物, 并用二氯甲烷从分离的上清液中萃取正构烷烃。
色谱-质谱(GC-MS)分析使用 HP6890色谱与PlatformⅡ质谱联用仪, 其中色谱分离柱为 JW-DB-5型30 m×0.25 mm×0.25 μm硅熔毛细柱, 样品采用无分流进样法, 汽化室温度为 290 ℃ , 色谱柱箱初始温度为80 ℃ , 5 min后以3 ℃ /m in 升至290 ℃ , 并保持 10 min, 氮气为载气。质谱仪器的离子源为电子轰击源(70 eV), 扫描范围50~550 u。
分离提纯的正构烷烃的单烃碳同位素分析均使用英国GV公司的Isoprime色谱-同位素质谱仪, 所用分离柱为JW-DB-5型 30 m×0.25 mm×0.25 μm硅熔毛细柱; 采用无分流进样法, 进样室温度为280 ℃ ,氦气为载气。色谱柱箱初始温度为80 ℃, 2 min后以20 ℃ /m in 升至130 ℃ , 以3 ℃ /m in 升至290 ℃并恒温10 min。质谱扫描范围为50~600 u。使用标准样品(PDB)校正, 每个样品重复进样2~3次, 测定误差小于0.5‰。
2 结果与讨论
2.1 有机碳含量(TOC)
表2和图2列示了所分析样品的有机碳含量等信息。该剖面有机碳含量(TOC)介于0.05%~5.65%之间, 变化较大, 显现出阶段性变化的特征。剖面中上部(161.5 cm以上)为有机碳含量的低值段, TOC在0.05%~2.43%之间, 平均为1.33%; 下部(161.5 cm以下)富化石层段为有机碳含量的高值段, TOC在2.50%~5.65%之间, 平均为4.02%。从剖面变化来看,有机碳含量主要受有机质输入的影响, 剖面下部含大量热河生物群化石的层位是有机质相对富集的层段。
可溶有机质族组成与其热演化程度有关。大多数样品的可溶有机质族组成丰度表现为芳烃 ≤ 饱和烃 < 非烃, 总体上反映出非烃含量高、沥青质含量低的特点, 显示有机质处于未成熟—低成熟阶段。这与其样品 tmax低于 435 ℃相对应[21], 说明义县组三段沉积有机质热演化程度较低。
2.2 饱和烃组成分布特征
不同母质来源的有机质正构烷烃化合物组成分布及碳同位素组成等存在显著差异。一般来说, 碳数小于 C21的正构烷烃主要来自能够进行光合作用的低等藻类和细菌[22], 而具有奇碳优势的高碳数正构烷烃如 nC27、nC29、nC31主要来源于高等植物输入[8]。义县组饱和烃色谱图显示, 正构烷烃的碳数分布范围基本都在nC13~nC34之间, 但主峰碳数及分布模式方面存在明显变化(图2和表3)。正构烷烃的组成分布在剖面上呈阶段性变化特征: 下部(125.0 cm以下)以双峰后峰群优势型分布模式为主, 后峰群大多以 nC27(或 nC29、nC31)为主峰碳、前峰群以 nC17或 nC15为主峰碳; 中部(125.0~379.5 cm)主要是以nC23为主峰的单峰群分布, 仅个别样品(如Ky-15)呈以 nC27为主峰的后峰型分布; 上部(379.5 cm以上)分布模式与下部相似, 主要为双峰后峰群优势型和单峰后峰群优势型分布。正构烷烃主峰碳数的这种规律性变化可能反映了义县组三段沉积时期古气候条件由温湿气候逐渐向干旱气候转变再回归温湿气候的特征[23]。高碳数后峰群优势型分布指示有机质来源以高等植物输入为主, 低碳数前峰型分布则表明以低等菌藻类和水生植物来源为主。值得指出的是, 以nC23为主峰碳的分布模式通常见于半咸水-咸水沉积环境中[24], 且高丰度的nC23很可能与某种特殊藻类的繁盛有关[25]。剖面上高碳数正构烷烃普遍具有较明显的奇碳优势(图2), CPI值均大于1(表3),显示有机质主要来源于高等植物且处于未成熟—低成熟阶段。大部分样品高碳数正构烷烃常伴随着UCM 小鼓包(图 2), 但完整的正构烷烃分布指示沉积有机质可能普遍受到轻微的细菌改造作用[26]。
正构烷烃的组成分布在母源判识方面具有重要的意义, 而其碳同位素组成能够为有机质来源提供更为准确的信息。图3展示了正构烷烃的碳同位素组成及随碳数的变化特征。该图表显示正构烷烃的碳同位素组成在–38.6‰~ –26.0‰之间, 变化较大,指示有机来源较为多样。在剖面上正构烷烃的碳同位素组成随碳数的变化分布特征明显不同, 可大致划分为上中下三个部分(图3)。剖面下部为正构烷烃碳同位素组成显著负偏的层段, 在–38.6‰~ –31.0‰之间, 变化较平缓, 高碳数部分见微弱的锯齿状分布特征。剖面中部层段正构烷烃的碳同位素组成明显变重, 在–38.0‰~ –29.0‰之间, 其分布曲线呈平缓的“V”字形。剖面上部层段中正构烷烃碳同位素组成显著变重、样品间以及不同碳数间差异变大, 其碳同位素组成介于–36.4‰~ –26.0‰之间, 高碳数正构烷烃的碳同位素组成远高于中低碳数正构烷烃。不同碳数正构烷烃碳同位素组成的规律性变化特征表明它们可能具有不同来源有机质输入或者同一来源但具有不同碳同位素分馏机制。
姥/植比值(Pr/Ph)常用于指示沉积时的氧化还原条件和有机母质来源特征[27]。因受母源输入、成熟度等影响, 一般认为该比值在大于 3.0时指示氧化条件下陆源有机质输入为主的特点, 而小于 0.8时则反映典型的还原条件, 通常是高盐或碳酸盐岩沉积环境[26]。在饱和烃总离子流图上(图2), 无环类异戊二烯烃仅见姥鲛烷(Pr)和植烷(Ph), 二者相对丰度较高, 且植烷优势明显(图2和表3)。研究区Pr/Ph比值变化不大, 介于 0.39~0.71之间(表 3), 均小于0.8, 反映了整体缺氧的沉积环境[26], 表明沉积有机质保存较好。这与前人在该剖面地层岩中发现铁质斑点[23], 以及保存完好的叠片结构[13]所指示的强还原环境一致。
2.3 生物标志物分布特征

表3 饱和烃及生物标志物比值参数表Table 3 The parameters of saturate hydrocarbons and biomarker compounds
甾萜类化合物是指示生物来源的重要标志化合物[28]。藿烷化合物多来源于细菌类输入, 其组成分布在研究剖面上基本相似, 只是相对丰度高低存在差异。在m/z 191质量色谱图上, 以五环三萜类化合物为主(图 4)。17α(H), 21β(H)藿烷系列碳数分布范围为 C27~C31(C28除外), 并以 17α(H), 21β(H)C30藿烷相对丰度最高, 且普遍检出稳定性较低的生物型17β(H), 21β(H)C30~C31藿烷。高丰度的藿烷类化合物表明, 细菌对沉积有机质具有重要贡献。

图3 正构烷烃碳同位素组成随碳数变化曲线Fig.3 The profile distribution of carbon isotopic compositions of n-alkanes with respect to carbon number
藿烷除具有生源指示意义之外, 一些藿烷化合物的相对丰度比值还是重要的成熟度指标。如表 3所示, 18α(H)-22, 29, 30- 三降藿烷(Ts)和 17α(H)-22,29, 30- 三降藿烷(Tm) 的相对比值Ts/(Ts+Tm)比值介于 0.28~0.5之间, C30莫烷/藿烷比值在 0.06~0.42之间以及升藿烷 22S/(22S+22R)比值介于 0.29~0.47之间等都指示有机质经历热演化程度低, 表明义县组三段沉积有机质基本处于未成熟至低成熟阶段,尽管个别样品可能是受母质来源或沉积环境影响成熟度指标略微偏高, 但综合来看总体上显示了正常沉积有机质的埋藏演化特征。此外, 稳定性较低的生物构型 17β(H), 21β(H)C30~C31藿烷的检出亦指示样品成熟度低。
在剖面上所有样品中都检测到伽马蜡烷(图 4),伽马蜡烷比值(Ga/αβC30Hop)在 0.04~0.42 之间, 呈高低值交替变化(表3)。伽马蜡烷是一种典型的非藿烷五环三萜类化合物, 多发现于高盐的沉积环境中,因此高丰度伽马蜡烷常指示有机质沉积时的强还原性超盐度环境[29]。剖面上3个层段的伽马蜡烷比值(Ga/αβC30Hop)非常接近, 平均在 0.20左右, 表明剖面上下沉积环境总体上相对稳定。伽马蜡烷的检出以及低的姥植比指示了强还原性沉积环境、以及可能的水体盐度分层。
甾类化合物的组成分布在大部分样品中都比较相似(图4)。在m/z 217质量色谱图上以规则甾烷为主, 但仅剖面中上部样品中有较低丰度的重排甾烷检出。Sieskind et al.[30]的模拟实验表明, 某些黏土矿物(如高岭石和蒙脱石)能够促进重排甾烷的转化。剖面上重排甾烷的异常分布, 可能是样品中黏土矿物组成的差异所致。规则甾烷以 5α(H), 14α(H),17α(H)C29甾烷为主, 可占规则甾烷总丰度的53%~82%(表3); C28或C27同系物丰度相对较低, 呈
不对称“V”字形或反“L”形分布(图4)。大多数样品中C304-甲基甾烷缺失, 仅在剖面上部有较高丰度检出。前人研究认为 4-甲基甾烷主要来自菌藻类, 而常规的C304-甲基甾烷多见于淡水沉积岩中。甾烷类化合物中 C27、C28和 C29规则甾烷的相对比例常用于确定特定环境的生源输入。其中 C27规则甾烷主要是陆生藻类来源, C28规则甾烷则主要来源于海相藻类, C29规则甾烷普遍认为来自陆相高等植物[26]。因此, 剖面上规则甾烷的“V”字型或反“L”型分布主要反映了水生藻类、陆源植物混合输入的特点。
甾烷也是重要的成熟度指标。样品中 C29甾烷的 ββ/(αα+ββ)和 20S/(20S+20R)均小于 0.2(样品Ky-30除外), 指示低成熟度, 与藿烷类成熟度指标所指示的成熟度一致(表3)。

图4 藿烷和甾烷化合物组成分布质谱图Fig.4 Mass chromatograms of m/z 191 and 217 showing the composition and distribution of hopanes and steranes
2.4 单烃碳同位素组成及物源环境意义
单烃分子碳同位素组成, 特别是来源于高等植物叶蜡中的各种烷烃(nC27、nC29、nC31)的单体烃碳同位素, 是反映陆地植物类型和大气 CO2碳同位素组成变化的重要指标。植被类型的转变可导致有机化合物碳同位素组成显著偏移, 如植被类型由C3植物过渡为以C4植物为主, 能够使分子化合物碳同位素组成正偏约 10‰。然而, 正构烷烃的碳同位素组成分析显示(图 3和表 4), 指示高等植物叶蜡来源nC29和 nC31正构烷烃的碳同位素组成范围在–36.2‰~ –27.7‰之间, 属于 C3植物来源有机质碳同位素组成范围[31]。从剖面变化来看, 剖面上不同碳数正构烷烃碳同位素组成的变化趋势大体相同(图5), 正构烷烃的碳同位素组成在剖面底部极为偏轻, 低至–38.6‰; 而向上至中部则呈逐渐正偏趋势,并在352.5 cm处达最大正偏值(–26‰); 但该正偏之后, 正构烷烃的碳同位素组成转而负偏, 低至–36.4‰。因此, 正构烷烃碳同位素组成的偏移应主要反映了大气CO2碳同位素组成的变化。δ13C(nC31) (‰) δ13C(CO2) (‰)–33.8 –7.0–28.7 –3.3–28.2 –3.0–29.5 –4.5–33.2 –7.2–32.4 –7.4–32.4 –7.3–32.1 –7.5–34.1 –8.6–35.3 –9.9
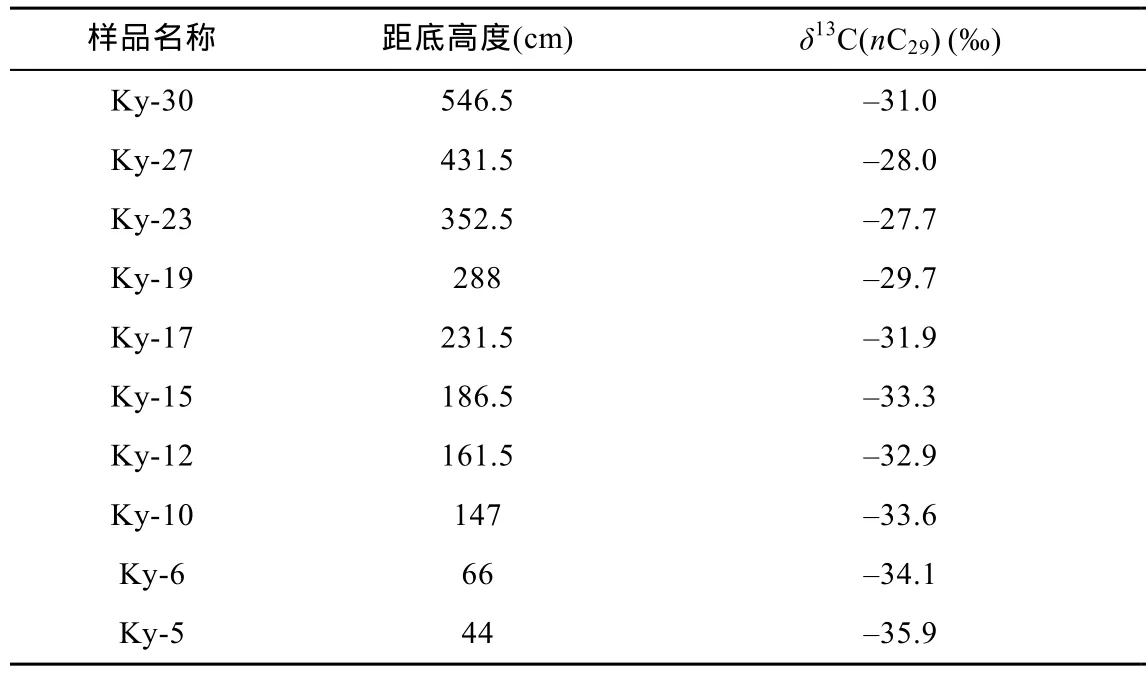
表4 根据正构烷烃化合物碳同位素组成计算的义县组沉积时期大气CO2碳同位素组成Table 4 Reconstructed δ13C values of atmospheric CO2 during the sedimentary period of Yixian Formation based on the δ13C of n-alkane compounds
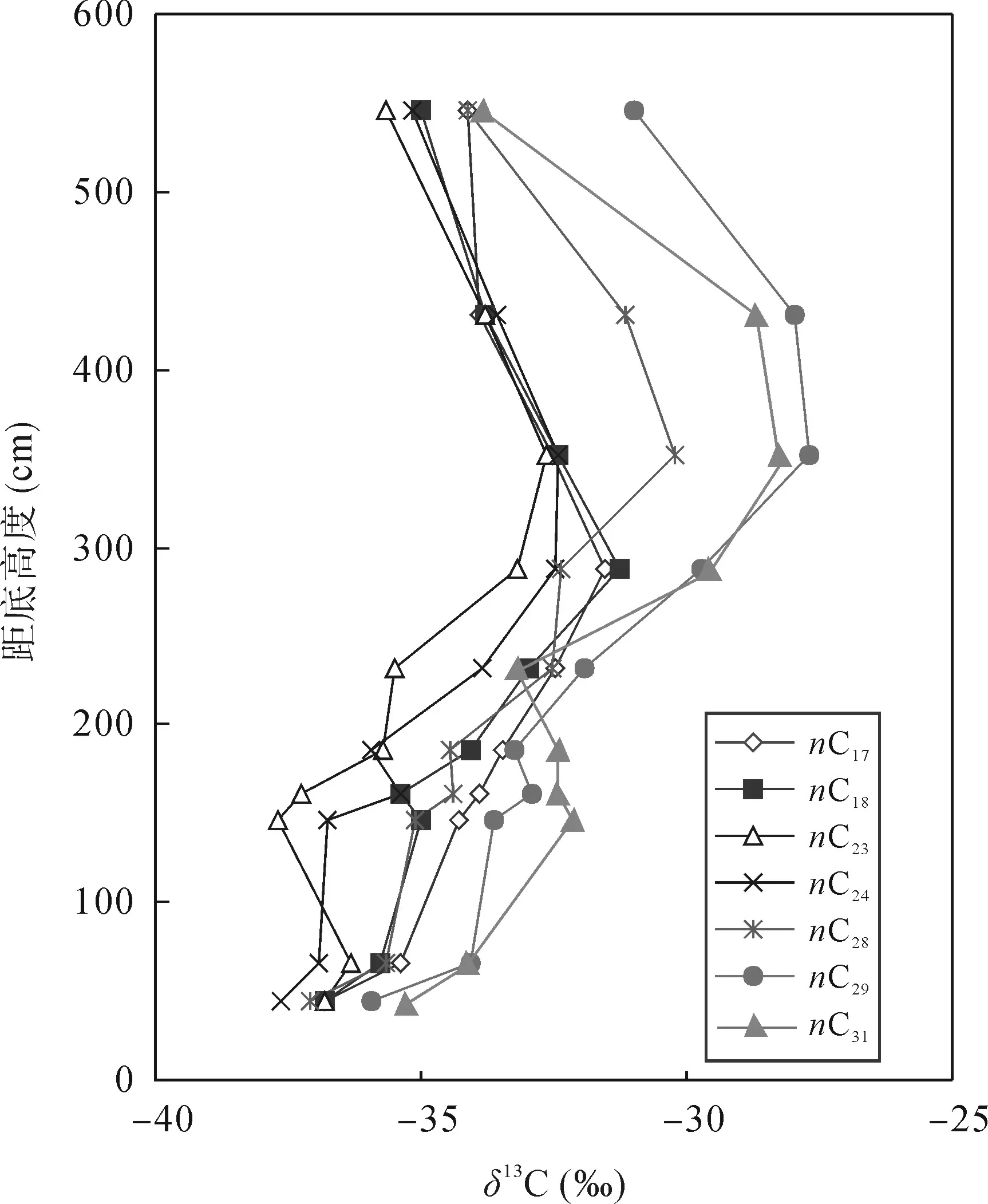
图5 正构烷烃碳同位素组成剖面变化图Fig.5 Profile variation in carbon isotopic composition of individual n-alkanes
前人研究发现高等植物叶蜡来源烷烃(nC29和nC31)的碳同位素组成能够直接反映古大气CO2碳同位素组成的变化。Arens et al.[32]通过对176种C3植物进行稳定碳同位素组成分析后, 首次提出重建古大气CO2碳同位素组成的关系式, 即: δ13Catmosphere=(δ13Cplant+ 18.67)/1.10。该关系式广泛应用于现代大气和古大气 CO2碳同位素组成重建[32–33]。然而, 过去的研究主要是利用以高等植物来源为主的沉积有机质的总碳同位素组成来重建古大气CO2碳同位素组成, 而高等植物有机质输入不占优势的沉积有机质则不能作为研究的载体, 这在一定程度上限制了其应用。由于所研究的地层为陆相地层, 陆源有
机质输入明显, 高碳数正构烷烃nC29和nC31主要来自植物叶蜡, 其来源单一且明确。因此, 单体烃碳同位素组成代替总有机碳同位素用于重建古大气CO2碳同位素组成可能更加灵敏。Collister et al.[31]研究发现来自C3植物叶蜡的长链正构烷烃通常较其植物母质的碳同位素组成负偏约6‰。因此, 本文分别应用nC29和nC31碳同位素组成代替总有机质碳同位素组成, 并加上6‰的自修正值。因此该关系式可修正为: δ13Catmosphere= (δ13C(nC29~31) +24.67)/1.10。如表 4所示, 根据修正的 Arens et al.[32]重建古大气CO2碳同位素组成计算公式, 该区义县组三段沉积时期, 大气CO2碳同位素组成在–10‰~ –3‰之间波动, 这与Jahren et al.[33]所重建的早白垩世时期大气CO2碳同位素组成的范围非常相近。在剖面下部, 大气CO2碳同位素组成明显偏负, 约为–10‰; 向上至中部350 cm范围内, 大气CO2碳同位素组成逐渐正偏至–3‰; 但在该正偏之后, 大气 CO2碳同位素组成转而负偏至–7‰。Huang et al.[34]根据四合屯地区义县组三段底部碳酸盐岩样品重建了大气CO2浓度,尽管样品数量较少, 其结果亦表明早白垩世时期大气CO2浓度存在显著波动。大气CO2碳同位素组成的显著偏移表明, 早白垩世义县组沉积时期有大量温室气体加入到大气中来。尽管影响大气CO2碳同位素组成的因素很多且普遍存在争论, 但火山活动释出大量CO2被认为是造成大气CO2碳同位素组成明显偏移的主要原因。从全球性范围来看, 早白垩世洋壳生长速率较大、LIPs反映出火山活动较为频繁,是大气CO2浓度、古气温、海平面升高的重要时期[35]。从区域性范围来看, 辽西义县组三段沉积时期存在火山侵入体以及大量火山灰沉积, 且辽西及邻区火山活动十分强烈, 具多期次、多旋回的喷发特征。前人研究业已表明, 大规模火山活动喷出的火山气体、火山灰等可造成大范围的气候与环境突变[15]。因此, 我们认为大气 CO2碳同位素组成向上的快速偏移主要与当时该区大规模的火山喷发活动有关,并反映到沉积有机质中叶蜡烷烃碳同位素组成上来。很显然, 频繁的火山喷发活动是导致大量动植物的集群死亡, 并造成大量热河生物群化石堆积的原因。义县组三段沉积时期, 大气 CO2碳同位素组成的显著波动变化(-10‰~-3‰)表明在早白垩世全球性温室气候的大背景下, 区域性陆地气候环境存在明显的波动。
3 总结与结论
通过对辽西四合屯义县组三段剖面进行系统的有机地球化学研究分析, 取得了以下认识和结论。
(1) 正构烷烃组成与分布及其稳定碳同位素组成在剖面上具有明显阶段性特征, 表明有机质来源、古气候环境条件以及有机碳循环等具有相应的阶段性变化。饱和烃的组成分布特征显示剖面下部和上部有机母质以高等植物来源为主, 中部有机母质继而转为以水生植物为主。
(2) 甾烷和萜烷等生物标志化合物的组成分布显示沉积有机质处于未成熟至低成熟阶段; 伽马蜡烷的普遍检出以及低的姥植比值(Pr/Ph < 0.8)表明当时沉积环境为强还原且具一定盐度分层的水体,沉积有机质保存较好。
(3) 剖面上正构烷烃碳同位素组成自下而上逐渐呈正偏的趋势, 表明大气 CO2碳同位素组成波动显著。根据高等植物叶蜡烷烃碳同位素组成重建的古大气CO2碳同位素组成在–10‰~ –3‰之间, 自下而上呈逐渐正偏后又回归的特点, 反映了频繁的火山喷发活动造成大气CO2浓度变化及其碳同位素组成的偏移效应。
:
[1] Hou L H. A carinate bird from the Upper Jurassic of western Liaoning, China [J]. Chinese Sci Bull, 1997, 42(5): 413–417.
[2] Ji Q, Currie P J, Norell M A, Ji S A. Two feathered dinosaurs from northeastern China [J]. Nature, 1998, 393(6687):753–761.
[3] Zhou Z H, Barrett P M, Hilton J. An exceptionally preserved Lower Cretaceous ecosystem [J]. Nature, 2003, 421(6925):807–814.
[4] Jiang B Y, Fürsich F T, Sha J G, Wang B, Niu Y Z. Early Cretaceous volcanism and its impact on fossil preservation in Western Liaoning, NE China [J]. Palaeogeogr Palaeoclimatol Palaeoecol, 2011, 302(3): 255–269.
[5] Fürsich F T, Sha J G, Jiang B Y, Pan Y H. High resolution palaeoecological and taphonomic analysis of Early Cretaceous lake biota, western Liaoning (NE-China) [J]. Palaeogeogr Palaeoclimatol Palaeoecol, 2007, 253(3): 434–457.
[6] 丁秋红, 张立东, 郭胜哲, 张长捷, 彭艳东, 贾斌, 陈树旺,邢得和. 辽西北票地区义县组古气候环境标志及其意义[J].地质通报, 2003, 22(3): 186–191.Ding Qiu-hong, Zhang Li-dong, Guo Sheng-zhe, Zhang Chang-jie, Peng Yan-dong, Jia Bin, Chen Shu-wang, Xing De-he. Paleoclimatic and palaeoenvironmental proxies of the Yixian Formation in the Beipiao area, western Liaoning [J].Geol Bull China, 2003, 22(3): 186–191 (in Chinese with English abstract).
[7] 郑少林, 郑月娟, 邢德和. 辽西晚侏罗世义县期植物群性质, 时代及气候[J]. 地层学杂志, 2003, 27(3): 233–241.Zheng Shao-lin, Zheng Yue-juan, Xing De-he. Characteristics,age and climate of Late Jurassic Yixian flora from western Liaoning [J]. J Stratigr, 2003, 27(3): 233–241 (in Chinese with English abstract).
[8] Eglinton G, Hamilton R J. Leaf epicuticular waxes [J]. Science, 1967, 156(3780): 1322–1335.
[9] Ten Haven H L, De Leeuw J W, Damsté J S S, Schenck P A,Palmer S E, Zumberge J E. Application of biological markers in the recognition of palaeohypersaline environments [J]. Geol Soc London Spec Publ, 1988, 40(1): 123–130.
[10] Freeman K H, Hayes J M, Trendel J M, Albrecht P. Evidence from carbon isotope measurements for diverse origins of sedimentary hydrocarbons [J]. Nature, 1990, 343(6255):254–256.
[11] Ren J Y, Tamaki K, Li S T, Zhang J X. Late Mesozoic and Cenozoic rifting and its dynamic setting in Eastern China and adjacent areas [J]. Tectonophysics, 2002, 344(3): 175–205.
[12] Jiang B Y, Sha J G. Preliminary analysis of the depositional environments of the Lower Cretaceous Yixian Formation in the Sihetun area, western Liaoning, China [J]. Cretac Res,2007, 28(2): 183–193.
[13] Zhang X L, Sha J G. Sedimentary laminations in the lacustrine Jianshangou Bed of the Yixian Formation at Sihetun, western Liaoning, China [J]. Cretac Res, 2012, 36: 96–105.
[14] 郭正府, 汪筱林. 火山活动与辽西四合屯脊椎动物集群死亡关系的初步研究[J]. 岩石学报, 2002, 18(1): 117–125.Guo Zheng-fu, Wang Xiao-lin. A study on the relationship between volcanic activities and mass mortalities of the Jehol vertebrate Fauna from Sihetun, western Liaoning, China [J].Acta Petrol Sinica, 2002, 18(1): 117–125 (in Chinese with English abstract).
[15] 张立军, 巩恩普. 辽宁北票四合屯地区早白垩世早期鸟类集群死亡原因探析[J]. 地质论评, 2003, 49(4): 347–354.Zhang Li-jun, Gong En-pu. Discussion and analysis on the cause of bird mass mortality in the Sihetun area of Beipiao,Liaoning, in the early Early Cretaceous [J]. Geol Rev, 2003,49(4): 347–354 (in Chinese with English abstract).
[16] Swisher C C, Wang Y Q, Wang X L, Xu X, Wang Y. Cretaceous age for the feathered dinosaurs of Liaoning, China [J].Nature, 1999, 400(6739): 58–61.
[17] Swisher C C, Wang X L, Zhou Z H, Wang Y Q, Jin F, Zhang J Y, Xu X, Zhang F C, Wang Y. Further support for a Cretaceous age for the feathered-dinosaur beds of Liaoning, China:New40Ar/39Ar dating of the Yixian and Tuchengzi Formations [J].Chinese Sci Bull, 2002, 47(2): 136–139.
[18] 王松山, 胡华光, 李佩贤, 王元青. 再论辽西四合屯脊椎动物生存时代: Ar-Ar 年龄证据[J]. 岩石学报, 2001, 17(4): 663–668.Wang Song-shan, Hu Hua-guang, Li Pei-xian, Wang Yuan-qing. Further discussion on the geologic age of Sihetun vertebrate assemblage in western Liaoning, China: Evidence from Ar-Ar dating [J]. Acta Petrol Sinica, 2001, 17(4):663–668 (in Chinese with English abstract).
[19] Yang W, Li S G, Jiang B Y. New evidence for Cretaceous age of the feathered dinosaurs of Liaoning: zircon U-Pb SHRIMP dating of the Yixian Formation in Sihetun, northeast China [J].Cretac Res, 2007, 28(2): 177–182.
[20] Zhu R X, Pan Y X, Shi R P, Liu Q S, Li D M. Palaeomagnetic and40Ar/39Ar dating constraints on the age of the Jehol Biota and the duration of deposition of the Sihetun fossil-bearing lake sediments, northeast China [J]. Cretac Res, 2007, 28(2): 171–176.
[21] 李洪涛, 宋之光, 邹艳荣, 王成善, 季强. 冀北-辽西早白垩世沉积有机质特征与古气候环境演变[J]. 地质学报,2008, 82(1): 72–76.Li Hong-tao, Song Zhi-guang, Zou Yan-rong, Wang Cheng-shan, Ji Qiang. Characteristics of sedimentary organic matter and paleoclimate and environmental evolution during Early Cretaceous time in Northern Part of Hebei and Western of Liaoning Provinces [J]. Acta Geol Sinica, 2008, 82(1):72–76 (in Chinese with English abstract).
[22] Gelpi E, Schneider H, Mann J, Oro J. Hydrocarbons of geochemical significance in microscopic algae [J]. Phytochemistry, 1970, 9(3): 603–612.
[23] Jiang B Y, Fürsich F T, Hethke M. Depositional evolution of the Early Cretaceous Sihetun Lake and implications for regional climatic and volcanic history in western Liaoning, NE China [J]. Sediment Geol, 2012, 257: 31–44.
[24] Bechtel A, Gawlick H J, Gratzer R, Tomaselli M, Püttmann W.Molecular indicators of palaeosalinity and depositional environment of small scale basins within carbonate platforms: The Late Triassic Hauptdolomite Wiestalstausee section near Hallein (Northern Calcareous Alps, Austria) [J]. Org Geochem,2007, 38(1): 92–111.
[25] Van Kaam-Peters H M E, Schouten S, De Leeuw J W, Damsté J S S. A molecular and carbon isotope biogeochemical study of biomarkers and kerogen pyrolysates of the Kimmeridge Clay Facies: Palaeoenvironmental implications [J]. Org Geochem, 1997, 27 (7): 399–422.
[26] Peters K E, Walters C C, Moldowan J M. The Biomarker Guide [M]. Cambridge: Cambridge University Press, 2005.
[27] Didyk B M, Simoneit B R T, Brassell S C, Eglinton G. Organic geochemical indicators of palaeoenvironmental conditions of sedimentation [J]. Nature, 1978, 272(5650): 216–222.
[28] Ourisson G, Albrecht P, Rohmer M. The hopanoids: palaeochemistry and biochemistry of a group of natural products [J].Pure Appl Chem, 1979, 51(4): 709–729.
[29] Moldowan J M, Seifert W K, Gallegos E J. Relationship between petroleum composition and depositional environment of petroleum source rocks [J]. AAPG Bulletin, 1985, 69(8):1255–1268.
[30] Sieskind O, Joly G, Albrecht P. Simulation of the geochemical transformations of sterols: Superacid effect of clay minerals [J].Geochim Cosmochim Acta, 1979, 43(10): 1675–1679.
[31] Collister J W, Rieley G, Stern B, Eglinton G, Fry B. Compound-specific δ13C analyses of leaf lipids from plants with differing carbon dioxide metabolisms [J]. Org Geochem, 1994,21(6): 619–627.
[32] Arens N C, Jahren A H, Amundson R. Can C3plants faithfully record the carbon isotopic composition of atmospheric carbon dioxide? [J]. Paleobiology, 2000, 26(1): 137–164.
[33] Jahren A H, Arens N C, Sarmiento G, Guerrero J, Amundson R.Terrestrial record of methane hydrate dissociation in the Early Cretaceous [J]. Geology, 2001, 29(2): 159–162.
[34] Huang C M, Retallack G J, Wang C S. Early Cretaceous atmospheric pCO2levels recorded from pedogenic carbonates in China [J]. Cretac Res, 2012, 33(1): 42–49.
[35] 邹艳荣, 彭平安, 宋之光, 王成善. 白垩纪缺氧事件期间分子有机碳同位素偏移的二种不同机制[J]. 地质学报, 2008,82(1): 31–36.Zou Yan-rong, Peng Ping-an, Song Zhi-guang, Wang Cheng-shan. The mechanism of stable carbon isotope excursion of the individual normal-alkane during the Cretaceous Oceanic Anoxic Event [J]. Acta Geol Sinica, 2008, 82(1),31–36 (in Chinese with English abstract).
