格列齐特脂质体的制备及质量评价
2015-07-02刘力铭王洪光
刘力铭,王洪光
(青岛科技大学化工学院,山东青岛 266042)
格列齐特脂质体的制备及质量评价
刘力铭,王洪光
(青岛科技大学化工学院,山东青岛 266042)
采用薄膜分散法制备格列齐特脂质体,以粒径和包封率为考核指标,通过单因素实验和正交实验优化制备条件,测定最优条件制备格列齐特脂质体的平均粒径和包封率。确定最优制备条件为:药脂比1∶10(g∶g)、超声时间10min、成膜温度60℃、缓冲液pH值6。所制备脂质体的平均粒径为(108.3±12.4)nm、包封率为(72.19±3.6)%、平均Zeta电位为(-40.8±2.3)mV,且在4℃下保存稳定性好。电镜照片显示,所制备脂质体圆整度好、粒径均一、无粘连。表明采用薄膜分散法制备格列齐特脂质体工艺稳定,质量可控。
格列齐特;脂质体;薄膜分散法;包封率
格列齐特(gliclazide),又名达美康,主要用于成年后发病单用饮食控制无效的,且无酮症倾向的轻、中型糖尿病[1];能改善糖尿病人眼底病变以及代谢、血管功能的紊乱;可与双胍类口服降血糖药合用于单用不能控制的糖尿病患者,与胰岛素合用治疗胰岛素依赖型糖尿病,可减少胰岛素用量。近年来,人们开始研究脂质体作载体来降低药物毒性,提高药物的组织相容性、细胞亲和性、靶向性和缓释性[2]。目前,国内已有格列齐特缓释片和缓释胶囊出售,尚无格列齐特注射液问世。由于格列齐特缓释片存在单次给药量大,若出现呕吐、血小板减少、贫血等不良反应时不能及时停药等缺点,因此,作者尝试制备格列齐特脂质体以降低其毒性。
作者选用大豆卵磷脂和胆固醇为膜材,采用薄膜分散法制备格列齐特脂质体。以平均粒径和包封率为考核指标,优化了脂质体的制备工艺,为进一步生产格列齐特注射液提供理论依据。
1 实验
1.1 试剂与仪器
格列齐特(含量99%),天津鑫鑫制药厂;大豆卵磷脂(化学纯),天津博迪化工股份有限公司;胆固醇(分析纯),国药集团化学试剂有限公司;维生素E(含量98%),郑州荔诺生物科技有限公司;氯仿(分析纯),烟台三和化学试剂有限公司;甲醇(色谱纯),天津科密欧化学试剂有限公司;Sephadex G-10葡聚糖凝胶,北京瑞达恒辉科技发展有限公司。
UV1000型紫外分光光度计,北京莱伯泰科有限公司;IT-09A5型恒温磁力搅拌器,上海一恒科学仪器有限公司;Zetasizer Nano ZS90型纳米粒度和Zeta电位及分子量分析仪,英国马尔文仪器有限公司;KH-250DB型数控超声波清洗器,昆山禾创超声仪器有限公司;JEM-2100型透射电子显微镜,日本电子株式会社。
1.2 脂质体的制备
分别精密称取0.3g大豆卵磷脂、0.15g胆固醇、0.05g维生素E和0.03g格列齐特于烧杯中,加入适量氯仿,将烧杯置于恒温磁力搅拌器上,常温下搅拌至完全溶解。将溶液转移至圆底烧瓶中,减压蒸馏除去氯仿,烧瓶内壁出现一层透明薄膜。烧瓶中加入磷酸盐缓冲液使膜充分水化,然后将烧瓶置于超声波清洗器内超声,生成乳白色半透明溶液,分别过0.45μm和0.22μm微孔滤膜各3次,即得格列齐特脂质体[3]。
1.3 优化实验
以药脂比(格列齐特与大豆卵磷脂的质量比,g∶g,下同)、超声时间、成膜温度和缓冲液pH值作为考察因素,以包封率为考核指标进行单因素实验;在单因素实验基础上,进行4因素3水平正交实验,确定最优条件;以筛选出的最优条件制备脂质体,重复3次,测定脂质体平均包封率、平均粒径和平均电位,并观察脂质体形态,验证最优制备条件。
1.4 标准曲线的绘制
精密称取20mg格列齐特置于250mL容量瓶中,加入pH值7.4的磷酸盐缓冲液,振摇、溶解,定容,得浓度为0.08mg·mL-1格列齐特标准溶液。分别精密量取1mL、2mL、3mL、4mL、5mL和6mL标准溶液于25mL容量瓶中,加缓冲液定容、摇匀,在226nm处测吸光度。以浓度(c)为横坐标、吸光度(A)为纵坐标绘制标准曲线,拟合得标准曲线方程:A=0.039c+0.0035,R2=0.9999。结果表明,格列齐特在3.456~20.738μg·mL-1浓度范围内线性关系良好。
1.5 回收率实验
精密称取16mg、20mg和24mg格列齐特,分别加入50mL空白脂质体溶液。摇匀后加入甲醇超声破膜,用pH值7.4的磷酸盐缓冲液定容。测定格列齐特脂质体溶液的吸光度,根据吸光度计算与空白脂质体混合后的药物含量,按式(1)计算回收率:

1.6 包封率的测定
取2mL格列齐特脂质体溶液上样于Sephadex G-10柱(上样前应先加空白脂质体直至流出液为乳白色溶液),上样结束后用pH值7.4的磷酸盐缓冲液进行洗脱,洗脱速度为1mL·min-1,收集洗脱液,每份收集1mL,共收集30份。每份洗脱液分别用适量甲醇超声破膜,再用pH值7.4的磷酸盐缓冲液定容至10mL,摇匀,测定吸光度[4],以吸光度为纵坐标、洗脱时间为横坐标绘制洗脱曲线。根据吸光度可以计算出每份样品中的药物含量,按式(2)计算包封率:

1.7 稳定性实验
将制备的格列齐物脂质体分成3份,分别于4℃、25℃、50℃下保存30d,在第0d、3d、6d、9d、12d、15d、18d、21d、24d、27d、30d分别取样测定包封率,绘制包封率曲线。
2 结果与讨论
2.1 回收率实验
经计算得格列齐特回收率分别为(99.8±1.7)%、(100.5±2.6)%、(104.3±3.4)%(n=3)。操作过程中,药物的损失量一定,加入的药物越多,药物损失对结果的影响就越小,回收率越高。结果表明,制备脂质体的辅料对样品测定没有影响,且方法简便、重现性好。
2.2 洗脱曲线(图1)
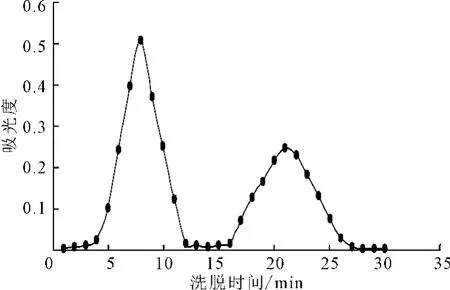
图1 格列齐特脂质体洗脱曲线Fig.1 The elution curve of gliclazide liposome
由于含药脂质体的粒径大于游离药物,因此,含药脂质体会先于游离药物被洗脱出来[5],即该洗脱曲线有两个分离度较好的峰:第一个峰所对应的几组样品的药物含量总和即为被包封的药物含量,第二个峰所对应的几组样品的药物含量总和即为未包封的药物含量。
由图1可看出,洗脱时间为5~11min所收集样品为含药脂质体,洗脱时间为17~25min所收集样品为游离药物。分别计算每份样品的药物含量,计算脂质体的包封率为62.63%。
2.3 单因素实验结果
2.3.1 药脂比
保持超声时间、成膜温度和缓冲液pH值不变,分别制备药脂比为1∶5、1∶10、1∶15、1∶20的脂质体溶液,测定包封率,结果见图2。
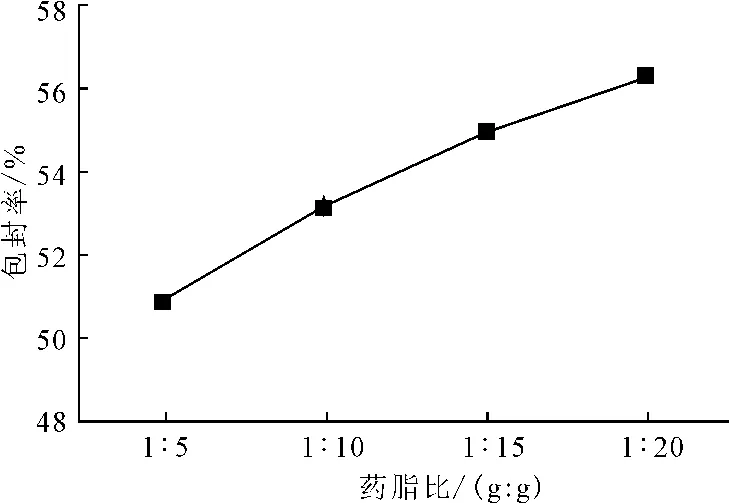
图2 不同药脂比下的包封率Fig.2 The entrapment efficiency of different drug-lipid ratios
由图2可知,随着药脂比的减小(即大豆卵磷脂质量的增加),包封率逐渐增大,但药脂比为1∶10和1∶20时,包封率分别为53.21%和56.35%,相差不大。综合考虑载药量,选取适宜的药脂比为1∶10。2.3.2 超声时间
其它条件不变,制备超声时间分别为5min、10 min、15min、20min的脂质体溶液,测定包封率,结果见图3。
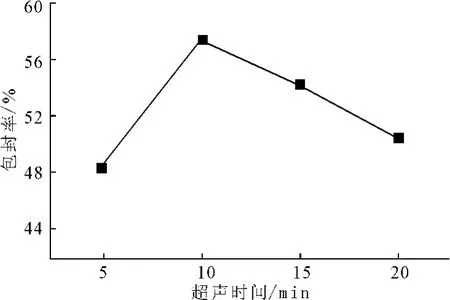
图3 不同超声时间下的包封率Fig.3 The entrapment efficiency of different ultrasonic times
由图3可知,随着超声时间的延长,包封率先增大后减小;当超声时间为10min时,包封率最大,达到57.39%。这是因为,随着超声时间的延长,脂质体粒径会越来越小,而粒径越小的脂质体包封率也越低。因此,选取适宜的超声时间为10min。
2.3.3 成膜温度
其它条件不变,制备成膜温度分别为40℃、50℃、60℃、70℃的脂质体溶液,测定包封率,结果见图4。
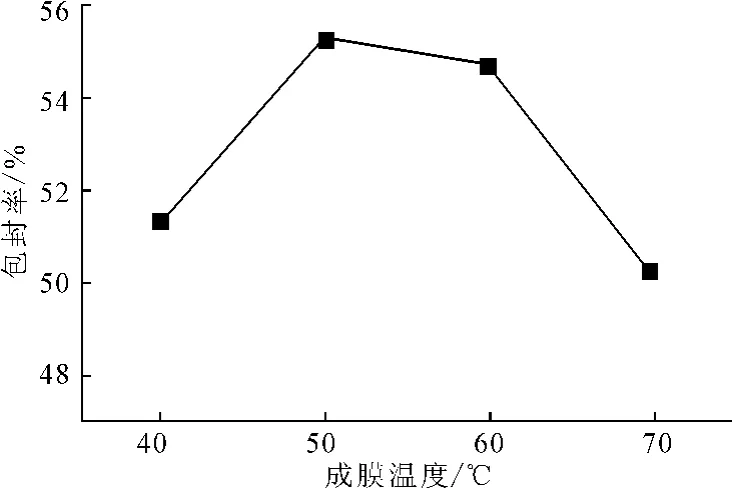
图4 不同成膜温度下的包封率Fig.4 The entrapment efficiency of different film-forming temperatures
由图4可知,随着成膜温度的升高,包封率先增大后减小;当成膜温度为50℃时,包封率最大,达到55.31%。这可能是因为,成膜温度太高会增加膜分子的热运动,膜的流动性增强,从而包封率降低。因此,选取适宜的成膜温度为50℃。
2.3.4 缓冲液pH值
其它条件不变,制备缓冲液pH值分别为5、6、7、8的脂质体溶液,测定包封率,结果见图5。
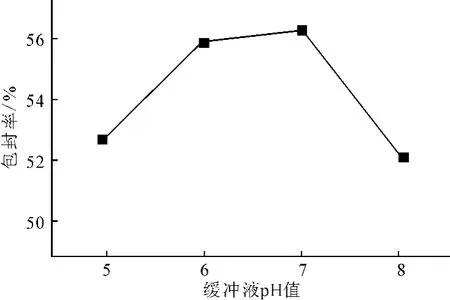
图5 不同缓冲液pH值下的包封率Fig.5 The entrapment efficiency of different pH values of buffer solution
由图5可知,随着缓冲液pH值的增大,包封率先增大后减小;缓冲液pH值为7时,包封率最大,达到56.24%。这是因为,当缓冲液pH值为7时,脂质体的性质最稳定,缓冲液pH值过高或过低都会加速脂质体的水解,降低包封率。因此,选取适宜的缓冲液pH值为7。
2.4 正交实验结果
根据单因素实验结果选取恰当的水平,用L9(34)正交实验优化制备条件,正交实验的因素与水平见表1,结果与分析见表2。

表1 正交实验的因素与水平Tab.1 Factors and levels of orthogonal experiment
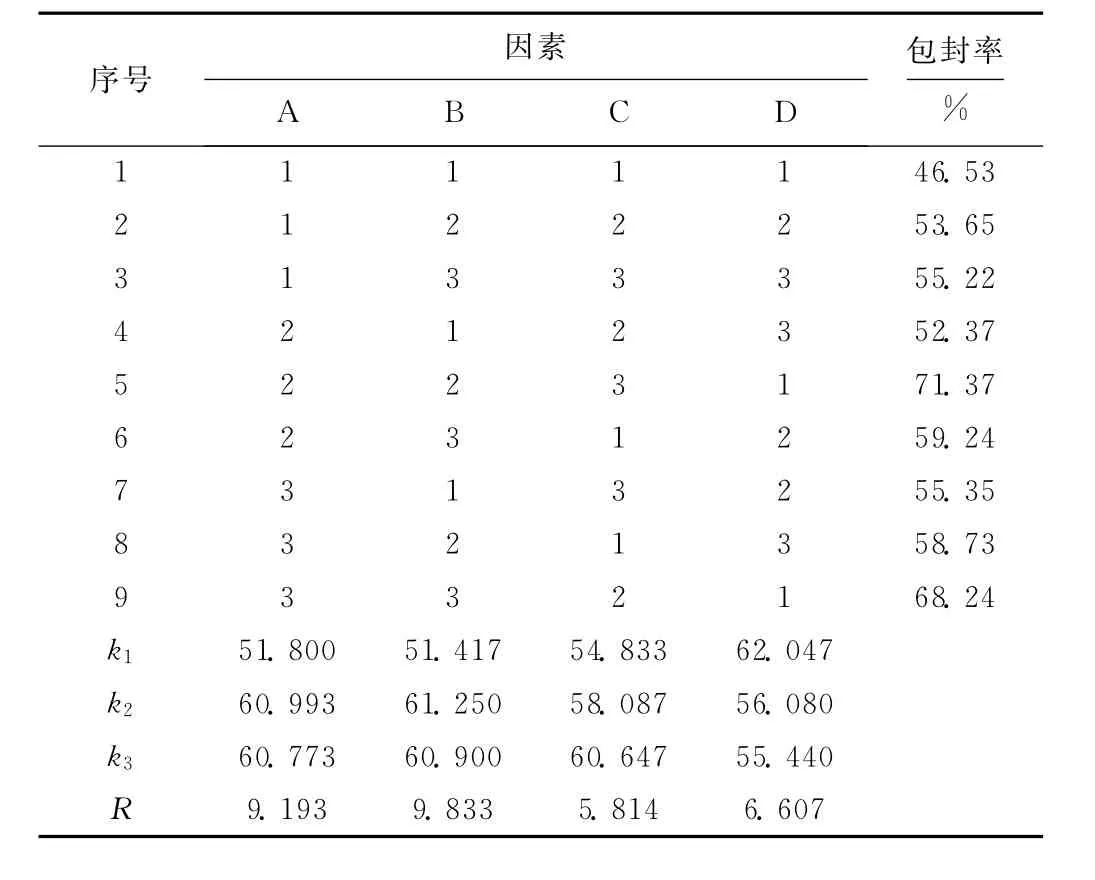
表2 正交实验结果与分析Tab.2 The results and analysis of orthogonal experiment
由表2可知,各因素对包封率影响的大小顺序为:B>A>D>C,即超声时间>药脂比>缓冲液pH值>成膜温度;优化组合为A2B2C3D1,即药脂比为1∶10、超声时间为10min、成膜温度为60℃、缓冲液pH值为6。
2.5 验证实验
经测定,3组最优条件所制备脂质体的平均包封率为(72.19±3.6)%,平均粒径为(108.3±12.4)nm,平均Zeta电位为(-40.8±2.3)mV。表明所确定的制备条件是稳定可行的。
2.5.1 脂质体的纳米粒度分析(图6)
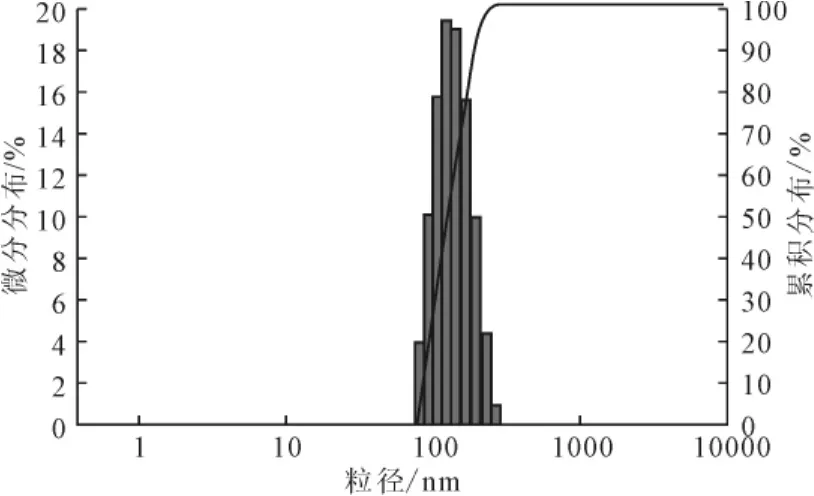
图6 脂质体的纳米粒度分布Fig.6 The size distribution of liposome nanoparticles
由图6可知,最优条件所制备的脂质体在100~200nm内完全分布,分布窄且无杂质,符合注射用脂质体的要求。
2.5.2 脂质体的Zeta电位分布(图7)
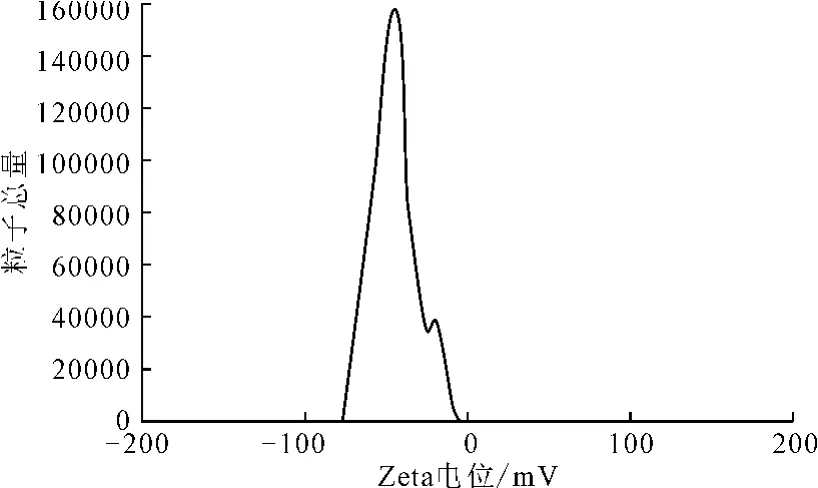
图7 脂质体的Zeta电位分布Fig.7 Zeta potential pattern of liposome nanoparticles
平均Zeta电位在-30~-60mV之间的脂质体溶液是稳定、不易泄露的[6]。由图7可知,所制备的脂质体的平均Zeta电位为(-40.8±2.3)mV。电位为负电位,稳定性好。
2.5.3 脂质体的透射电镜照片(图8)
由图8可知,所制备的脂质体颗粒近似圆形、无粘连且粒径均一。在进行透射电镜检测时,因为受到高温干燥和电子束轰击,会导致部分脂质体颗粒破裂,因而透射电镜照片中的粒子数较少。

图8 格列齐特脂质体透射电镜照片Fig.8 TEM Image of gliclazide liposome
2.6 稳定性实验
测定3组样品的包封率,绘制包封率曲线,见图9。
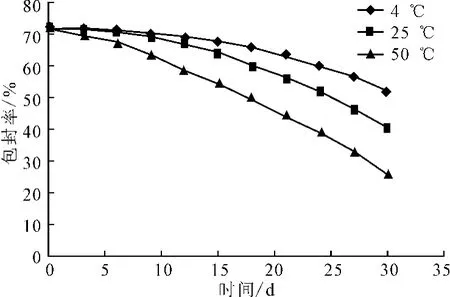
图9 包封率曲线Fig.9 The curve of entrapment efficiency
由图9可知,在4℃下保存的脂质体,包封率下降缓慢且30d后包封率仍在50%以上,而50℃保存的脂质体在30d后包封率已经降到30%以下,所以脂质体溶液适宜在低温环境下保存[7]。
2.7 讨论
膜材中加入少量抗氧化物可有效抑制磷脂的氧化,提高脂质体的稳定性[8]。实验中加入的维生素E安全无害,不但可以提高脂质体的稳定性,且对人体有益。
测定脂质体包封率的方法主要有:高速离心法、超滤离心法和葡聚糖凝胶柱法[9]。高速离心法由于脂质体粒径太小,不能使载药脂质体和游离药物完全分离,导致测量结果不准确;超滤离心法虽然测量准确,但测量费用昂贵,且操作复杂;葡聚糖凝胶柱法,方法简单、测量准确、重现性好,可以有效地分离含药脂质体和游离药物,因此选取葡聚糖凝胶柱法测量脂质体包封率。
Sephadex G-10适用于分离小分子的脂溶性药物,若所包封的药物是水溶性药物应该选取Sephadex G-50柱[10]。Sephadex G-10柱可有效地分离含药脂质体和游离的格列齐特。
3 结论
采用薄膜分散法制备格列齐特脂质体,以粒径和包封率为考核指标,通过单因素实验和正交实验优化制备条件。确定制备格列齐特脂质体的最优条件为:药脂比1∶10(g∶g)、超声时间10min、成膜温度60℃、缓冲液pH值6。验证实验表明,所制备的脂质体包封率达到(72.19±3.6)%,平均粒径为(108.3± 12.4)nm,且粒径分布均匀、形态规整,平均Zeta电位为(-40.8±2.3)mV,且在4℃下保存稳定性好。本方法工艺简单、条件温和、重现性好,有望进一步制备格列齐特脂质体注射液。
[1]薛瑞.格列齐特骨架缓释片的制备及释放度测定[J].中国医院药学杂志,2013,33(17):1398-1401.
[2]DESAIM P,LABHASETWAR V,AMIDONG L,et al.Gastroin-testinal of biodegradable microparticles[J].Pharm Res,1996,13(12):1838-1845.
[3]李红娇,王玮,张卫强,等.阿莫西林脂质体的制备及质量评价[J].中国兽药杂志,2013,17(2):35-37.
[4]李淑斌,刘丹,宁红,等.紫杉醇固体脂质纳米粒包封率的测定[J].中国药学杂志,2008,43(21):1665-1668.
[5]杜昌余.纳米粒制备方法的筛选及工艺处方优化[D].青岛:青岛科技大学,2013.
[6]牟琳琳,徐洋,蒋宫平,等.改良pH梯度法制备盐酸小檗碱脂质体[J].中国药学杂志,2013,48(1):49-53.
[7]LAOUINI A,JAAFAR-MAALEJ A,SFAR S,et al.Liposome preparation using a hollow fiber membrane contactor-application to spironolactone encapsulation[J].International Journal of Pharmaceutics,2011,415(1-2):53-61.
[8]刘亚文,曹光群,陈婷婷.维生素C脂质体的制备研究[J].大豆科学,2007,26(2):270-272.
[9]陈召红,刘皈阳,魏亚超.脂质体包封率测定方法研究进展[J].解放军药学学报,2011,27(1):79-82.
[10]任文霞,李建科.逆相蒸发法制备茶多酚脂质体及质量评价[J].生物加工过程,2009,7(2):68-73.
Preparation and Quality Evaluation of Gliclazide Liposome
LIU Li-ming,WANG Hong-guang
(College of Chemical Engineering,Qingdao University of Science and Technology,Qingdao 266042,China)
Gliclazide liposomes were prepared by thin-film dispersion method.Using mean diameter and entrapment efficiency as evaluation index,the preparation conditions were optimized by single factor experiment and orthogonal experiment,and mean diameter and entrapment efficiency were measured.The optimal conditions were as follows:drug-lipid ratio of 1∶10(g∶g),ultrasonic time of 10min,film-forming temperature of 60℃,the buffer solution pH value of 6.The mean diameter,entrapment efficiency and average Zeta potential of gliclazide liposomes were(108.3±12.4)nm,(72.19±3.6)%and(-40.8±2.3)mV,respectively.The liposomes showed good stability under preservation at 4℃.TEM Image showed that the liposomes exhibited good spherical degree,uniform particle size and no adhesion.The results showed that the process of gliclazide liposomes prepared by thin-film dispersion method was stable and the quality could be controlled well.
gliclazide;liposome;thin-film dispersion method;entrapment efficiency
TQ 460.6
A
1672-5425(2015)03-0040-05
10.3969/j.issn.1672-5425.2015.03.010
2014-11-06
刘力铭(1988-),男,辽宁丹东人,硕士研究生,研究方向:药物新剂型,E-mail:403005919@qq.com;通讯作者:王洪光,教授,E-mail:whongg1@yeah.net。
