维持性血液透析患者血清Fetuin-A、炎症因子水平与心脏瓣膜钙化的相关性
2015-07-01张菲菲张雪晶柴建高延霞
张菲菲,张雪晶 ,柴建,高延霞
(1青岛大学医学院,山东青岛266003;2青岛市市北区人民医院; 3 青岛大学附属医院)
维持性血液透析患者血清Fetuin-A、炎症因子水平与心脏瓣膜钙化的相关性
张菲菲1,张雪晶2,柴建1,高延霞3
(1青岛大学医学院,山东青岛266003;2青岛市市北区人民医院; 3 青岛大学附属医院)
目的 探讨血清胎球蛋白(Fetuin)-A、IL-6和超敏C反应蛋白(hsCRP)水平与维持性血液透析(MHD)患者心脏瓣膜钙化发生中的作用。方法 研究对象为 99例MHD 患者,超声心动检查发现40例(40.4%)患者合并瓣膜钙化(钙化组),其中二尖瓣瓣膜钙化钙化(MVC)27例,主动脉瓣瓣膜钙化(AVC)30例,双瓣膜钙化17例。未发现钙化59例(未钙化组)。采用ELISA法检测两组血清Fetuin-A、IL-6、hsCRP水平并分析其与心脏瓣膜钙化程度的相关性。结果 钙化组血清Fetuin-A水平低于无钙化组,hsCRP、IL-6水平高于无钙化组(P均<0.05);钙化组双瓣膜钙化者血清Fetuin-A水平低于、hsCRP、IL-6水平高于单个瓣膜钙化者(P均<0.05)。结论 MHD患者心脏瓣膜钙化的发生率较高,以主动脉瓣瓣膜钙化多见。血清Fetuin-A 及IL-6、hsCRP参与了MHD患者心脏瓣膜钙化的发生,且与钙化程度有关。
血液透析;心脏瓣膜钙化;胎球蛋白;白细胞介素6;C反应蛋白
心脏瓣膜钙化是维持性血液透析(MHD)的常见并发症[1~4]。多年来对于瓣膜钙化机制的研究主要集中于高磷血症、高钙磷乘积以及甲状旁腺机能亢进方面[5]。为探讨胎球蛋白A(Fetuin-A)及炎性因子(hsCRP、IL-6)在MHD心脏瓣膜钙化发生中的作用,我们进行了如下研究。
1 资料与方法
1.1 临床资料 研究对象为99例选取2014年3月前于青岛大学附属医院血液透析中心开始行MHD的患者,其中男53例、女46例,年龄(52.14±11.62)岁,透析龄(4.23±3.17)年。原发病为慢性肾小球肾炎54例,糖尿病肾病19例,高血压肾病8例,多囊肾6例,狼疮性肾炎3例,抗中性粒细胞胞质抗体(ANCA)相关性血管炎2例,脂蛋白肾病2例,痛风性肾病2例,马兜铃酸肾病2例,梗阻性肾病1例。入选标准:年龄大于18岁,透析龄大于6个月,碳酸氢盐透析,每周透析3次,每次4 h。排除标准:曾有冠状动脉血管再造包括冠状动脉搭桥手术和经皮冠状动脉介入术、起搏器和除颤器放置或置换心脏瓣膜或实体器官移植术病史;年龄>70岁,或者有明显的感染征象、急性血管炎、急性肝脏疾病、甲状旁腺切除术后、吸烟或者先前已行肾移植者。采用PhilipsSD800心脏彩超诊断仪观察心脏瓣膜钙化情况,探头频率7.5 MHz。主动脉瓣、二尖瓣或二尖瓣瓣环发现一个或多个超过1 mm的明亮回声则认为存在心脏瓣膜钙化。本组共发现瓣膜钙化40例(钙化组),其中二尖瓣瓣膜钙化27例(MVC,27.3%),主动脉瓣瓣膜钙化30例(AVC,30.3%),二尖瓣瓣膜及主动脉瓣瓣膜均存在钙化(双瓣膜钙化)17例;未发现瓣膜钙化59例(未钙化组)。99例患者均签署知情同意书。
1.2 血清Fetuin-A及IL-6、hsCRP检测 常规抽取患者静脉血分离血清,采用ELISA法检测Fetuin-A及IL-6、hsCRP水平。操作按试剂盒说明书进行。分析心脏Fetuin-A、IL-6、hsCRP与瓣膜钙化程度的关系。
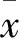
2 结果
由表1可见,与未合并瓣膜钙化组相比,合并瓣膜钙化组血清Fetuin-A水平较低(P均<0.05),hsCRP、IL-6水平较高(P均<0.05);与合并单个瓣膜钙化者相比,双瓣膜钙化者血清Fetuin-A水平较低(P均<0.05),hsCRP、IL-6水平较高(P均<0.05)。
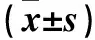
表1 两组血清Fetuin-A及IL-6、hsCRP水平比较
注:与无钙化组相比,*P<0.05;与单瓣膜钙化者相比,#P<0.05。
3 讨论
研究发现,慢性肾脏病(CKD)及终末期肾脏病(ESRD)患者血管钙化的发生率普遍增高,年龄和透析龄与瓣膜钙化的相关性也已经被证实[12]。从组织结构上来说血管钙化分为四种类型:动脉粥样硬化内膜钙化、动脉中层钙化、心脏瓣膜钙化、微动脉钙化[6]。MHD患者的心脏瓣膜病变主要为瓣膜钙化。国外研究发现,心脏瓣膜钙化在长期血液透析患者中的发病率为47%[7],约是正常人群的4~5倍[8]。另一项研究表明,透析患者AVC的发生率较MVC高,且无论是正常人群还是MHD患者,钙化均主要发生在主动脉瓣[9]; AVC和MVC的发生率分别为为30.7%和14.9%[10]。本研究AVC和MVC发生率分别为30.3%和27.3%,与文献报道基本一致。晚期的心脏瓣膜钙化可致瓣膜功能异常,进而可致心功能不全、全身炎症进展,增加心血管疾病的发生率。
Fetuin-A为近年发现的一种血管钙化抑制物[14],是由肝脏产生的负性急性期反应蛋白,存在于所有细胞的细胞液中[15]。由于其与高磷酸钙有密切的相关性,因此可沉积于矿化骨基质中、动脉粥样硬化斑块中以及病理矿化组织中[16]。矿物结合是Fetuin-A显著的特征[17]。从化学特性上来说,Fetuin-A是自发性磷酸钙沉积的抑制剂,主要通过形成可溶性胶状的钙质蛋白颗粒发挥作用[18]。细胞水平上,Fetuin-A主要沉积于与血管平滑肌细胞相关的矿化基质小泡中,可致细胞凋亡的衰减和营养不良性钙化[19]。同时,伴血管钙化的ESRD患者血清Fetuin-A的水平显著低于不伴ESRD患者[20]。研究发现,ESRD患者免疫功能下降,血清IL-6、hsCRP等炎性因子水平升高[21]。本研究结果显示钙化组Fetuin-A水平明显低于无钙化组,瓣膜钙化数量越多,Fetuin-A的水平越低,进一步证实Fetuin-A水平降低与心脏瓣膜钙化的发生密切相关。钙化组血清hsCRP、IL-6水平明显高于无钙化组,Fetuin-A水平与hsCRP和IL-6呈负相关。证实MHD患者体内存在微炎症状态。而微炎性反应状态是MHD 患者并发心血管疾病和死亡的独立危险因素。文献报道,MHD患者Fetuin-A与hsCRP水平呈负相关[20];Fetuin-A和IL-6均可直接参与心血管疾病的发展,但后者的预测作用大于前者。目前IL-6并未纳入MHD患者的常规检验,可能与对该因子的临床价值认识不足、检测价格昂贵、检验费用未在医保范围等有关。本研究未行Fetuin-A、hsCRP和IL-6对心脏瓣膜钙化预测价值的比较,今后需更多的研究探讨。
综上所述,MHD患者心脏瓣膜钙化发生率高。Fetuin-A水平降低及炎状态在心脏瓣膜钙化的发生中起重要作用。Fetuin-A对于评估心脏钙化、心血管病变的进展及其恶化均有着重要价值。
[1] Ribeiro S, Ramos A, Brandao A, et al. Cardiac valve calcification in haemodialysis patients: Role of calcium-phosphate metabolism[J].Nephrol Dial Transplant, 1998,13(3):2037-2040.
[2] Wang AY, Wang M, Woo J, et al. Cardiac valve calcification as an important predictor for all-cause mortality and cardiovascular mortality in longterm peritoneal dialysis patients: a prospective study[J]. J Am Soc Nephrol, 2003,14:159-168.
[3] Raggi P, Bellasi A, Gamboa C, et al. All-cause mortality in hemodialysis patients with heart valve calcification[J]. Clin J Am Soc Nephrol, 2011,34(6):1990-1995.
[4] Shanahan CM, Crouthamel MH, Kapustin A, et al. Arterial calcification in chronic kidney disease: key roles for calcium and phosphate[J]. Circ Res, 2011,10(9):697-711.
[5] Blacher J, Gué rin AP, Pannier B. Arterial calcifi cations, arterial stiffness and cardiovascular risk in end-stage renal disease[J]. Hypertension, 2001,38(3):938-942.
[6] Memon F, El-Abbadi M, Nakatani T, et al. Does Fgf23-klotho activity influence vascular and soft tissue calcification through regulating mineral ion metabolism[J]. Kidney Int, 2008,74(16):566-570.
[7] Sharma R, Pellerin D, Gaze DC, et al. Mitral annular calcification predicts mortality and coronary artery disease in end stage renal disease[J]. Atherosclerosis, 2007,19(1):348-354.
[8] Herzog CA.Kidney disease in cardiology[J]. Nephrol Dial Transplant, 2011,26(3):46-50.
[9] Boon A, Cheriex E, Lodder J, et al.Cardiac valve calcification: Characteristics of patients with calcification of the mitral annulus or aortic valve[J]. Heart, 1997,78:472-474.
[10] Mohamed BA,Yang W,Litt H,et al. Valvular calcification, inflammation, and mortality in. dialysis batients[J]. J Heart Valve Dis, 2013,22(3):584-590.
[11] Nkomo VT, Gardin JM, Skelton TN, et al. Burden of valvular heart diseases: a population- based study[J]. Lancet,2006,36(8):1005-1011.
[12] 戎殳,叶朝阳,牛晓萍,等. 血液透析患者心脏瓣膜钙化及其 危险因素[J].中华肾脏病杂志, 2004,24(1):364-366.
[13] 周长菊,章旭,曹娟,等. 维持性血液透析患者采用不同血液净 化方式心脏瓣膜钙化高危因素分析[J].新乡医学院学报, 2012, 29( 4) : 282-285.
[14] Peng CS,Cao YA. Fetuin A and Artery Calcification[J]. J Nav Gen Hosp, 2011, 23(2): 29-31.
[15] Schafer C, Heiss A, Schwarz A. The serum protein alpha 2-Heremans-Schmid glycoprotein/fetuin-A is a systemically acting inhibitor of ectopic calcifi cation[J]. J Clin Invest,2003,11(2):357-366.
[16] Keeley KW, Sitarz EE. Identifi cation and quantitation of alpha 2-HS-glycoprotein in the mineralized matrix of calcified plaques of atherosclerotic human aorta[J]. Atherosclerosis, 1985,55(3):63-69.
[17] Demetriou M, Binkert C, Sukhu B, et al. Fetuin/α 2 HS glycoprotein is a transforming growth factor-beta type II receptor mimic and cytokine antagonist[J]. J Biol Chem, 1996,27(1):12755- 12761.
[18] Price PA, Lim JE. The inhibition of calcium phosphate precipitation by fetuin is accompanied by the formation of a fetuin-mineral complex[J].J Biol Chem, 2003,27(8):22144-22152.
[19] Reynolds JL, Joannides AJ, Skepper JN, et al. Human vascular smooth muscle cells undergo vesicle-mediated calcifi cation in response to changes in extracellular calcium and phosphate concentrations: a potential mechanism for accelerated vascular calcifi cation in ESRD[J]. J Am Soc Nephrol, 2004,15(13):2857-2867.
[20] Ketteler M, Bongartz P, Westenfeld R, et al. Association of low fetuin-A (AHSG) concentrations in serum with cardiovascular mortality in patients on dialysis: a cross-sectional study[J]. Lancet, 2003,361(24):827-833.
[21] Kimmel PL, Phillips TM, Simmens SJ. Immunologic function and survival in hemodialysis patients[J]. Kidney Int, 1998,54:236-244.
山东省医药卫生科研项目(2007BW10)。
高延霞
10.3969/j.issn.1002-266X.2015.06.013
R459.5
B
1002-266X(2015)06-0037-03
2014-10-15)
