人脐带来源的间充质干细胞再次培养效果观察
2015-07-01高彦琳张宁坤陈厚良高连如朱智明
高彦琳, 张宁坤, 陈厚良, 高连如, 朱智明
(中国人民解放军海军总医院,北京100000)
·基础研究·
人脐带来源的间充质干细胞再次培养效果观察
高彦琳, 张宁坤, 陈厚良, 高连如, 朱智明
(中国人民解放军海军总医院,北京100000)
目的 探讨人脐带来源间充质干细胞(hUC- MSCs )体外培养的最佳方法。方法 采用组织块贴壁法分离培养hUC- MSCs,记为初次培养组。将原代培养瓶中的培养液及组织离心,重新分成再次培养组织组、再次培养混合组和再次培养纯液组进行再次培养。观察四组原代细胞的细胞形态、获得时间和细胞得率;MTT法绘制细胞生长曲线, 流式细胞仪检测细胞周期及免疫表型。结果 初次培养组、再次培养组织组、再次培养混合组、再次培养纯液组获取细胞的平均时间分别为(15±0.45)d、(7±0.30)d、(8±0.25)d、(8±0.25)d。每个T75培养瓶可获取的第1代细胞数分别为(4.0±0.50)×105、(9.0±0.55)×105、(15.0±0.20)×105、(7.0±0.33)×105个。倒置显微镜下观察四组细胞为形态相对均一的梭形贴壁细胞,呈平行排列生长或旋涡状生长。四组细胞的生长曲线、增殖活性、表面标记物检测均无明显差异。结论 对脐带间充质干细胞的原代培养体系进行再次培养,可在短时间内扩增出大量原代细胞。
间充质干细胞;脐带;细胞培养
间充质干细胞(MSCs)是进行细胞疗法的主要种子细胞[1], 具有较强的自我更新能力和多向分化潜能,在细胞治疗领域有着极为广阔的应用前景[2,3]。目前已从骨髓、 脂肪、 羊膜、 胎盘、 脐血以及脐带等组织中分离出MSCs,其有向内皮细胞、成骨细胞、软骨细胞、脂肪细胞、成肌细胞和神经细胞分化的能力[4~6]。 脐带的来源广泛,取材方便,易于收集、保存、冷冻,属于医疗废弃物,不受伦理、道德及法律方面的限制,且脐带组织中MSCs含量丰富,是再生医学理想的种子细胞[7]。目前分离培养脐带血来源的间充质干细胞(hUC-MSCs )的方法很多,但是都不能快速有效地获取原代细胞。2014年1~5月,我们观察并比较了对hUC-MSCs原代培养体系进行再次培养所获得hUC-MSCs的形态,获得hUC-MSCs 时间及数目,获得hUC-MSCs 细胞表型、增殖能力、周期分布,探讨最佳的hUC- MSCs 培养方法。现报告如下。
1 材料与方法
1.1 材料
1.1.1 脐带来源 经医院伦理委员会的批准, 在征得产妇和家属书面知情同意的情况下, 在海军总医院妇产科产房取当日剖宫产健康足月生产的新生儿脐带 (乙型肝炎病毒、 丙肝病毒、 人类免疫缺陷病毒、 TP-SX、巨细胞病毒梅毒、艾滋病等传染性疾病检测阴性)。
1.1.2 主要试剂及器材 DMEM/F12培养液、胎牛血清(FBS)、0.25%trypsin-EDTA胰蛋白酶均为美国 Gibco 公司生产;MTT为Sigma公司生产;流式单抗CD45-FITC、CD44-FITC、CD90-PE、 CD105-PE、HLA-ABC-PE、HLA-DR-FITC、CD31-PE 均为美国Biolegend 公司生产;倒置相差显微镜下为日本Nikon公司生产;流式细胞仪为美国 BD 公司生产;紫外分光光度仪、 二氧化碳培养箱(Thermo)。
1.2 hUC-MSCs分离及培养
1.2.1 hUC-MSCs的原代培养 将无菌条件下获取的脐带放入无菌生理盐水中,1 h内送至细胞培养实验室。参照Li等[8]报道的hUC-MSLs分离、培养方法。用生理盐水反复冲洗,洗去脐带残留血液,将脐带剪成3~4 cm的小段,每段均沿脐静脉腔剪开,平铺后剔除静脉,再剔除2根动脉,取出血管之间、血管与外膜之间的胶状物——华通胶,用小剪刀将取出的华通胶反复剪切成大约1 mm3及以下小块,接种于T75培养瓶内,每个培养瓶内加入10 mL含有10%FBS 的 DMEM/F12 培养液,使脐带华通胶均匀分布瓶底,置于5%CO2、37 ℃的培养箱内培养。在显微镜下观察细胞生长增殖情况并拍照。待细胞生长至80%~90%融合状态时,用0.25%胰蛋白酶消化传代细胞,为初次培养组。
1.2.2 hUC-MSCs再次培养 将原代培养瓶中的培养液及组织移入离心管中,1 500转/min离心5 min。将此体系分成三组,并分别接种于T75培养瓶内。再次培养组织组:单纯组织块组(无原培养基)加入10 mL含有10%FBS 的 DMEM/F12 培养液;再次培养混合组:组织块及原培养基的混合物组加入5 mL含有10%FBS 的 DMEM/F12 培养及5 mL原培养液;再次培养纯液组:原培养液10 mL,分别置于5%CO2、37 ℃的培养箱内培养。在显微镜下观察细胞生长增殖情况并拍照。待细胞生长至80%~90%融合状态时,用0.25%胰蛋白酶消化传代细胞。
1.3 观察项目及方法
1.3.1 hUC-MSCs形态、第一代细胞获取时间及数量 采用倒置显微镜观察四组hUC-MSCs形态。统计各组获取第一代hUC-MSCs的时间及每个培养瓶获取hUC-MSCs的数量。
1.3.2 hUC- MSCs 表面标记物 取各组第3代细胞,0.25%胰蛋白酶消化,PBS洗两次,调整细胞浓度为1×106/mL单细胞悬液,每个Eppembrf 管加 100 μL的细胞悬液 , 加入鼠抗人单克隆抗体 PE- CD90PE- CD105PE- CD44PE-CD73PE- HLA- ABC FITC- CD45FITC- CD34FITC- HLA- DR各 20 μL,充分混匀,避光室温孵育30 min, PBS 洗 2 遍(250 g 离心 5 min ),重新制成细胞悬液 0.5 mL,经300目细胞筛过滤,流式细胞仪上机检测并分析。
1.3.3 细胞增殖活性 取各组第3代细胞, 经0.25%胰蛋白酶消化计数后,分别用完全培养基调整细胞数至2.5 × 104/mL,取200 μL细胞悬液接种在96孔板中,每组设6个复孔,置于37 ℃ 5%CO2饱和湿度培养箱中培养。每隔24 h用MTT法检测各组细胞吸光度值(激发波长490 nm),连续7 d,取6孔均值绘制生长曲线。
1.3.4 细胞周期分布 取各组第3代细胞,经0.25%胰蛋白酶消化收集后,分别用 PBS 离心洗涤 2 次,调整细胞数至 1×106/mL,离心弃上清,加入4 ℃预冷的70%乙醇1 mL重悬,4 ℃冰箱过夜; 离心弃上清,用1 mL碘化丙啶重悬,4 ℃避光孵育 30 min,流式细胞仪检测,分析细胞周期。
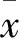
2 结果
2.1 hUC-MSCs形态、得第一代细胞获取时间及数量 倒置显微镜下观察四组原代细胞呈贴壁生长,形态均为长梭形或多角形1。初次培养组细胞以华通胶为中心呈旋涡状或平行排列生长,获取细胞的时间为(15.00±0.45)d,每个培养瓶可获取(4.00±0.5)×105个第一代细胞;再次培养组织组细胞以华通胶为中心呈旋涡状生长,获取细胞的平均时间为(7.00±0.3)d,每个培养瓶可获取(9.00±0.55)×105个第一代细胞;再次培养混合组部分细胞以华通胶为中心呈旋涡状生长,部分细胞呈散在生长,得到原代细胞的时间(8.00±0.25)d,每个培养瓶可获取(15.00±0.20)×105个第一代细胞;再次培养纯液组细胞呈散在生长,得到原代细胞的平均时间(8.00±0.58)d,每个T75培养瓶可获取(7.00±0.33)×105个第一代细胞。传至第3 代, 细胞增殖速度加快,形态较为均一呈长梭形,折光度好。四组第一代及第3代hUC-MSCs细胞形态无明显差异,初次培养组原代细胞获取时间显著长于其他三组(P均<0.05),再次培养的三组之间两两比较,P均>0.05。获取原代细胞数再次培养混合组数目最多,再次培养组织组其次,再次培养纯液组稍差,初次培养组最少,四组间两两比较P均<0.05。
2.2 hUC-MSCs免疫表型 四组第3代脐带间充质干细胞均高表达CD90、CD105、HLA-ABC,不表达 CD31、CD34、CD45、HLA- DR。
2.3 hUC-MSCs增殖能力 四组第3代hUC- MSCs细胞生长曲线见图1。四组hUC- MSCs 生长曲线形态相似,基本重叠。第1~2 d各组细胞处于潜伏期,增殖不明显; 3~5 d各组细胞进入对数生长期, 细胞增殖加速; 第 6 天以后进入平台期,细胞生长停滞。

图1 四组hUC-MSCs 生长曲线
2.4 hUC-MSCs细胞周期分布 各组细胞周期分布无统计学差异。
3 讨论
最近几年里,对成体干细胞疗法的研究在不断增加。MSCs是一个相当具有吸引力的种子细胞,可以用于治疗各种疾病,包括神经系统疾病、心血管疾病、自身免疫性疾病、内分泌疾病等[9]。hUC- MSCs 是介于胚胎干细胞和成体干细胞之间的原始干细胞,分化能力强,倍增时间短,具有免疫调节作用和较低的免疫原性,且无致肿瘤性[10,11]。1976年Friedenstein等[12]首先从脐带组织中分离培养出间充质干细胞,之后Schugar等[13]采用组织块法和酶消化法两种方法分别培养出脐带间充质干细胞,这也是目前较为常用的两种方法。这两种方法分离培养出的脐带间充质干细胞形态、 生长曲线、 细胞表面标记物等无明显差异[14]。但是酶消化法成本较高;操作比较繁琐污染概率大;消化过程时间过短,细胞很难爬出;消化时间过长易损伤细胞;长时间酶的消化对细胞损伤较大, 多次传代后细胞易脱落死亡[15]。
本研究采用组织块培养法提取脐带中MSCs。通常来讲组织块贴壁法是将小的组织块均匀铺于培养瓶底,原代细胞从组织块边缘爬出。虽然组织块贴壁法方便易行,操作简单,但存在原代细胞收获率低、培养周期长等问题[16],难以适应组织工程对种子细胞的需要。本研究中初次培养组获取原代细胞的平均时间大约2周,获取细胞数量较少,符合组织块贴壁法培养的结果。一般传代结束后就会将培养原代细胞的组织和培养液丢弃。本研究中笔者将废弃的组织和培养液离心后,分成组织组、混合组和纯液组进行再次培养,大约1周即可传代,且获取的细胞数为初次培养的2倍左右。相对于传统组织贴壁法,这种改进的方法可在较短时间内获得大量原代细胞,而且获得细胞的免疫表型、增殖能力及周期分布正常。笔者推测其原因:①初次培养后组织块内细胞并未完全爬出;②初次培养过程中可能形成了某些黏附物质和生长因子,促进组织块贴壁和生长[17];③组织块在经过一轮培养后,纤维组织松解,细胞易于爬出;④原代培养的培养液中可能存在一些散在细胞。
[1] Gatta V, Aurora MD, Lanuti P, et al. Gene expression modifications in Wharton's Jelly mesenchymal stem cells promoted by prolonged in vitro culturing[J]. BMC Genomics,2013,14(12):635.
[2] Mok PL, Leong CF, Cheong SK. Cellular mechanisms of emerging applications of mesenchymal stem cells[J]. Mal J Pathol, 2013,35(1):17-32.
[3] Neirinckx V, Coste C, Rogister B,et al. Concise review: adult mesenchymal stem cells, adult neural crest stem cells, and therapy of neurological pathologies: a state of play[J]. Stem Cells Trans Med, 2013,2(4):284-296.
[4] Constantinescu A, Andrei E,Iordache F, et,al.Recellularization potential assessment of Wharton's Jelly-derived endothelial progenitor cells using a human fetal vascular tissue model[J]. Develop Biol, 2014,8(3):37-39.
[5] Kang BJ, Ryul HK, Park SS, et al. Comparing the osteogenic potential of canine mesenchymal stem cells derived from adipose tissues, bone marrow, umbilical cord blood, and Wharton′s jelly for treating bone defects[J]. Korean Soc Veterin Sci, 2012,3(3):299-310.
[6] Fu YS, Shih YT, Cheng YC, et al. Transformation of human umbilical mesenchymal cells into neurons in vitro[J]. J Biomed Sci, 2004,11(5):652-660.
[7] Parvathy V,Sudha B, Majumdar AS, et al. Isolation, characterization, and gene expression analysis of Wharton′s jelly-derived mesenchymal stem cells under xeno-free culture conditions[J]. Adv App, 2011,8(5):39-50.
[8] Hsieh JY, Fu YS, Chang SJ, et al. Functional module analysis reveals differential osteogenic and stemness potentials inhuman mesenchymal stem cells from bone marrow and Wharton′s jelly of umbilical cord[J]. Stem Cells Dev, 2010,19(12):1895-1910.
[9] Bai J, Hu Y, Wang YR,et al. Comparison of human amniotic fluid-derived and umbilical cord Wharton's Jelly-derived mesenchymal stromal cells: Characterization and myocardial differentiation capacity[J]. J Geriatric Cardiol, 2012,9(5):166-171.
[10] Ribeiro J, Pereira T, Amorim I, et al. Cell therapy with human MSCs isolated from the umbilical cord Wharton jelly associated to a PVA membrane in the treatment of chronic skin wounds[J]. Inte J Med Sci, 2014,11(10):979-987.
[11] Prasajakl P, Leeanansaksiri W. Developing a new two-step protocol to generate functional hepatocytes from wharton′s jelly-derived mesenchymal stem cells under hypoxic condition[J]. Stem Cells Inter, 2013,5(10):1155-1165.
[12] Friedenstein AJ, Gorskaja JF, Kulagina NN. Fibroblast precursors in normal and irradiated mouse hematopoietic organs[J]. Exp Hematol, 1976,34(4):267-274.
[13] Schugar RC, Chirieleison SM, Wescoe KE, et al. High harvest yield, high expansion, and phenotype stability of CD146mesenchymal stromal cells from whole primitive human umbilical cord tissue[J]. J Biomed Biotechnol, 2009,2009:1-11.
[14] 李昆,于艳秋,李世正.两种分离人胎盘间充质干细胞方法的比较[J] .中国医科大学学报,2010,39(5):675-676.
[15] 郝白露,杨瑞峰,彭祥炽,等.改良的人脐带间充质干细胞培养方法[J].中国计划生育学杂志,2013,1(21):44-49.
[16] Diao Y, Ma Q, Cui F, et al.Human umbilical cord esenchymal stem cells :Osteogenesis in vivo as seed cells for bone tissue engineering[J]. J Biomed Mater Res, 2009,91(2):123-131.
[17] Conget PA , Minguell JJ. Phenotypical and functional properties of human bone marrow Mesenchymal progenit or cells[J]. J Cell Physiol, 1999,181 (1):67- 73.
国家自然科学基金面上项目(81170094)。
朱智明
10.3969/j.issn.1002-266X.2015.06.010
R318
A
1002-266X(2015)06-0028-03
2014-10-15)
