RASSF1A基因甲基化与肝细胞癌关系的Meta分析
2015-07-01叶婷於琳刘靳波
叶婷,於琳,刘靳波
(泸州医学院附属医院,四川泸州646000)
RASSF1A基因甲基化与肝细胞癌关系的Meta分析
叶婷,於琳,刘靳波
(泸州医学院附属医院,四川泸州646000)
目的 探讨RAS相关结构家庭1A基因(RASSF1A基因)异常甲基化与肝细胞癌的关系。方法 检索国外PubMed、Embase、Ovid、Web of science、Cochrane Library数据库和国内的中国生物医学文献数据库(CBM)、中文科技期刊全文数据库(VIP)、中国期刊全文数据库(CNKI)、万方数据库2014年7月以前的相关文献,按纳入排除标准筛选文献并提取数据。用RevMan5.2软件进行统计分析,使用比值比(OR)及95%置信区间(95%CI)衡量RASSF1A基因启动子区甲基化与肝癌的关系。结果 共15篇文献1 417例患者纳入研究,其中肝细胞癌组710例、对照组707例。肝细胞癌组织中RASSF1A甲基化阳性率高于正常肝组织[OR=50.23,95%CI(22.21~113.61)、P<0.05]、癌旁正常组织[OR=7.63,95%CI(3.38~17.22),P<0.05]及肝硬化组织[OR=17.18,95%CI(2.57~114.91),P<0.05]。结论 RASSF1A基因的高甲基化导致该基因的失活,与肝细胞癌的发生发展密切相关。
肝细胞癌;DNA 甲基化; RAS相关结构家庭1A基因; Meta分析
肝细胞癌是原发性肝癌的主要类型,是最常见的预后不良恶性肿瘤之一,其发生率呈上升趋势[1]。肝癌的发生发展是一个多阶段过程,由基因改变和表观遗传学异常共同引起原癌基因激活和抑癌基因失活或丢失。DNA甲基化是表观遗传学失活的主要类型,抑癌基因启动子区CpG岛高甲基化引起的表观沉默已成为肝癌发生发展中遗传学改变的关键因素之一[2]。近年有关DNA甲基化与肝细胞癌的研究较多,但结果并不完全一致。2014年8~9月,对国内外有RAS相关结构家族1A基因(RASSF1A基因)甲基化与肝细胞癌的文献进行Meta分析,以期为临床提供参考依据。
1 资料与方法
1.1 文献检索
1.1.1 检索策略 制定检索策略并进行系统全面的计算机检索。检索范围包括国外PubMed、Embase、Ovid、Web of Science、Cochrane Library数据库以及国内的中国生物医学文献数据库(CBM)、中文科技期刊全文数据库(VIP)、中国期刊全文数据库(CNKI)、万方数据库。中文检索词为RASSF1A基因、肝细胞癌、甲基化;英文检索词为Hepatocellular Carcinoma/HCC/Liver Cancer Carcinoma, Methylation/Methylate/Hypermethylation,Ras association domain family protein 1A/RASSF1A,对研究设计类型限定为case control/incidence,检索时间从建库截止到2014年6月30日,无语种限制。同时辅以文献追溯,获取全文。
1.1.2 纳入排除标准 纳入标准:①国内外公开发表的关于RASSF1A基因在肝细胞癌中甲基化情况研究的一次文献;②研究对象为人群,研究类型为病例—对照研究,病例组均由病理学确诊为肝细胞癌患者,对照组为经临床证实良性肝疾病患者或健康人群;③研究方法相似,即采用DNA甲基化特异性PCR(MSP)检测基因甲基化情况。④能获得全文,直接报告了有效的比值比(OR)及其95%CI,或者可以从文章报告的数据进行计算。排除标准:①重复发表的文献;②文摘、综述、讲座或会议文章;③标本为血清、细胞或动物等非肝脏组织实验研究;④检测方法不明确,资料不完整或数据不全不能统计的研究;⑤无法获得全文的文献。
1.2 资料提取 由两名评价者按照标准的数据提取表格,独立提取符合要求的研究资料。包括第一作者姓名、发表年份、研究地点、肿瘤的组织学类型、对照组来源、病例组和对照组的样本量、平均年龄及性别。通过讨论解决分歧。
1.3 文献质量评估 由两名评价者按照Cochrane手册推荐使用的纽卡斯尔—渥太华量表(NOS)独立评估纳入研究的方法学质量。该量表主要从研究人群即病例组与对照组的定义和选择、组间可比性、暴露因素的测量三方面共8个条目进行评分,满分9分。
1.4 统计学分析 采用Cochrane协作网提供的Reviews Manager 5.2(Rev Man 5.2)统计软件。对纳入文献的研究结果通过Meta分析方法进行合并,绘制森林图。各个被纳入文献之间的异质性大小用χ2检验和I2统计量来验证。若P≤0.05、I2≥50%则采用随机效应模型进行数据合并;若P>0.05、I2<50%则采用固定效应模型进行数据合并。进行敏感性分析以验证每个独立研究对总的合并结果的影响。通过Begg's测试以及绘制漏斗图估计是否有发表偏倚。P<0.05为差异有统计学意义。
2 结果
2.1 检索结果及纳入文献情况 初步检索获得相关文献共87篇,通过Endnote X6文献管理软件去重后获得文献49篇,再通过阅读文题和摘要排除综述、会议文章、与主题不相关的文献以及相同作者相似内容文献等获得18篇,进一步阅读全文,未达到纳入标准的3篇,最终纳入文献共15篇[3~17]。入选病例1 417例,其中肝细胞癌组710例,对照组707例(包括癌旁组354例、肝硬化111例、肝炎组39例及正常组织136例)。纳入文献基本情况见表1。

表1 RASSF1A基因纳入Meta分析文献的基本特征及质量评分
2.3 统计结果分析
2.3.1 肝细胞癌组织和正常肝组织RASSF1A基因甲基化率比较 11篇文献[3~9,11,12,15,16]报道此内容,肝细胞癌组450例、正常肝组织对照组136例,其中分别有372例(83.7%)患者肝细胞癌组织和11例(8.1%)正常肝组织检测到RASSF1A基因甲基化。异质性检验结果P=0.49、I2=0%,显示结果无异质性,采用固定效应模型进行Meta分析。结果显示肝细胞癌组织和正常肝组织中RASSF1A基因甲基化率差异有统计学意义[OR=50.23,95%CI(22.21~113.61),P<0.05],肝细胞癌组织中RASSF1A基因甲基化率明显高于正常肝组织,详见图1。

图1 肝癌组织与正常肝组织中RASSF1A基因甲基化的Meta分析
2.3.2 肝细胞癌组织和癌旁组织RASSF1A基因甲基化率比较 10篇文献[3~6,9~12,14,16]报道此内容,肝细胞癌426例、癌旁组织354例,其中分别有374例(87.8%)患者肝细胞癌组织和196例(55.4%)癌旁组织检测到RASSF1A基因甲基化。异质性检验结果P=0.005、I2=64%,显示结果有异质性,采用随机效应模型进行Meta分析。结果显示肝细胞癌组织和正常肝组织中RASSF1A基因甲基化率差异有统计学意义[OR=7.63,95%CI(3.38~17.22),P<0.05],肿瘤组织中RASSF1A基因甲基化率明显高于癌旁组织,详见图2。

图2 肝癌组织与癌旁组织中RASSF1A基因甲基化的Meta分析
2.3.3 RASSF1A基因在HCC肿瘤组织和肝硬化组织中的甲基化比较 5篇文献[4,12~15]报道此内容,肝细胞癌280例、肝硬化111例,其中分别有374例(87.8%)患者肝细胞癌组织和196例(55.4%)肝硬化组织检测到RASSF1A基因甲基化。异质性检验结果P=0.00 09、I2=79%,显示结果有异质性,采用随机效应模型进行Meta分析。结果显示肝细胞癌组织和正常肝组织中RASSF1A基因甲基化率差异有统计学意义[OR=17.18,95%CI(2.57~114.91),P<0.05],肝细胞癌组织中RASSF1A基因甲基化率明显高于肝硬化组织,详见图3。
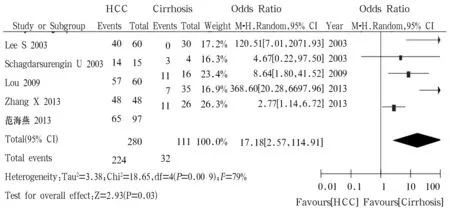
图3 肝癌组织与肝硬化组织中RASSF1A基因甲基化的Meta分析
2.4 发表偏倚评估 漏斗图图形基本呈对称倒立分布,说明发表偏倚对研究结果无影响。
2.5 敏感性分析 对I2>50%的结果行敏感性分析,每次减少一篇文献估计单个独立研究对Meta分析的影响。剔除后结果前后无明显差异,提示Meta分析结论较稳定可信。
3 讨论
抑癌基因启动子区异常甲基化的表观遗传失活被认为是肝癌等多种癌症发生的重要机制。RASSF1A基因定位于3p21.3,在细胞周期调控、微管稳定、细胞黏附和细胞凋亡中起着重要作用[18]。RASSF1A作为抑癌基因的功能已被体内外实验所证实, 在肿瘤细胞中高表达可降低细胞软琼脂克隆形成及裸鼠的致瘤性[19]。RASSF1A基因启动子区异常甲基化导致的基因缺失是癌症形成的频发事件,已在包括肝癌等多种类型的肿瘤中被证实。其作用机制是同源异位基因HOXB3与DNA甲基转移酶DNMT3B基因结合使其高表达,同时多梳抑制复合物2与癌基因MYC相互作用促进DNMT3B结合于RASSF1A启动子区,导致高甲基化及表达沉默促进肿瘤形成。RASSF1A基因异常甲基化与肝细胞癌的关系日益受到国内外研究者的关注,然而文献报道的结论存在一定分歧。本研究结果显示,肝细胞癌组织中RASSF1A基因甲基化率高于正常肝组织、肝硬化组织和癌旁组织。肝细胞癌的发生发展经过肝炎、肝硬化再到肝癌的多步骤演变,RASSF1A基因甲基化率在此过程中逐渐增高。
检验研究间的异质性是Meta分析的重要内容之一。本系统评价对纳入研究是否具有异质性做了详细分析,根据组间异质性存在与否选择随机效应或固定效应模型。为了保证结果的稳定性,另行敏感性分析,剔除单个独立研究后观察结果前后并无显著性变化,说明本次Meta分析结果稳定可靠。本研究尚有不足之处,包括检索到的文献不够全面,检索范围局限在公开发表的文献,对于未公开发表的研究存在漏检的可能;检索语种仅限于中文和英文,可能漏检其他语种的研究;纳入文献人种多为肝细胞癌多发的东亚地区等。因此,本系统评价纳入研究存在选择性偏倚、文献收集性偏倚的可能。由于Meta分析评价方法本身的不足与纳入研究间的差异,要更准确的评价抑癌基因RASSF1A甲基化与肝细胞癌的关系,尚需要纳入更全面、严谨,更高质量的病例对照研究进一步证实结果。
总之,本系统评价表明抑癌基因RASSF1A高甲基化与肝细胞癌密切相关,基因启动子区高甲基化诱导的表达失活在肝细胞癌的发生发展中发挥了重要作用。
[1] Siegel R, Naishadham D, Jemal A. Cancer statistics[J]. CA Cancer J Clin, 2013, 63(2):11-30.
[2] Nishida N, Nagasaka T, Nishimura T, et al. Aberrant methylation of multiple tumor suppressor genes in aging liver, chronic hepatitis, and hepatocellular carcinoma[J]. Hepatology, 2008, 47(3):908-918.
[3] 孙昕,朱立新,钱波,等.肝细胞癌中抑癌基因的甲基化现象[J].中华肝胆外科杂志,2008,14(5):318-320.
[4] Lou C, Du Z, Yang B, et al. Aberrant DNA methylation profile of hepatocellular carcinoma and surgically resected margin[J]. Cancer Sci, 2009, 100(6):996-1004.
[5] Zhang YJ, Ahsan H, Chen Y, et al. High frequency of promoter hypermethylation of RASSF1A and p16 and its relationship to aflatoxin B1-DNA adduct levels in human hepatocellular carcinoma[J]. Mol Carcinog, 2002,35:85-92.
[6] 赵中海, 耿小平, 朱立新,等. 肝细胞癌组织中Ras相关区域家族蛋白1A、肿瘤高甲基化基因1和p73基因的异常甲基化[J].中华外科杂志,2005,43(23):1528-1532.
[7] Feng QH, Stern JE, Hawes SE, et al. DNA methylation changes in normal liver tissues and hepatocellular carcinoma with different viral infection[J]. Exp Mol Pathol, 2010,88(2):287-292.
[8] Saelee P, Wongkham S, Chariyalertsak S, et al. RASSF1A promoter hypermethylation as a prognostic marker for hepatocellular carcinoma[J]. Asian Pac J Cancer Prev, 2010, 11(3):1677-1681.
[9] 费伯健,黄朝晖,华东,等. 血浆Ras相关区域家族蛋白1A基因甲基化在肝细胞癌分子诊断中的价值[J]. 肿瘤,2011,31(8):742-747.
[10] 陈武松,郭圣龙.原发性肝细胞癌RASSF1基因启动子甲基化检测及其临床意义[J].中国现代医学杂志,2011,21(15):1864-1867.
[11] 邱东民,余坚,黄朝晖.MSRE-qPCR技术分析多基因DNA甲基化对肝细胞癌的诊断价值[J]. 中国癌症杂志, 2011, 21(8):615-620.
[12] Zhang X, Li HM, Liu Z, et al. Loss of heterozygosity and methylation of multiple tumor suppressor genes on chromosome 3 in hepatocellular carcinoma[J]. J Gastroenterol, 2013,48(3):132-143.
[13] 范海燕, 张慧景, 郭占军,等.肝细胞癌患者癌组织中rassf1a和wif-1基因甲基化的临床意义[J].山东大学学报,2013,51(5):89-93.
[14] Lee SLH, Kim JH, Lee HS, et al. Aberrant CpG Island Hypermethylation Along Multistep Hepatocarcinogenesis[J]. AJP, 2003,163(4):1371-1378..
[15] Schagdarsurengin U, Wilkens L, Steinemann D, et al. Frequent epigenetic inactivation of the RASSF1A gene in hepatocellular carcinoma[J]. Oncogene, 2003,22(6):1866-1871.
[16] Yu J, Ni M, Xu J, et al. Methylation profiling of twenty promoter-CpG islands of genes which may contribute to hepatocellular carcinogenesis[J]. BMC Cancer, 2002, 12(2):29.
[17] Formeister EJ, Tsuchiya M, Fujii H, et al. Comparative analysis of promoter methylation and gene expression endpoints between tumorous and non-tumorous tissues from HCV-positive patients with hepatocellular carcinoma[J]. Mutat Res, 2010,692(1-2):26-33.
[18] Agathanggelou A, Cooper WN, Latif F. Role of the Ras-association domain family 1 tumor suppressor gene in human cancers[J]. Cancer Res, 2005, 65(9):3497-3508.
[19] Donninger H, Vos MD, Clark GJ. The RASSF1A tumor suppressor[J]. J Cell Sci, 2007,120(18):3163-3172.
四川省教育厅科研项目重点项目(12ZA243)。
刘靳波
10.3969/j.issn.1002-266X.2015.06.034
R735.7
B
1002-266X(2015)06-0085-04
2014-11-12)
