cDNA末端快速扩增法克隆高山离子芥原叶绿酸酯氧化还原酶基因及其表达特异性分析
2015-07-01李玉华邓培渊雷志华
李玉华,邓培渊,赵 奇,雷志华
(1.郑州师范学院生命科学学院,河南 郑州 450044; 2.郑州师范学院自然博物馆,河南 郑州 450044)
cDNA末端快速扩增法克隆高山离子芥原叶绿酸酯氧化还原酶基因及其表达特异性分析
李玉华1,邓培渊2,赵 奇1,雷志华1
(1.郑州师范学院生命科学学院,河南 郑州 450044; 2.郑州师范学院自然博物馆,河南 郑州 450044)
用cDNA末端快速扩增技术从高山离子芥中克隆得到完整的原叶绿酸酯氧化还原酶(POR, EC:1.3.1.33)基因,命名为CbPORB,DNAMAN软件分析CbPORB和其他几种植物的POR基因,有很高的同源性,将其cDNA序列提交到NCBI数据库(序列接受号为FJ390503)。CbPORB基因全长1 444 bp,包含1个1 209 bp的开放阅读框(ORF),编码402个氨基酸的蛋白CbPORB(序列号为ACJ12925)。NCBI数据库在线软件计算高山离子芥CbPORB蛋白的等电点为9.43,推测其相对分子量为43.37 kD。组织特异性表达分析显示:CbPORB在叶、茎中表达,根中不表达,具有器官特异性;干旱胁迫处理抑制CbPORB的转录水平;而表油菜素内酯(24-epibrassinolide;EBR)处理提高了CbPORB的转录水平。
cDNA末端快速扩增;CbPORB;半定量RT-PCR;高山离子芥
依赖光的原叶绿酸酯氧化还原酶(NADPH:Protochlorophyllide Oxidoreductase;POR,EC 1.3.1.33)催化原叶绿酸酯(Protochlorophyllide,Pchlide)还原成叶绿酸酯(Chlorophyllide,Chlide),它是叶绿素(Chl)生物合成和叶绿体发育的1个关键酶[1,2]。并且,POR催化Pchlide还原是Chl合成过程中唯一需要光的反应步骤[3]。在生物体中催化Pchlide还原有2种不同的还原酶:一种是POR;另一种是不依赖光Pchlide氧化还原酶(DPOR)[4]。DPOR与POR在分子结构、亚基组成、基因组编码和催化反应机制等方面完全不一样,DPOR是由叶绿体基因组编码[5];POR是由细胞核基因组编码[6]。在被子植物中,普遍存在2种POR,分别是PORA和PORB。PORA和PORB mRNAs是在黄化苗中形成的,但只有PORBmRNA在光照条件下生长的植物中累积,PORAmRNA在光照之后快速地消失[7]。POR基因的表达受到很多因素的影响,除了受生长发育阶段和光照条件影响外,研究发现,在拟南芥中POR基因表达水平还受光敏色素A的影响[8]。另外,POR基因表达水平受昼夜节律和生物钟节律的控制[9,10],POR基因水平还受植物激素控制[11]。总之,在被子植物中,POR在光照条件下催化质体中的Pchlide转变成Chlide,并且对白色体向叶绿体的转化过程的启动是必需的。
高山离子芥,属十字花科,生长于天山中段乌鲁木齐河源区,这里空气稀薄,劲风,剧烈冻融,强烈紫外线辐射等。高山离子芥整个生长发育过程的环境温度均在0 ℃上下频繁波动,是高山冰缘植物的典型代表[12,13]。高山冰缘植物能在极端环境下生存繁衍,都具有一些形态解剖和生理生化等方面的进化适应方式,尤其是它的光合特性反映了植物对高原特殊自然环境条件的响应和适应。本研究以高山离子芥为材料,研究其在低温环境下的光合作用,Chl合成机理,探讨它的低温适应性机制。同时,也希望能为农作物的抗低温、抗干旱育种,改善作物抗冻性、抗旱性提供理论依据。
1 材料与方法
1.1 试验材料
高山离子芥幼苗叶片为试验材料。高山离子芥种子表面用含有0.1%吐温20的1%氯化钠溶液消毒,然后用去离子水冲洗几次。种子子叶切下放在含有0.2 mg·L-12,4-二氯苯氧乙酸丁酯和0.2 mg·L-16-苄基腺嘌呤的MS培养基上,置于光照强度120 μmol·m-2·s-1,16 h(昼)/8 h(夜)光周期的人工组培室里生长20 d后,组织被转移到含有0.4 mg·L-1赤霉素、0.6 mg·L-1激动素、30 g·L-1蔗糖和8 g·L-1琼脂的MS培养基上生长。培养基每2周换1次,当高山离子芥生长高度达5 cm左右时挑选长势一致的幼苗作为试验材料。
1.2 干旱胁迫(PEG)处理
用Hoagland营养液配制成含20% PEG6000的溶液浇灌高山离子芥再生苗,在20% PEG6000处理0、6、12、24、48、72 h后采取高山离子芥叶片立即液氮速冻并保存于-80 ℃以备用于提取RNA。
1.3 表油菜素内酯(24-epibrassinolide;EBR) 处理
配置0.1 μmol EBR(含有0.1%的吐温20)溶液喷洒于离子芥幼苗叶面,喷洒前先取叶片(作为对照),液氮速冻后存放于-80 ℃。每株幼苗间隔2 h喷洒1次,以叶面滴水为止,共喷洒3次。高山离子芥叶片在0.1 μmol EBR处理6、12、24、48、72、120、168 h后采摘,立即液氮速冻并保存于-80 ℃以备用于提取RNA。
1.4 高山离子芥总RNA的提取及RT-PCR
采摘高山离子芥叶片后立即液氮速冻,严格按照Trizol试剂手册说明方法进行总RNA的提取,用琼脂糖凝胶电泳检测RNA提取的质量。经RNase-Free DNase处理,去除基因组DNA,使用M-MLV反转录酶进行逆转录,按照TaKaRa公司的产品说明书RT-PCR进行操作。
1.5CbPORB中间保守区的扩增
根据Genbank中公布的拟南芥,豌豆和黄瓜植物的POR基因序列(NP_194474﹑Q01289﹑Q41249) 设计简并引物,扩增CbPORB的保守区。简并引物序列如下:上游引物P1:5′-TCACBGGVGCKTCNTCHGG-3′;下游引物P2:5′-TTGCTRTCYTTRTAHGCCTT-3′ (其中B=G/C/T;V=G/A/C; K =G/T;N=A/T/G/C;H=A/T/C;R=A/G;Y=C/T)。
以高山离子芥反转录cDNA为模板,以引物P1,P2进行PCR,PCR反应产物经1.0%的琼脂糖凝胶电泳检测,切取目的条带,用Gel Extraction Kit 回收,连接pMD19-T Vector载体,转化大肠杆菌DH5α感受态细胞,蓝白斑筛选后挑取白色菌斑,提取质粒,经PCR扩增验证为阳性克隆后测序。
1.6 cDNA末端快速扩增CbPORB基因全长序列
利用已扩增得到的中间保守区片段序列设计特异引物,3′RACE上游引物P3:5′-CAGTCATGACCCTTCAAGCTGCTTC-3′;5′RACE下游引物P4:5′-TTTCTCGAGGGCCAAGCCAACGAGCTT-3′引物序列,并按照Clontech公司的SMARTTMRACE cDNA Amplification kit使用指南进行末端扩增。扩增产物经1.0%琼脂糖凝胶电泳后,切胶纯化回收,连接pUCM-T载体,转化大肠杆菌DH5α感受态细胞,蓝白斑筛选阳性克隆,测序。
1.7 高山离子芥CbPORB生物信息学和分子进化分析
将得到的核苷酸序列进行拼接后,用DNAMAN软件,推导出氨基酸序列;对CbPORB和其他植物POR基因进行多重序列比较,建立相应的系统树;利用 www.expasy.org 网址的Computer pI/Mw Tool 软件计算高山离子芥CbPORB蛋白的等电点及其相对分子量。
1.8CbPORB原核表达载体的构建
根据CbPORB基因CDS区及pET28a质粒载体序列设计双酶切引物,分别加入BspHI和XhoI 酶切位点。CbP-B:5′-CAGTCATGACCCTTCAAGCTGCTTC-3′,(TCATGA是BspHI 酶切位点);CbP-X:5′-TTTCTCGAGGGCCAAGCCAACGAGCTT-3′,(CTCGAG是XhoI 酶切位点)。以CbP-B﹑CbP-X为引物,第一链cDNA为模板,进行PCR扩增,扩增产物用Gel Extraction Kit 回收。后用XhoI和BspHI双酶切回收产物,pET28a载体质粒用XhoI和NcoI进行双酶切(BspHI和NcoI是同尾酶,产生相同的粘性末端)。双酶切后的CbPORB基因和pET28a载体在T4DNA Ligase和PEG4000条件下进行连接,转化大肠杆菌DH5α感受态细胞,以卡那霉素为筛选压,筛选抗性菌落。对抗性克隆进行PCR扩增检测和测序检测,提取重组质粒pET-CbPORB。
1.9CbPORB基因的诱导表达
将构建好的重组质粒pET-CbPORB转化到E.coli宿主菌BL21(DE3),挑取单克隆接种到3 mL含0.05 g·L-1Kan的LB液体培养基中,37 ℃,200 r·min-1培养至OD600到0.6,加入终浓度为1 mmol·L-1的IPTG,诱导3 h 后离心收集菌体,加入20 μL 5倍样品缓冲液,沸水煮5 min 破碎菌体细胞,13 000 r·min-1离心5 min,取部分上清进行聚丙烯酰胺凝胶电泳(SDS-PAGE)检测。
1.10 RT-PCR检测CbPORB表达水平
叶片总RNA提取严格按照Trizol方法进行,用DNase去除DNA。每个样品均取1 μg总RNA,用Promega公司的PrimeScript RTase进行反转录。根据克隆得到CbPORB基因序列设计特异引物:P5:5′-TGCCTAAAGGGAGTTACACGG-3′;P6:5′-TGGCAACGCCTGTGAAACT-3′。
以高山离子芥Actin基因(基因登记号:AY825363)为内参,设计特异引物。上游引物A1:5′-GGAGCTGAGAGATTCCGTTGC-3′;下游引物A2:5′-GAAGCATTTCCTGTGGACAATCGA-3′。扩增程序如下:94 ℃预变性2 min;94 ℃变性40 s,57 ℃退火50 s,72 ℃延伸50 s,共进行30个循环;最后72 ℃延伸5 min。试验进行3次生物学重复。
1.11CbPORB器官特异性表达分析
分别从高山离子芥再生苗的叶、茎和根中提取总RNA,RNA反转录后进行RT-PCR检测,条件同上。
2 结果与分析
2.1 高山离子芥叶片总RNA的提取
提取高质量的总RNA是后续一系列工作的基础,使用Trizol试剂从高山离子芥叶片中提取总RNA,经琼脂糖凝胶电泳检测(图 1),28 S和18 S 2条带型清晰,且28 S条带亮度约是18 S条带亮度的2倍,这说明分离得到的高山离子芥叶总RNA比较完整,具有较好的质量。总RNA经RNase-Free DNase去除基因组DNA后,取1 μg进行逆转录生成第一链cDNA后用于基因克隆。

图1 高山离子芥总RNA琼脂糖凝胶电泳图
2.2CbPORB基因保守区的克隆
根据GenBank中公布的拟南芥,黄瓜,大麦的POR基因序列,设计简并引物扩增高山离子芥POR基因的保守区,得到大于500 bp的预期片段(图 2)。将目的条带切胶回收后连接到pMD19-T载体上,转化大肠杆菌DH5α感受态后,挑选阳性克隆进行测序,得到563 bp片段。
2.3 末端快速扩增法扩增5’和3’非翻译区
按照Clontech公司的SMARTTMRACE cDNA Amplification Kit使用指南设计了1对特异引物,与试剂盒提供的通用引物配对进行PCR扩增,5′RACE和3′RACE的第1轮扩增都得到了特异性较高的产物。其扩增产物经电泳检测如图3所示:5′RACE产物为泳道1、2,大小约700 bp;而3′RACE产物为泳道3、4,大小约为1 000 bp,扩增获得的片段都与预期的片断大小一致。分别以第1轮产物为模板进行第2次扩增,电泳检测得到特异条带,切胶回收后连接载体,转化后挑选阳性克隆进行测序。测序得到的5′端扩增产物是640 bp,3′端扩增产物是1 013 bp。把5′端、中间片段和3′端序列拼接后得到全长为1 444 bp的高山离子芥CbPORB(GenBank接收号为FJ390503)基因的完整cDNA序列。
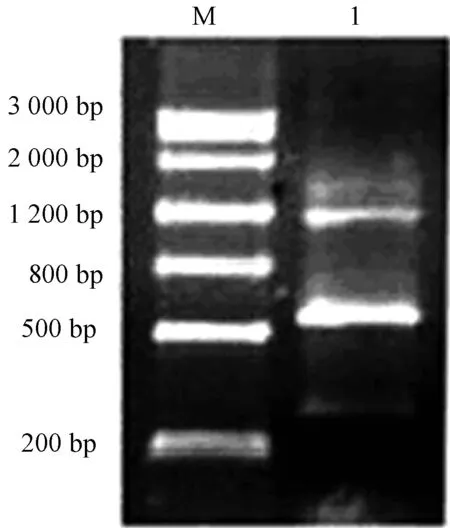
泳道M:DNA marker;泳道1:扩增的PCR产物。

泳道M:DNA marker;泳道1,2:5′RACE扩增产物;泳道3,4:3′RACE扩增产物。
Lane M is DNA marker; lane 1,2 is PCR product of 5’ RACE; lane 3,4 is PCR product of 3’ RACE.
图3 高山离子芥CbPORB基因RACE片段琼脂糖凝胶电泳图
Fig.3 Agarose gel electrophoresis of the RACE fragment ofCbPORBgene
2.4 全CDS序列的扩增
根据3′RACE和5′RACE的测序结果,设计特异引物P3,P4,PCR扩增获得约1 200 bp的目的片段(图 4)。将条带切胶回收后连接到载体,转化后挑选阳性克隆进行测序,得到CbPORB完整的CDS序列为1 209 bp。
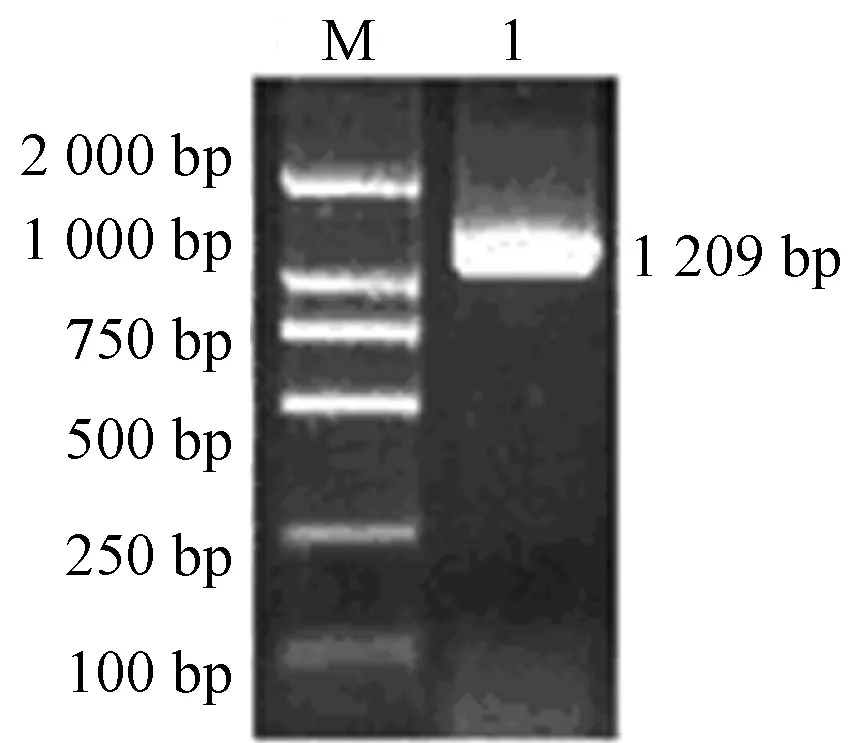
泳道M:DNA marker;泳道1:扩增的PCR产物。
2.5 高山离子芥CbPORB基因全长的特性分析
高山离子芥CbPORB基因全长1 444 bp,包含1个1 209 bp ORF,编码402个氨基酸的蛋白。起始密码子前面有54 bp长的5′非翻译区,编码区后面有181 bp包含27 bp的poly(A)的3′非翻译区(图 5)。应用生物学软件DNAMAN中的多重序列比对模块,对高山离子芥CbPORB基因与其他植物POR基因序列进行序列比对,发现高山离子芥CbPORB基因在核苷酸水平上与其他植物POR基因的同源性很高,如与豌豆POR(GenBank No.AY488758)基因同源性是72.69%,与黄瓜POR(GenBank No.NM-001280784)基因同源性是73.28%,与拟南芥PORB(GenBank No.NM118879)基因同源性最高是91.40%。而且,高山离子芥CbPORB基因编码402个氨基酸(图5),在GenBank中的登录号是ACJ12925。而且,CbPORB蛋白与拟南芥PORB蛋白(登录号是 NP_194474)的同源性高达93.78%。利用www.expasy.ory网址的Computer pI/Mw Tool软件分析得出,CbPORB蛋白相对分子量是43.37 kD,等电点是9.43。
2.6 高山离子芥CbPORB融合蛋白的诱导表达
构建好的pET-CbPORB原核表达载体转入Rosseta( DE3)表达菌株,经IPTG处理3 h,取菌液制样跑SDS-PAGE电泳检测。如图6所示,pET-CbPORB转化的大肠杆菌Rosseta诱导表达出43 kD左右的特异条带,而对照pET-28a空载体转化的大肠杆菌Rosseta在同一位置没有诱导条带产生。说明pET-CbPORB融合蛋白在大肠杆菌Rosseta中被大量诱导表达,并且表达的蛋白和用Computer pI/Mw Tool软件分析得出的CbPORB蛋白相对分子量大小相符。

图5 高山离子芥CbPORB基因cDNA核酸序列及推测的氨基酸序列
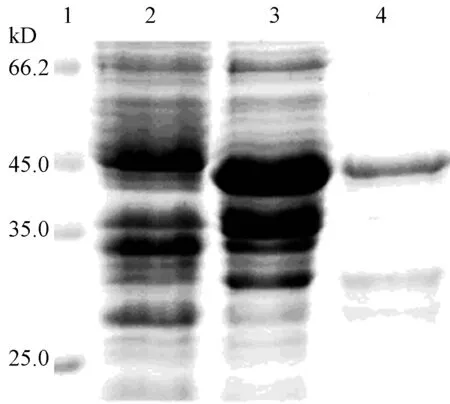
泳道1:蛋白分子Marker;泳道2:pET-28a空载体转化Rosseta后IPTG诱导;泳道3:pET-CbPORB转化Rosseta后IPTG诱导;泳道4:纯化后的CbPORB蛋白。
Lane 1: protein molecular-mass markers; lane 2: cells contained pET-28a were induced by IPTG; lane 3: cells contained pET-CbPORBwere induced by IPTG; lane 4: purified His6-PORB.
图6CbPORB融合蛋白的诱导表达和分离纯化SDS-PAGE
Fig.6 SDS-PAGE analysis of the expression and purification of His6-PORB
2.7CbPORB器官特异性表达分析
为了研究CbPORB基因在高山离子芥不同器官中的表达情况,检测了再生苗的叶,茎和根中CbPORB表达水平。结果表明:该基因主要在叶和茎中表达(图 7)。因此认为高山离子芥CbPORB基因是一个器官特异性表达基因。我们的研究结果与OOSAWA等[14]和KURODA等[15]一致,他们分别在拟南芥和黄瓜中研究发现,POR是与光合作用密切相关的器官特异性表达基因,其在成熟、光适应植物的所有光合器官(除了根)中均表达。
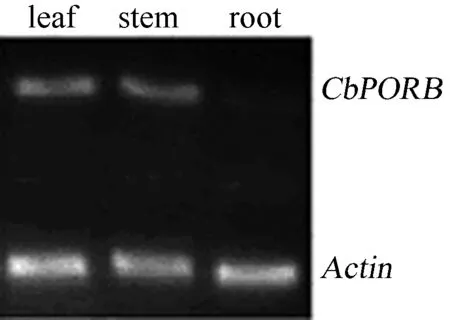
图7 高山离子芥CbPORB基因器官特异性表达分析
2.8 PEG处理对CbPORB表达水平的影响
高山离子芥CbPORB对干旱胁迫非常敏感,在PEG处理12 h之后,其表达水平明显下降(图8)。

A:CbPORB;B:Actin作内参
2.9 EBR处理对CbPORB表达水平的影响
外源EBR处理高山离子芥叶片提高了CbPORB的表达水平(图9)。CbPORB表达水平在EBR处理24 h显著上升,直到处理的第5天,CbPORB表达水平仍比对照高,但到第7天时恢复到处理前的水平。
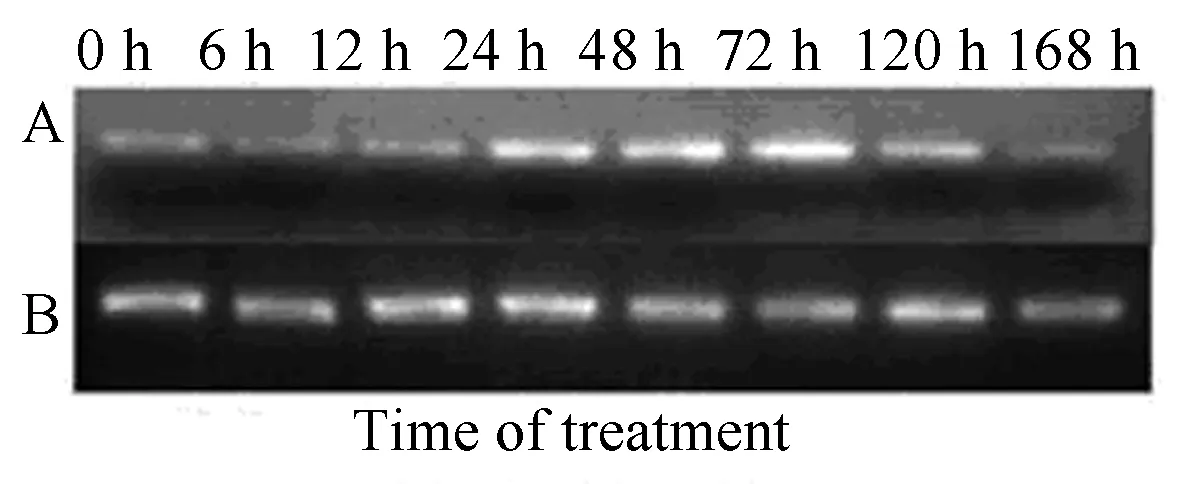
A:CbPORB;B:Actin作内参
3 讨论
本研究表明高山离子芥叶片在4 ℃条件下处理6 h,其CbPORB的水平也明显降低[16]。另外,SONOIKE[17]研究报道:低温处理黄瓜幼苗导致叶片中的POR基因水平显著下降。YANG等[18]也报道,冷处理绿豆幼苗严重抑制了POR基因的表达水平,并导致Chl含量明显下降。MOHANTY等[19]用热(42 ℃)胁迫处理小麦幼苗研究发现,其叶片中POR蛋白含量显著下降。TALAAT[20]通过RNAi方法对烟草叶片中的POR基因进行沉默,造成叶片中Pchlide大量积累、Chl完全消失。由此可以看出:在以上所研究的各种植物中,决定叶绿素合成的关键酶基因POR在干旱、低温、高温胁迫、人为干扰条件下其表达水平均降低,进而影响植物的生长发育。
BRs可促进植物的光合作用,维持较高的Chl含量,提高叶片的净光合速率,还可促进光合产物的运输。YU等[21]研究发现,用EBR处理黄瓜幼苗后,增强了叶片的光合作用、提高了Chl含量。他们推测很可能是EBR对色素蛋白复合物有保护作用,从而致使Chl的降解减少。LI等[22]研究结果表明,分别对在正常生长和干旱胁迫处理下的高山离子芥幼苗叶片喷施EBR后,其Chl含量都比相应对照叶片中的高,且生长表型有明显改观。同时,BR还可提高核酸、蛋白质的合成代谢[23]。本研究证明,外源EBR提高了CbPORB的表达水平,推测相应的CbPORB蛋白浓度也会相应升高,在光照条件下,就可以使较多的Pchlide还原成Chlide,进一步合成较多的Chl,改善植物生长发育状况。这个研究结果很可能为EBR能促进植物的光合作用和提高Chl含量提供了较直接的证据。
[1] GRIFFITHS T W.Reconstitution of chlorophyllide formation by isolated etioplast membranes[J].Biochem J,1978,174(3):681-692.
[2] APEL K,SANTEL H J,REDLINGER T E,et al.The protochlorophyllide holochrome of barley isolation and characterization of the NADPH:protochlorophyllide oxidoreductase[J].Eur J Biochem,1980,111(1): 251-258.
[3] SCHOEFS B,FRANCK F.Protochlorophyllide reduction: mechanisms and evolutions[J].Photochem Photobiol,2003,78(6): 543-557.
[4] MASUDA T,TAKAMIYA K.Novel insights into the enzymology,regulation and physiological functions of light-dependent protochlorophyllide oxidoreductase in angiosperms[J].Photosynth Res,2004,81(1): 1-29.
[5] RASKIN V I,SCHWARTZ A.Experimental approach to elucidating the mechanism of light-independent chlorophyll biosynthesis in greening barley[J].Plant Physiol,2003,133: 25-28.
[6] HARPSTER M,APEL K.The light-dependent regulation of gene expression during plastid development in higher plants[J].Physiol Plant,1985,64(2): 147-152.
[7] ARMSTRONG G A,RUNGE S,FRICK G,et al.Identification of NADPH-protochlorophyllide oxidoreductases A and B: a branched pathway for light dependent chlorophyll biosynthesis inArabidopsisthaliana[J].Plant Physiol,1995,108(4): 1505-1517.
[8] BARNES S A,NISHIZAWA N K,QUAGGIO R B,et al.Far-red light blocks greening ofArabidopsisseedlings via a phytochrome A-mediated change in plastid development[J].Plant Cell,1996,8: 601-615.
[9]HOLTORF H,REINBOTHE S,REINBOTHE C,et al.Two routes of chlorophyllide synthesis that are differentially regulated by light in barley (HordeumvulgareL.) [J].Proc Natl Acad Sci USA,1995,92(8): 3254-3258.
[10]KURODA H,MASUDA T,FUSADA N,et al.Expression of NADPH-protochlorophyllide oxidoreductase gene in fully green leaves of cucumber[J].Plant Cell Physiol,2000,41(2): 226-229.
[11]CHORY J,REINECKE D,SIM S,et al.A role of cytokinins in de-etiolation inArabidopsis(det mutants have an altered response to cytokinins)[J].Plant Physiol,1994,104(2): 339-347.
[12]阿依吐尔汗,谭敦炎,李志军,等.高山离子芥营养器官的结构与环境的关系研究[J].新疆农业大学学报,1998,21(4): 21-25.
[13]安黎哲,刘艳红,冯国宁,等.乌鲁木齐河源区高寒冰缘植被的生态特征研究[J].西北植物学报,2000,20(1): 98-105.
[14]OOSAWA N,MASUDA T,AWAI K,et al.Identification and light-induced expression of a novel gene of NADPH:protochchlorophyllide oxidoreductase isoform inArabidopsisthaliana[J].FEBS Lett,2000,474(2-3): 133-136.
[15]KURODA H,MASUDA T,FUSADA N,et al.Expression of NADPH-protochlorophyllide oxidoreductase gene in fully green leaves of cucumber[J].Plant Cell Physiol,2000,41(2): 226-229.
[16]LI Y H,SUN Z L,XU X L,et al.Influence of low temperatures on photosystem II photochemistry and expression of the NADPH:protochlorophyllide oxidoreductase in the alpine,subnival perennial,Chorisporabungeana[J].Photosynthetica,2010,48 (3): 457-468.
[17]SONOIKE K.Photoinhibition of photosystem I: Its physiological significance in the chilling sensitivity of plants[J].Plant Cell Physiol,1996,37(3): 239-247.
[18]YANG M T,CHEN S L,LIN C Y,et al.Chilling stress suppresses chloroplast development and nuclear gene expression in leaves of mung bean seedlings[J].Planta,2005,221(3): 374-385.
[19]MOHANTY S,GRIMM B,TRIPATHY B C.Light and dark modulation of chlorophyll biosynthetic genes in response to temperature[J].Planta,2006,224(3): 692-699.
[20]TALAAT NB.RNAi based simultaneous silencing of all forms of light-dependent NADPH:protochlorophyllide oxidoreductase genes result in the accumulation of protochlorophyllide in tobacco (Nicotianatabacum)[J].Plant Physiol Biochem,2013,71: 31-36.
[21]YU J Q,HUANG L F,HU W H,et al.A role for brassinosteroids in the regulation of photosynthesis inCucumissativus[J].J Exp Bot,2004,55(399): 1135-1143.
[22]LI Y H,LIU Y J,XU X L,et al.Effect of 24-epibrassinolide on drought stress-induced changes inChorisporabungeana[J].Biol Plantarum,2012,56(1): 192-196.
[23]KHRIPACH V,ZHABINSKII V,GROOT A D,Twenty years of brassinosteroids: steroidal plant hormones warrant better crops for the XXI century[J].Annals of Botany,2000,86: 441-447.
(责任编辑:朱秀英)
Cloning of NADPH: protochlorophyllide oxidoreductase by rapid amplification of cDNA ends and its developmental expression inChorisporabungeana
LI Yuhua1, DENG Peiyuan2, ZHAO Qi1, LEI Zhihua1
(1.School of Life Sciences, Zhengzhou Normal University, Zhengzhou 450044, China; 2.Museum of Natural History, Zhengzhou Normal University, Zhengzhou, 450044, China)
A NADPH:protochlorophyllide oxidoreductase (POR) gene was obtained by 5′-and 3′-RACE (rapid amplification of cDNA ends) PCR inChorisporabungeana. The gene was termed asCbPORB(GenBank Accession No.FJ390503) and showed high homology to POR cDNA sequences from related species analyzed with DNAMAN software. The full-length cDNA sequence ofCbPORBis 1 444 bp containing a 1 209 bp ORF, which encoded a predicted protein of 402 amino acid residues (GenBank Accession No.ACJ12925) with a theoretical molecular weight of 43.37 kD, and the isoelectric point is 9.43 examined using iPSORT. Furthermore, by semi-quantitative RT-PCR,CbPORBexpression was detected in leaves and stems, but not in roots, thereby demonstrating that this gene is of organ-specific expression patterns;CbPORBtranscript was inhibited by drought stress; but was induced by 24-epibrassinolide.
rapid amplification of cDNA ends;CbPORB;semi-quantitative reverse transcription and polymerase chain reaction;Chorisporabungeana
2014-08-21
国家自然科学基金项目(90302010);国家杰出青年基金项目(30625008)
李玉华(1980-),女,河南濮阳人,讲师,博士,主要从事植物生理生态和分子生物学方面的研究。
1000-2340(2015)03-0374-06
Q943.2
A
