小麦穗发育障碍的遗传及cDNA-AFLP分析
2015-07-01韩亚利程西永谢科军张艳林朱保磊詹克慧
韩亚利,任 妍,程西永,谢科军,张艳林,朱保磊,詹克慧
(河南农业大学农学院,河南 郑州 450002)
小麦穗发育障碍的遗传及cDNA-AFLP分析
韩亚利,任 妍,程西永,谢科军,张艳林,朱保磊,詹克慧
(河南农业大学农学院,河南 郑州 450002)
在2个杂交组合周麦16/豫农2593和豫农2593/新麦9号的F2群体中,发现小麦穗发育障碍植株。该植株所有的穗发育障碍,小穗变长,小穗数减少,且排列间距明显增大,花药瘪瘦,花丝稀疏不伸长,不能正常开花,雌蕊发育萎缩,且这些性状在世代间可稳定遗传。对2个组合F3∶4和F4∶5分离株系中穗发育正常植株和穗发育障碍植株进行统计,比例均符合3∶1,表明穗发育障碍是由1对隐性等位基因控制的,并非受环境的影响。利用cDNA-AFLP技术,通过109对引物组合对正常型和发育障碍型材料在幼穗分化的单棱期和二棱期的表达谱进行分析,共获得17 486个转录衍生片段(TDF),其中有20个TDFs在正常型和障碍型之间表现出差异。对这些差异TDFs进行克隆测序并利用生物信息学比对分析后发现,有10个TDFs与已知功能的基因具有高度相似性,功能主要涉及胁迫响应、细胞和组织代谢、促进转运、表达调节以及信号转导等;有6个TDFs与功能未知的基因相似性较高;其余4个TDFs未匹配到序列相似性,可能是一些新的基因。
小麦; 穗发育障碍; 性状表现; 遗传分析; cDNA-AFLP; 生物信息学
小麦是中国的主要粮食作物之一,随着耕地资源不断减少,进一步提高小麦品种的产量潜力对提高小麦产量至关重要,也关系到国家的粮食供需平衡和安全。从河南省的育种情况看,小麦的穗粒数对产量的影响越来越大,已成为品种产量潜力突破的瓶颈[1],因此,研究小麦穗部发育及其相关基因对提高小麦品种的产量潜力极为重要。前人对小麦穗部发育的研究多集中在栽培和生理方面,如通过外源激素对温光敏型核不育小麦育性的研究[2],发现在育性敏感期用外源IAA,GA3和ABA处理温光敏核雄不育小麦的不育株和可育株,花粉育性和自交结实率都有不同程度提高,且降低不育植株的不育度,提高可育植株的可育度。朱云集等[3]研究认为,拔节期、孕穗期施氮可延长穗花发育的时间,减少穗花退化,增加穗粒数;发育中后期施氮还可以提高小麦生育后期的光合速率,延长灌浆高峰期的时间,显著提高粒重和子粒产量。小麦缺乏微量元素锌、铁、硒时,其生长发育和产量都会受到不同程度的影响[4]。春季低温导致冬小麦不育小穗数增加,穗粒数明显减少,粒重降低[5]。在遗传研究方面,前人曾报道了多效基因SDA1,该基因使小麦的抽穗期延迟,花器官发育畸形且影响植株的糖分转化与利用[6]。DISTELFELD等[7]研究了春化基因VRN1,VRN2,VRN3以及光周期基因PPD1之间的相互作用机制以及它们如何调控小麦、大麦的开花期。还有一种特殊类型的小麦材料三粒小麦,这种小麦的雌蕊有3个柱头,在1个小花内可以结3粒种子[8],这种结实特点和花器官组成的小麦势必会在选育高产小麦品种、杂种优势利用和研究植物花器官发育等方面提供帮助。有关穗发育研究方面,对水稻类似控制生长发育基因的研究较多。文雯等[9]曾报道了一个由1对隐性等位基因控制的水稻双子房突变体TOR。该突变体表现为植株矮化且高度不育,通过编码F-box蛋白来调控水稻营养生长与生殖发育的基因AP01[10]。其突变体的穗明显短小、心皮畸形、雄蕊转化为浆片。还有基因DDF1[11]的突变导致水稻植株矮化、花器官变异。该基因编码的F-box 蛋白同时控制水稻营养生长和生殖发育[12]。综合以上研究结果,作为产量形成重要器官的穗,其发育的遗传机制研究较少,一方面是由于穗的发育过程和遗传机制可能比较复杂,另一方面也缺乏相应的遗传材料,因此,发掘更多穗发育的相关基因有助于揭示穗发育的遗传机制。2010年在河南农业大学小麦育种后代圃中发现2个杂交组合的F2代出现了一些穗发育障碍的植株,大约占到10%,这些植株小穗排列间距明显增大,小穗数减少,整株小花发育障碍,雌蕊育性严重降低,雄性高度不育,收获F2代部分正常植株种植后,次年发现部分F2∶3家系也出现这种现象,表现出能够稳定遗传。为了进一步了解该穗发育障碍材料的遗传特点,对这两个杂交组合后代的障碍株和正常株进行了表型差异和遗传分离研究,并运用cDNA-AFLP技术对控制该小麦穗发育障碍的相关基因进行差异表达分析。
1 材料与方法
1.1 试验材料
所用材料为出现小麦穗发育障碍植株的杂交组合周麦16/豫农2593和豫农2593/新麦9号的F3∶4和F4∶5家系。
1.2 田间试验与调查
田间试验于2011—2012年度和2012—2013年度在河南农业大学郑州科教试验园区进行。2011—2012年度,选取2个杂交组合上年度出现表现型差异的F2∶3家系中的正常株种子种植,各种植4行,行长1 m,行距23 cm,单粒点播,株距10 cm,并从各组合均选取10个分离株系,每个株系从小区中间区域随机选取5株穗发育障碍株和5株正常株,调查株高、穗长、脖长、穗下节长、旗叶长、旗叶宽、小穗数和单株穗数等性状,并计算小穗排列密度(小穗数/穗长)。2012—2013年度,选取2个杂交组合上年度出现基因分离的F3∶4家系中的正常株种子种植,每个单株种植6行,行长1 m,行距23 cm,单粒点播,株距10 cm。小麦抽穗后,观察各株系的表型分离情况,并调查各分离株系中正常株和障碍株的株数。
1.3 数据分析
将每个株系中的5株穗发育障碍株和5株正常株分别计算平均数,然后采用配对的t测验方法进行性状差异分析。遗传分离比例的确定采用卡方测验方法。数据分析是利用Excel进行的。
1.4 cDNA-AFLP分析
根据小麦发育的外部形态指标,确定小麦穗发育的时期,于2013年3月随机选取周麦16/豫农2593和豫农2593/新麦9号2个杂交组合的F4∶5代群体中穗轴节片原基分化期和小穗原基分化期即单棱期和二棱期的小麦幼穗,由于此时正常株与障碍株无法在形态上分离,取穗时依据行号进行挂牌标记,抽穗以后进行调查验证。取回的幼穗在冰上迅速剥离(保持其幼穗活性,减少RNA的降解),并盛于对应标记的1.5 mL离心管中,液氮速冻,-80 ℃冰箱保存备用。待小麦抽穗之后,在2013年5月对正常植株与障碍植株的表现型进行鉴定,并将同一杂交组合的正常幼穗与障碍幼穗分别进行混合,为总RNA提取做准备。
1.4.1 样品总RNA提取和双链cDNA的合成 参照产品说明书,用TRIzol试剂盒(Invitrogen)提取各材料的总RNA。经过琼脂糖变性胶进行总RNA浓度和质量检测后,利用双链cDNA合成试剂盒(TaKaRa)合成双链cDNA。
1.4.2 双链cDNA纯化浓缩、限制性双酶切和接头连接 采用酚/氯仿/异戊醇(25∶24∶1)溶液纯化双链cDNA,无水乙醇沉淀后浓缩,加适量的灭菌蒸馏水,依据A260值将对照和各种低磷处理的双链cDNA含量调整至相同浓度。常规方法进行MseI和PstI限制性双酶切。其后,在反应体系中加入1 μL的T4 DNA连接酶,PstI接头和MseI接头各1 μL,以及1 μL 10×T4连接酶缓冲液,进行接头连接。其中,MseI接头序列为5’-GACGATGAGTCCTGAG-3’(正向)和5’-TACTCAGGACTCAT-3’(反向);PstI接头序列为5’-CTCGTAGACTGCGTACATGCA-3’(正向)和5’-TGTACGCAGTCTAC-3’(反向)。
1.4.3 cDNA-AFLP预扩增和选择性扩增 参照DAE等[13]的方法,将完成限制性双酶切和连接接头的产物进行预扩增。预扩增反应的热循环程序为95 ℃下2 min,随后为30个循环过程,每个循环中包括95 ℃变性30 s,56 ℃退火30 s和72 ℃延伸1 min。完成后将预扩增产物于4 ℃保存。其中,用于预扩增反应的引物为M00(5’-GATGAGTCCTGAGTA-3’)和P00(5’-AGACTGCGTACATGCAG-3’ ),分别与MseI和PstI的接头序列相匹配。选用12条M引物和15条P引物进行选择性扩增。其中,12条M引物分别与MseI的预扩增引物匹配,15条P引物分别与PstI的预扩增引物匹配,但上述引物的3’端较预扩增引物均增加3个随机碱基。每条M引物分别与P引物进行组合,共有180个引物对组合,但其中有71对扩增效果不理想,最终选用了109对引物组合进行聚丙烯酰胺凝胶电泳分析。用于选择性扩增的M引物和P引物如表1所示。cDNA-AFLP 的选择性扩增程序为95 ℃下5 min后进行13个下述热反应循环;95 ℃变性30 s,65 ℃退火30 s,72 ℃延伸60 s,13个循环,每个循环降0.7 ℃;95 ℃变性30 s,56 ℃退火30 s,72 ℃延伸60 s,24个循环;72 ℃保温10 min。不同材料的各引物组合均重复4次。
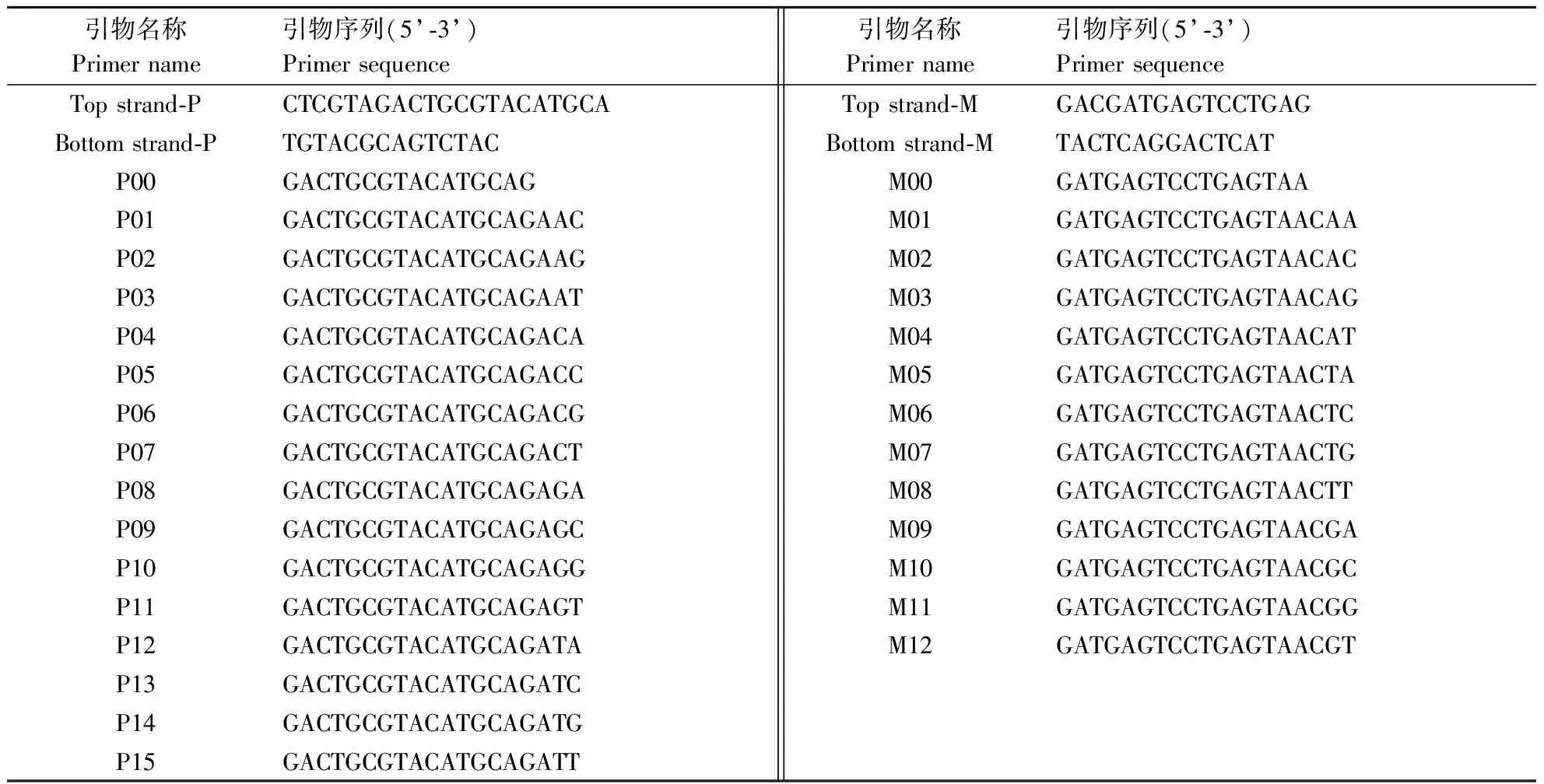
表1 cDNA-AFLP预扩增与选择性扩增引物
1.4.4 cDNA-AFLP产物的聚丙烯酰胺凝胶电泳及银染显影 参考郑宏远等[14]的方法进行聚丙烯酰胺凝胶电泳、染色和显影。室温下自然干燥胶板,拍照进行数据保存。
1.4.5 差异条带的PCR扩增和克隆 用刀片从聚丙烯酰胺凝胶上切下重复间稳定一致的差异条带,置于1.5 mL离心管中,加100 μL蒸馏水,以96 ℃处理10 min,12 000 r·min-1离心20 min后,吸取上清液100 μL作为再次PCR扩增反应的模板。PCR反应体系及程序与前述选择性扩增相同,其中,各TDF再次扩增时选用的引物,与cDNA-AFLP中鉴定该特异表达TDF的引物一致。PCR产物经1.0%琼脂糖凝胶电泳检测后,进行二次胶回收,回收产物与pMD19-T载体(上海sangon)连接,转化感受态大肠杆菌菌株DH5α。菌液PCR无误后进行测序(上海Sangon),获得TDF序列。
2 结果与分析
2.1 小麦穗发育障碍植株的形态特征和育性表现
在小麦抽穗后对穗发育障碍的植株观察后发现(图1-a ~ b),与正常植株相比,障碍植株的所有麦穗均发育异常,抽穗稍晚,小穗变长且排列间距明显增大,小穗数减少。在偏光显微镜(Nikon Eclipse Soi)下观察发现(图1-c, 1-d, 1-e),障碍株植株的花药发育障碍,花药瘪瘦且畸形,花丝稀疏不伸长,不能正常开花,雌蕊发育萎缩。连续2 a利用其与多个亲本进行了人工杂交授粉,作为父本均没有得到杂交种子,作为母本绝大多数杂交穗没有得到杂交种子,偶有杂交穗结1粒种子,对其剪去部分颖壳进行开放授粉也是类似结果,说明其花粉完全败育和雌蕊高度不育。

注:a. 抽穗表现;b.穗部形态特征;c.雄蕊形态特征;d.正常植株雌蕊形态特征;e.障碍植株雌蕊形态特征。
2.2 小麦穗发育障碍植株和正常植株的性状差异
为了搞清穗发育障碍对小麦生长发育的影响,对2个杂交组合的F3∶4分离株系的穗发育障碍植株和正常植株的部分性状进行了比较分析(表2)。从表2可以看出,杂交组合周麦16/豫农2593的穗发育障碍植株与正常植株在株高、穗长、脖长、穗下节长、旗叶长、旗叶宽、小穗数、小穗密度都存在极显著差异,杂交组合豫农2593/新麦9号的穗发育障碍植株与正常植株在穗长、脖长、穗下节长、旗叶长、小穗数、小穗密度都存在极显著差异,在株高上存在显著性差异,2个杂交组合小穗数和小穗排列密度的差异显著程度明显高于其他性状。障碍植株与正常植株相比,株高、穗长、脖长、穗下节长降低,旗叶变长,主要是小穗数和小穗密度降低特别明显,而单株穗数变化不大。

表2 小麦F3∶4代中障碍株与正常株性状差异比较
注:*为障碍株减去正常株的差值。
Note: *means the difference between abnormal plants and normal plants.
2.3 小麦穗发育障碍基因的遗传分析
为了研究该穗发育障碍的遗传机制,对2个组合的F3∶4和F4∶5群体进行了穗发育障碍株和正常株的调查(表3)。在杂交组合周麦16/豫农2593中,调查了31个F3∶4代分离株系和22个F4∶5代分离株系,F3∶4代共1 071株,其中797株表现正常,274株表现障碍,经卡方测验,符合3∶1的分离比例;F4∶5代共1 738株,正常植株有1 309株,障碍植株有429株,也符合3∶1的分离比例。在杂交组合豫农2593/新麦9号的中,调查了22个F3∶4代分离株系和27个F4∶5代分离株系,F3∶4代共706株,其中530株表现正常,176株表现障碍,经卡平方测验,符合3∶1的分离比例;F4∶5代共982株,正常植株有721株,障碍植株有261株,也符合3∶1的分离比例。综合上述结果表明,该性状是由1个隐性单基因控制的。
对周麦16/豫农2593杂交组合F3∶4代的797个正常单株进行F4∶5代株系鉴定,有520个株系发生分离,277个株系不出现分离,符合2∶1的分离比率(P=0.416)。对豫农2593/新麦9号杂交组合F3∶4代的482个正常单株进行F4∶5代株系鉴定中,有310个株系发生分离,172个株系不出现分离,符合2∶1的分离比率(P=0.295)。这一结果也表明该性状是由单基因控制的。
结合对2个杂交组合的F3∶4和F4∶5群体鉴定结果,说明小麦穗发育障碍是受隐性单基因控制的。

表3 小麦穗发育障碍株和正常株的遗传分离统计分析
2.4 小麦穗发育障碍基因的cDNA-AFLP分析
2.4.1 穗发育障碍基因表达相关的差异TDFs的cDNA-AFLP分析 为了寻找引起穗发育障碍的基因,利用cDNA-AFLP的技术对穗发育障碍植株和正常植株的表达谱进行研究。在幼穗分化的单棱期和二棱期从周麦16/豫农2593和豫农2593/新麦9号的F4∶5代群体随机选取障碍植株与正常植株,通过109对MseI和PstI酶切引物组合对2个杂交组合2种表现型小麦的2个分化时期分别进行聚丙烯酰胺凝胶电泳分析,共观测到17 486条清晰可见的片段,如图2所示,是P14M8和P14M9引物的扩增结果,每1对引物扩增8个试验材料,其中正常型与发育障碍型各4个重复,平均每一泳道可以获得20.1条片段。其中26个TDFs在障碍植株与正常植株间表现出差异,扩增片段的长度分布为100~550 bp,将这26个差异TDFs分为6种类型(表4),既有有带和无带的差异,也有转录产物量的差异。将扩增产物根据基因表达差异分为以下3类:(1)Ⅰ和Ⅱ类型在正常株与障碍株的2个分化时期都存在差异,说明这类基因可能在穗分化早期即开始表达,并持续表达了几个时期,占差异条带总数的30.77%,这类基因在正常型中表达,即类型Ⅱ有6个,在障碍型中表达,即类型Ⅰ有2个;(2)Ⅲ和Ⅵ类型只在正常株或障碍株的单棱期存在差异,说明这类基因可能表达得较早,但在穗发育的过程中由于某些原因表达抑制了,占差异条带总数的30.77%,这类基因在正常型中,即类型Ⅲ有5个,在障碍型中表达,即Ⅵ有3个;(3)Ⅳ和Ⅴ类型只在正常株或障碍株的二棱期存在差异,说明这类基因可能在穗发育前期没有表达,随着穗分化的进行,在单棱期到二棱期的过渡时期开始表达,其中,在正常型中表达,即Ⅳ有9个,在障碍型中表达,即Ⅴ有1个。

注:A.正常植株二棱期;B.正常植株单棱期;a.障碍植株二棱期;b.障碍植株单棱期;1.重复1;2.重复2 。
Note: A.The double ridge stage of the normal spike; B.The single ridge stage of the normal plants; a. Two ridge stages of the abnormal plants; b. Single ridge stage of the abnormal plants; 1&2. Two replicates.
图2 小麦穗发育调控基因cDNA-AFLP电泳结果
Fig.2 Representative electropherograms of cDNA-AFLP revealing the differential fragments between the abnormal and normal spikes in common wheat

表4 穗发育障碍基因表达相关的差异TDFs的带型分类
2.4.2 穗发育障碍基因表达相关的差异TDFs的克隆、测序及同源性分析 为了研究穗发育障碍和正常之间的差异基因,对cDNA-AFLP所检测的差异条带进行回收、克隆和测序,成功获得20个TDFs,其大小及所属类型见表5。Blastx结果表明,匹配到已知确切功能的差异TDFs有10个,占成功回收差异片段总数的50.00%;6个TDFs与未知功能或假定的蛋白有较高同源性,占成功回收差异片段总数的30.00%;4个TDFs未找到序列同源性,可能是一些尚未被发现的新基因。
2.4.3 小麦穗发育障碍基因表达相关的差异TDFs的功能分类 把分析得到的20个已知确切功能的差异TDFs按功能分成以下7类:胁迫响应、细胞和组织代谢、促进转运、表达调节、信号转导、未知功能以及无同源性等,每一类所包含的TDFs编号见表6。
在这些TDFs中,有许多TDFs的功能可能与植物的生长发育相关。如P1M5同二穗短柄草的E3泛素蛋白连接酶RIN2-like基因相似,前人研究发现,水稻粒宽和粒重GW2基因编码一个未知的RING型E3泛素连接酶[15],将其底物锚定到蛋白酶体进行降解,从而负调节细胞的分裂,GW2 的WY3等位基因显著地增加粒宽和千粒重,从而增加单株产量,该等位基因同时也能增加每株穗数、延长生育期,并显著地降低每穗粒数和主穗长度,P1M5可能对小麦的子粒发育也存在影响。P1M8与ARF-GAPs基因的功能相似,而最近研究结果表明,AGDs 在激素信号、极化细胞生长及器官分裂过程中具有重要的意义[16-18]。辣椒中CaAGD8基因在茎、叶、花组织中均为上调表达,而在根中的表达量下降,这表明CaAGD8 基因可能在辣椒的发育过程中发挥了一定的作用[19]。玉米的DSC1基因也编码了一个ARF-GAP蛋白,该基因导致玉米发育迟缓,籽粒皱缩,组织退化[20]。推测P1M8可能是影响小麦穗发育的一个关键基因。P4M8-2与水稻中的RNA甲基转移酶同源性较高,近年来, 研究已经发现RNA介导的染色质水平的基因沉默涉及植物的生长发育、胁迫应答、表观遗传多态性, 并对植物的表型多样化、生理适应性以及植物进化具有显著影响[21]。

表5 小麦穗发育障碍基因表达相关的cDNA片段

表6 小麦穗发育障碍基因表达相关的差异TDFs的功能分类
3 结论与讨论
本研究发现,导致穗发育障碍的基因是由1对隐性基因控制的,该基因在纯合隐性状态下,主要表现为穗部和小花发育障碍,导致小穗数减少以及小穗密度降低,花粉完全败育,雌蕊高度不育。尽管对抽穗期、植株株高、穗下节长、脖长和旗叶大小等性状也产生影响,但可能都是穗发育障碍对抽穗进程产生影响引起的,该基因本身不控制这些性状的遗传。由于该基因是在2个杂交组合中发现的,但由于突变概率极低,不可能同时发生类似的突变,所以,该突变应该是在杂交亲本中存在或发生的。从2个杂交组合的亲本看,有共同亲本豫农2593,可以推断该基因来源于该材料。豫农2593是河南农业大学小麦育种课题组选育的一个高代稳定品系,由于是隐性突变,纯合隐性不能结实,不易被发现,一旦某个杂合单株与其他亲本进行了杂交,在F2代中就会分离出大量隐性纯合单株,这是该突变被发现的主要原因。通过从后代中建立纯合隐性和显性混合池进行分子标记检测,没有检测到紧密连锁的分子标记,推断该材料可能在某个基因位点产生突变。
本研究利用cDNA-AFLP技术分析,获得了20个TDFs在穗发育正常型和障碍型之间表现出差异,其中有10个TDFs与已知功能的基因具有高度相似性,功能主要涉及胁迫响应、细胞和组织代谢、促进转运、表达调节以及信号转导等,有6个TDFs与功能未知的基因相似性较高,其余4个TDFs未匹配到序列相似性。大部分TDFs的功能都是与细胞和组织代谢相关的,因此,推测小麦穗发育障碍的机制可能是关键基因通过调节细胞数目或改变细胞形态,或是影响跨膜运输作用,从而影响了细胞分化的速度,导致性状差异,当然,这一推断还有待于进一步验证。由于关键基因对小麦幼穗分化及发育有明显影响,因此,搞清其遗传机制有助于阐明其等位正常基因的重要功能,以期在作物改良和遗传研究中得以更好利用。
植物中广泛存在控制其生长发育的多效基因,且分别在不同水平起着调控作用。水稻中发现的AP01基因与该基因有相似之处,突变均导致穗部发生变异,现已研究表明,AP01编码的F-box蛋白在植物光形态建成、自交不亲和、生物钟节律、花和叶片发育等方面发挥着重要作用[22]。TOB1基因编码的YABBY蛋白,在调控水稻叶片中脉发育的同时还控制着花器官分化[23,24]。在小麦中,发现一种穗部发育萎缩且花器官明显退化,但茎叶等其他器官发育正常的突变体sda1,遗传分析表明,该基因是由1对隐性基因控制的,并定位于小麦6B染色体上,在标记WMC398和BARC136之间,与两标记的遗传距离分别为2.2和2.1 cM,该基因使小麦的抽穗期延迟,花器官发育畸形且影响着植株的糖分转化与利用[6]。sda1基因与本试验中发现的调控小麦穗发育基因功能相似,都是对小麦穗部发育产生了明显影响,但对比形态特征,sda1基因对小麦抽穗期和穗长影响较大,穗长只有正常的1/2左右,而本研究发现的基因影响较小,抽穗期稍晚,2个组合的穗长分别值减少0.72和0.53 cM,应该属于不同的基因。
cDNA-AFLP是一种将RT-PCR和AFLP技术相结合、从转录水平上研究基因表达差异的技术,该技术被广泛用于植物抗病、抗逆、生长发育等研究领域[25-28]。本研究利用cDNA-AFLP技术分析了小麦穗部发育基因的表达差异,结果不仅表明cDNA-AFLP技术在目的基因研究上的可行性,而且表明小麦穗分化是一个复杂多控的发育过程。扩增结果表明,存在3种差异表达类型基因,综合这3种类型基因可以看出,不同基因在小麦穗发育的不同时期其表达及表达量存在差异,在这个复杂的过程中,它们共同调控小麦的穗分化。
[1] 刘朝辉,李江伟,蒋志凯,等. 河南省小麦区试品种(系)产量与产量构成因素的相关和通径分析[J].山东农业科学,2013,45(9):26-28; 32.
[2] 杨海燕,宗学凤,余国东,等.激素调控对小麦温光敏核不育系育性转换的影响[J].西南农业大学学报,2006,28(3): 369-372.
[3] 朱云集,崔金梅,王晨阳,等.小麦不同生育时期施氮对穗花发育和产量的影响[J].中国农业科学,2002,35(11): 1325-1329.
[4] 鲁 璐,吴 瑜.3种微量元素对小麦生长发育及产量和品质的影响研究进展[J].应用与环境生物学报,2010,16(3): 435-439.
[5] 刘 璇,王瑞丽,周 伟,等.春季低温对冬小麦穗部发育和粒重的影响[J].河南农业大学学报,2013,47(4): 373-380.
[6] 宋全昊,刘路平,李法计,等.小麦穗部发育多效基因的遗传分析与基因定位[J].西北植物学报,2013,33(4): 643-648.
[7] DISTELFELD A,LI C,DUBCOVSKY J.Regulation of flowering in temperate cereals[J].Plant Biology,2009,12(2): 178-184.
[8] 王宏霞,王志国,樊小莉,等.三粒小麦与甘麦8号亲缘关系的SSR标记分析[J].麦类作物学报,2012,32(2): 229-233.
[9] 文 雯,李双成,王世全,等.一个水稻双子房突变体的表型鉴定和遗传分析[J].中国水稻科学,2007,21(3): 253-258.
[10]IKEDA K,ITO M,NAGASAWA N,et al.Rice ABERRANT PANICLE ORGANIZATION 1,encoding an F-box protein,regulates meristem fate[J].The Plant Journal,2007,51(6):1030-1040.
[11]李生平,段远霖,陈志伟,等.水稻生长发育多效基因DDF1的遗传分析与基因定位[J].遗传,2011,33(12): 1374-1379.
[12]DUAN Y L,LI S P,CHEN Z W,et al.Dwarf and deformed flower 1,encoding an F-box protein,is critical for vegetative and floral development in rice(OryzasativaL.) [J].The Plant Journal,2012,72(5):829-842.
[13]DAE Y K,MIN J H,JI H J,et al.,cDNA-AFLP analysis reveals differential gene expression in response to salt stress inBrachypodiumdistachyon[J].Genes & Geno-mics,2012,34(5): 475-484.
[14]郑宏远,任 妍,吴少辉,等.小麦K型不育系育性恢复基因的cDNA-AFLP分析[J].河南农业大学学报,2014,48(2): 117-122.
[15]SONG X J,HUANG W,SHI M,et al.A QTL for rice grain width and weight encodes a previously unknown RING-type E3 ubiquitin ligase[J].Nature Genetics,2007,39(5): 623-630.
[16]ZHUANG X L,JIANG J F,LI J H,et al.Over-expression of OsAGAP,an ARF-GAP,interferes with auxin influx,vesicle trafficking and root development[J].The Plant J,2006,48(4): 581-591.
[17]YOO C M,WEN J Q,MOTES C M,et al.A class I ADP-ribosylation factor GTPase-activating protein is critical for maintaining directional root hair growth inArabidopsis[J].Plant Physiol,2008,147(4): 1659-1674.
[18]LILJEGREN S J,LESLIE M E,DARNIELLE L,et al.Regulation of membrane trafficking and organ separation by the NEVERSHED ARF-GAP protein[J].Development,2009,136(11):1909-1918.
[19]冯冬林,赖 燕,何水林.辣椒ArfGAP基因的克隆与表达分析[J].中国农学通报,2012,28(34): 184-189.
[20]TAKACS E M,SUZUKI M,SCANLON M J.Discolored1 (DSC1) is an ADP-ribosylation factor-GTPase activating protein required to maintain differentiation of maize kernel structures[J].Plant Science,2012,115(3): 1-15.
[21]焦晓明,范云六,王磊.植物表观遗传中的RNA介导的DNA甲基化[J].中国农业科技导报,2009,11(6): 7-13.
[22]秘彩莉,刘 旭,张学勇.F-box蛋白质在植物生长发育中的功能[J].遗传,2006,28(10): 1337-1342.
[23]YAMAGUCHI T,NAGASAWA N,KAWASAKI S,et al.TheYABBYgene drooping leaf regulates carpal specification and midrib development in Oryzasativa[J].The Plant Cell,2004,16(2): 2500-2509.
[24]TANAKA W, TORIBA T,OHMORI Y,et al.TheYABBYgeneTONGARI-BOUSHI1 is involved in lateral organ development and maintenance of meristem organization in the rice spikelet[J].The Plant Cell,2012,24(1): 80-95.
[25]DURRANT W E,ROWLAND O,PIEDRAS P,et al.cDNA-AFLP reveals a striking overlap in race-specific resistance and wound response gene expression profile[J].The Plant Cell,2000,12(6): 6963-6977.
[26]DUBOS C,PROVOST G L,POT D,et al.Identification and characterization of water-stress-responsive genes in hydroponically grown maritime pine (Pinuspinaster) seedlings[J].Tree Physiology,2003,23(3): 169-179.
[27]VUYLSTEKE M,PELEMAN J D,EIJK M J V.AFLP-based transcript profiling (cDNA-AFLP) for genome-wide expression analysis[J].Nature Protocols,2007,6(2):1399-1413.
[28]赵继荣,李 宁,刘红霞,等.小麦抗黄矮病相关基因cDNA-AFLP差异表达片段的验证[J].植物遗传资源学报,2009,10(1): 16-20.
(责任编辑:常思敏)
Genetic and cDNA-AFLP analysis of abnormal spike development in common wheat
HAN Yali, REN Yan, CHENG Xiyong, XIE Kejun, ZHANG Yanlin, ZHU Baolei, ZHAN Kehui
(College of Agronomy, Henan Agricultural University, Zhengzhou 450002, China)
This study found some plants with abnormal ears in F2generations of two hybrid combinations Zhoumai 16/Yunong 2 593 and Yunong 2 593/Xinmai 9. All ears of these abnormal plants were dysplastic, spikelets got longer and arranged spacing increased obviously, the number of spikelets cut down, anthers were shriveled and thin, filaments were sparse and could not elongate, which resulted in abnormal blossom,and the development of pistil was atrophic, and all the traits could be inherited stably in different generations. The ratio of normal plants and abnormal plants from F3∶4and F4∶5of two hybrid combinations were 3∶1, which showed that the abnormal ear development was controlled by a pair of recessive genes, instead of environment. We screened a total of 17486 transcript derived fragments (TDF) in which 20 TDFs successfully got through 109 pairs of markers for single ridge stage and two stages of normal and abnormal type ear differentiation by cDNA-AFLP technology. And then these TDFs after cloning and sequencing were analyzed by bioinformatics. The result showed that 10 TDFs were identified of high similarity to known function genes, which functions included stress responding, metabolism of cellular and organization, transport facilitation, expression regular and signal transduction, 6 TDFs were identified of high similarity with unknown function or putative protein, and the remaining 4 TDFs were found to be of no sequence similarity which might be some new genes. These results have important theoretical guiding significance for the study of wheat spike developmental regulatory genes and the reveal of wheat spike differentiation process.
wheat; abnormal spike development; traits performance; genetic analysis; cDNA-AFLP; bioinformatics
2014-12-16
国家重点基础研究发展计划(973计划)项目(2014CB138105)
韩亚利(1989-) 女,河南夏邑人,硕士研究生,主要从事小麦育种研究。
詹克慧(1964-),男,河南商城人,教授,博士。
1000-2340(2015)03-0292-09
S 512.1
A
