小剂量秋水仙碱联合糖皮质激素治疗急性痛风性关节炎的疗效观察
2015-06-28刘颖李志琛陈建斌俞婷婷崔翠张华北
刘颖,李志琛,陈建斌,俞婷婷,崔翠,张华北
小剂量秋水仙碱联合糖皮质激素治疗急性痛风性关节炎的疗效观察
刘颖,李志琛,陈建斌,俞婷婷,崔翠,张华北
目的观察小剂量秋水仙碱联合糖皮质激素治疗急性痛风性关节炎的临床效果。方法选择2009年1月-2013年12月收治的92例急性痛风性关节炎患者,随机分为小剂量联合治疗组(治疗组)和常规大剂量治疗组(对照组),每组46例。治疗组采用小剂量秋水仙碱联合小剂量地塞米松,对照组采用常规大剂量秋水仙碱治疗。分别于治疗3、6、12、24、48、72h后进行关节病变评分和疗效评价,检测两组患者治疗前及治疗72h后血尿酸、红细胞沉降率(ESR)、血白细胞、丙氨酸转氨酶(ALT)、肾小球滤过率(GFR)的变化,观察治疗后的胃肠道不良反应情况及1个月内的复发率。结果与对照组比较,治疗组用药6、12、48、72h时关节病变评分明显降低,疗效显著(P<0.05,P<0.01)。与治疗前比较,治疗72h后两组ESR及血白细胞计数均明显下降(P<0.05),但两组间比较差异无统计学意义(P>0.05)。两组治疗前及治疗72h后血尿酸、ALT、GFR无明显变化,且组间比较亦无明显差异(P>0.05)。对照组胃肠道不良反应发生率(76.1%)明显高于治疗组(0%),差异有统计学意义(P<0.05)。随访1个月治疗组和对照组复发率差异无统计学意义(4.3%vs6.5%,P>0.05)。结论小剂量秋水仙碱联合小剂量地塞米松可更加快速有效地控制急性痛风性关节炎的发作,与常规大剂量秋水仙碱治疗相比具有良好的耐受性和安全性,值得临床推广。
关节炎,痛风性;秋水仙碱;地塞米松
痛风是嘌呤代谢紊乱和(或)尿酸排泄减少导致血尿酸增高所引起的一种晶体性关节炎,临床表现为高尿酸血症和尿酸盐结晶沉积所致的特征性急性关节炎、痛风石形成、痛风石性慢性关节炎,并可发生尿酸盐肾病、尿酸性尿路结石等,严重者可致关节破坏、肾功能受损[1-2]。痛风急性发作时临床多应用大剂量秋水仙碱、非甾体消炎药进行治疗,在患者不能耐受时可考虑糖皮质激素治疗[3]。为避免大量秋水仙碱造成的不良反应,本研究观察小剂量秋水仙碱联合小剂量糖皮质激素对痛风的临床治疗效果,以期为临床提供经验。
1 资料与方法
1.1 研究对象 选择2009年1月-2013年12月收治的急性痛风性关节炎患者92例,其中男89例,女3例。患者均在发病1~3d后就诊,处于疾病活动期,入院前未接受正规方案治疗。所有患者均符合1977年美国风湿病学会痛风性关节炎分类标准。排除已有骨质破坏、明显痛风石及反复发作的慢性痛风性关节炎,排除严重的心、肺、肝、肾等重要脏器损伤,血液系统病变,活动性消化性溃疡者和有相关药物过敏史、过敏体质者及妊娠期、哺乳期妇女。
1.2 分组及一般资料 将92例患者随机分为2组:治疗组46例,其中男45例,女1例,年龄27~76(44.6±10.9)岁,受累关节数1.4±0.6个/例,关节病变程度评分10.0±1.2分;对照组46例,其中男44例,女2例,年龄28~74(44.3±11.2)岁,受累关节数1.2±0.4个/例,关节病变程度评分9.8±1.1分。两组患者性别、年龄、受累关节数及关节病变程度差异均无统计学意义(P>0.05)。
1.3 治疗方法 治疗组给予小剂量秋水仙碱联合地塞米松治疗,具体方法为地塞米松2.5mg静滴,1次/d,秋水仙碱0.5mg口服,2次/d,疗程3d。对照组首先给予秋水仙碱1mg口服,以后每1~2h给予0.5mg,24h总量不超过6mg,如症状缓解或出现恶心、呕吐、腹泻等胃肠道不良反应时停用,24h后给予秋水仙碱1mg口服,2次/d,疗程3d。3d后两组均改为塞来昔布200mg口服,1次/d,秋水仙碱0.5mg口服,1次/d,连用1周后停用,随访1个月。原来使用降尿酸药物者,继续使用,未使用者,停用秋水仙碱后使用。所有患者均予碳酸氢钠片1.0g口服,3次/d,低嘌呤饮食,多饮开水,每日2000ml以上,适当休息,抬高患肢,并进行健康宣教。
1.4 急性痛风性关节炎评分标准 关节疼痛评分:0分为无疼痛,1分为轻度疼痛,2分为中度疼痛,3分为重度疼痛,4分为极重度疼痛;触诊压痛评分:0分为无触痛,1分为有轻微触痛,2分为有明显触痛,但无躲避动作,3分为肢体压痛躲避;肿胀度评分:0分为无肿胀,1分为可触及但不可见的肿胀,2分为可见的肿胀,3分为重度肿胀,超过关节边缘;皮肤红晕评分:0分为无红晕,1分为轻度红晕,2分为中度红晕,3分为重度红晕。以上述分值的总和作为总评分[4]。分别于治疗前及治疗3、6、12、24、48、72h后依据上述标准对两组患者进行评分。
1.5 疗效评价 显效:疼痛、红肿、压痛明显好转,功能基本恢复正常,总评分0~4分;有效:疼痛、红肿、压痛有改善,功能恢复有进步,总评分5~12分;无效:疼痛、红肿、压痛无改善,功能没有恢复,总评分13分。分别于治疗3、6、12、24、48、72h后观察两组关节病变评分及疗效情况。
1.6 血、尿指标检测及胃肠反应观察 检测两组患者治疗前及治疗72h后血尿酸、血细胞沉降率(ESR)、血白细胞、丙氨酸转氨酶(ALT)、肾小球滤过率(GFR)水平。观察并记录两组患者用药后恶性、呕吐、腹泻等胃肠道反应情况。
1.7 随访反跳和复发情况 随访1个月,记录两组患者急性痛风性关节炎复发情况。
1.8 统计学处理 采用SPSS 19.0软件进行统计分析,计量资料以表示,组间比较采用独立样本t检验,计数资料采用率表示,组间比较采用χ2检验,P<0.05为差异有统计学意义。
2 结 果
2.1 用药不同时间两组疗效评价及关节病变评分比较 用药后3h及24h两组疗效评价和关节病变评分无明显差异。治疗组用药6、12、48、72h时疗效评价明显高于对照组,关节病变评分明显低于对照组(P<0.05,P<0.01),且6h与72、12h与48h比较差异也有统计学意义(P<0.05,P<0.01,表1)。
2.2 两组血尿酸、ESR等指标比较 两组在治疗前血尿酸、ESR、血白细胞、ALT、GFR比较差异无统计学意义(P>0.05)。与治疗前比较,治疗72h后两组ESR、血白细胞明显下降,差异有统计学意义(P<0.01)。治疗72h后两组间各指标比较差异均无统计学意义(P>0.05,表2)。
2.3 不良反应及复发情况比较 对照组35例出现胃肠道不良反应,发生率76.1%,明显高于治疗组(0%),差异有统计学意义(P<0.01)。两组均未见肝肾功能异常。随访1个月,治疗组和对照组的复发率(分别为4.3%、6.5%),差异无统计学意义(P>0.05)。
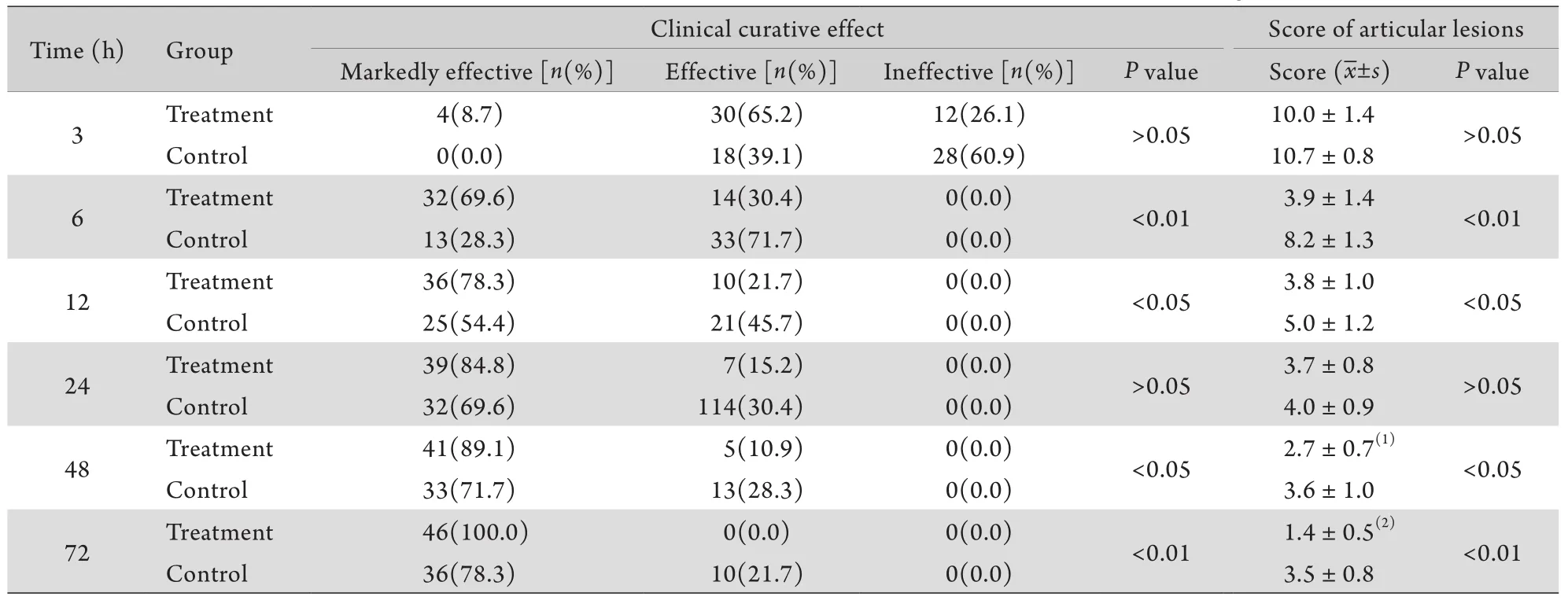
表1 两组临床疗效及关节病变评分比较(n=46)Tab. 1 Comparison of clinical curative effects and articular lesion scores between the two groups (n=46)
表2 两组治疗前后血、尿指标比较(±s,n=46)Tab. 2 Comparison of the indexes of blood and urine between the two groups pre- and post-treatment (±s,n=46)
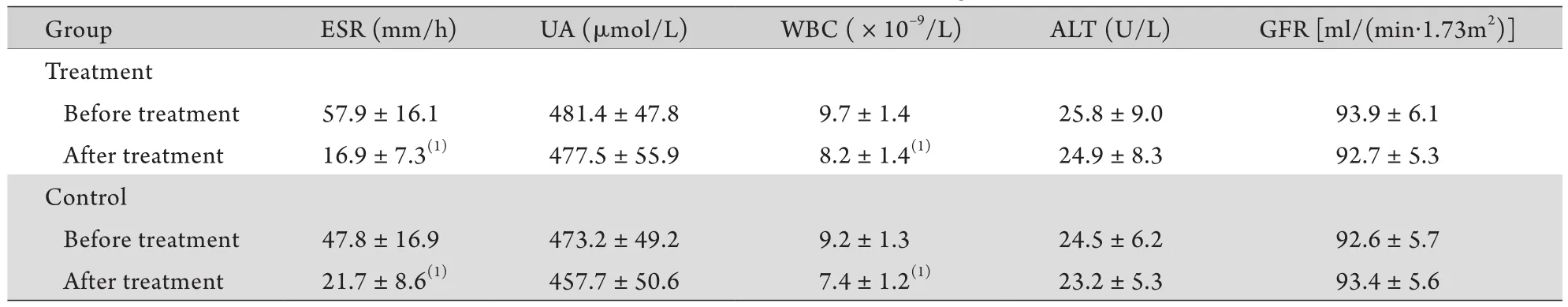
表2 两组治疗前后血、尿指标比较(±s,n=46)Tab. 2 Comparison of the indexes of blood and urine between the two groups pre- and post-treatment (±s,n=46)
ESR. Erythrocyte sedimentation rate; UA. Blood uric acid; WBC. Peripheral white blood cells; ALT. alanine aminotransferase; GFR. Glomerular filtration rate. (1)P<0.01 compared with before treatment
Group ESR (mm/h) UA (µmol/L) WBC (×10–9/L) ALT (U/L) GFR [ml/(min·1.73m2)] Treatment Before treatment 57.9±16.1 481.4±47.8 9.7±1.4 25.8±9.0 93.9±6.1 After treatment 16.9±7.3(1) 477.5±55.9 8.2±1.4(1) 24.9±8.3 92.7±5.3 Control Before treatment 47.8±16.9 473.2±49.2 9.2±1.3 24.5±6.2 92.6±5.7 After treatment 21.7±8.6(1) 457.7±50.6 7.4±1.2(1) 23.2±5.3 93.4±5.6
3 讨 论
急性痛风性关节炎的发病是因为尿酸盐结晶在关节滑囊内沉积,白细胞显著增多并吞噬尿酸盐,释放白三烯B4(LTB4)和糖蛋白等化学趋化因子,单核细胞受尿酸盐结晶影响释放白介素1所致,长期发作可导致单核细胞、上皮细胞和巨细胞浸润,形成异物结节及痛风石[5]。随着人们生活水平的不断提高,痛风的发生趋于年轻化,发病率逐年提高,近期流行病学研究显示痛风患病率为1%~2%[6]。
急性痛风性关节炎呈撕裂样、刀割样或咬噬样剧痛,并且进行性加剧,受累关节红肿灼热,功能受限,患者非常痛苦。目前该病常规治疗方案为首先使用大剂量秋水仙碱、非甾体消炎药,不能耐受情况下考虑糖皮质激素治疗[1]。
非甾体抗炎药是目前急性痛风性关节炎的一线治疗药物,但在实际应用中,单用该类药物较难快速有效地控制症状。秋水仙碱为有效治疗痛风急性发作的传统药物[7],其作用机制为:①与中性粒细胞微管蛋白的亚单位结合而改变细胞膜功能,抑制中性粒细胞的趋化、黏附和吞噬作用;②抑制磷脂酶A,减少单核细胞和中性粒细胞释放前列腺素和白三烯;③抑制局部细胞产生白介素6等炎症因子,从而减轻关节局部红肿热痛等炎性反应。最近研究也证实秋水仙碱在痛风性关节炎中可调节多个亲和抗炎途径[8]。但该药可导致腹泻等消化道反应,腹泻程度与给药剂量呈正相关,且治疗剂量与中毒剂量相近,故常规大剂量治疗因其用量大而常导致消化道反应,本研究中对照组腹泻发生率为76.1%,而治疗组为0。常规大剂量治疗过程中,患者常因无法耐受严重腹泻而终止服药,从而不能有效地控制痛风性关节炎的症状,同时,腹泻还可能导致脱水、电解质紊乱,对同时患有糖尿病、心肺慢性疾病等基础疾病的患者可能诱发急性代谢紊乱或心衰。上述不良反应和风险使患者对治疗的依从性和耐受性下降。地塞米松为糖皮质激素类药物,具有强大的抗炎作用,并能切断痛风性关节炎的炎症反应病理过程,从而迅速有效地控制痛风性关节炎的疼痛症状和关节炎症。有研究证实全身应用糖皮质激素可快速缓解痛风性关节炎疼痛症状[9],且疗效优于非甾体抗炎药[10-11]。但目前糖皮质激素并未作为常规初始治疗药物,通常用于不能耐受非甾体抗炎药和秋水仙碱或肾功能不全患者,停药后可能会发生反跳。
本研究将小剂量秋水仙碱联合小剂量糖皮质激素用于急性痛风性关节炎的初始治疗,结果显示可快速有效地控制病情,同时未发生明显不良反应。治疗组6h显效率达到69.6%,与对照组24h的显效率接近,表明与常规方案相比该方案的急性期治疗显效窗提前了18h,在6h之内即可有效缓解疼痛,且患者无需忍受腹泻带来的痛苦和风险。治疗组72h显效率明显高于对照组,说明随着时间延长,治疗组显效率明显升高,对照组因不良反应的出现导致疗效下降。随访1个月两组复发率无明显差异,表明经过后续7d维持治疗,无明显反跳和复发。有文献报道低剂量秋水仙碱可能是急性痛风性关节炎的首选治疗方法[12],与本研究结果一致。
综上所述,传统大剂量秋水仙碱作为痛风性关节炎的常规治疗需谨慎,而选用小剂量激素联合小剂量秋水仙碱治疗效果好,不良反应少,值得临床推广。
[1]Chinese Rheumatology Association. Guideline on the diagnosis and treatment of primary gout[J]. Chin J Rheumatol, 2011, 15(6): 410-413. [中华医学会风湿病学分会. 原发性痛风诊断和治疗指南[J]. 中华风湿病杂志, 2011, 15(6): 410-413.]
[2]Zhao HY, Zhang XL, Wang XF. Analysis of the clinical features of 748 cases of gout[J]. Chin J Pract Intern Med, 2014, 34(11): 1114-1115. [赵海燕, 张晓莉, 王晓非. 痛风748例临床特征分析[J]. 中国实用内科杂志, 2014, 34(11): 1114-1115.]
[3]Zeng XJ. "2010 China gout clinical treatment guidelines" Interpretation[J]. Chin J Pract Intern Med, 2012, 32(6): 438-441. [曾学军. 《2010年中国痛风临床诊治指南》解读[J].中国实用内科杂志, 2012, 32(6): 438-441.]
[4]Khanna D, Khanna PP, Fitzgerald JD,et al. 2012 American College of Rheumatology guidelines for management of gout. Part 2: therapy and antiinflammatory prophylaxis of acute gouty arthritis[J]. Arthritis Care Res (Hoboken), 2012, 64(10): 1447-1461.
[5]Ma HY, Zhu MC, Quan SZ,et al. Investigation of hyperuricemia in pilots and analysis of its risk factors[J]. Med J Chin PLA, 2012, 37(1): 73-75. [马红雨, 朱美财, 全首祯, 等. 飞行员高尿酸血症调查及危险因素分析[J]. 解放军医学杂志, 2012, 37(1): 73-75.]
[6]Zhang W, Doherty M, Pascual E,et al. EULAR evidence based recommendation for gout. Part I: diagnosis. Report of a task force of the Standing Committee for International Clinical Studies Including Therapeutics (ESCLSU)[J]. Ann Rheum Dis, 2006, 65(10): 1301-1311.
[7]Han YX, Qiu H, Yang WH,et al. Successful treatment of refractory gout by tumor necrosis factor antagonist - case report and literature review[J]. Tianjin Med J, 2013, 41(2): 181-182.[韩依轩, 邱虹, 杨文浩, 等. 肿瘤坏死因子拮抗剂成功治疗难治性痛风一例报告并文献复习[J]. 天津医药, 2013, 41(2): 181-182.]
[8]Dalbeth N, Lauterio TJ, Wolfe HR. Mechanism of action of colchicine in the treatment of gout[J]. Clin Ther, 2014, 36(10): 1465-1479.
[9]Van Durme CM, Wechalekar MD, Buchbinder R,et al. Nonsteroidal anti-inflammatory drugs for acute gout[J]. Cochrane Database Syst Rev, 2014, 9: CD010120.
[10] Khanna PP, Gladue HS, Singh MK,et al. Treatment of acute gout: a systematic review[J]. Semin Arthritis Rheum, 2014, 44(1): 31-38.
[11] Janssens HJ, Janssen M, van de Lisdonk EH,et al. Use of oral prednisolone or naproxen for the treatment of gout arthritis: a double-blind, randomised equivalence trial[J]. Lancet, 2008, 371(9627): 1854-1860.
[12] Van Echteld I, Wechalekar MD, Schlesinger N,et al. Colchicine for acute gout[J]. Cochrane Database Syst Rev, 2014, 8: CD006190.
Therapeutic efficacy of small doses of colchicine combined with glucocorticoid for acute gouty arthritis
LIU Ying, LI Zhi-chen, CHEN Jian-bin, YU Ting-ting, CUI Cui, ZHANG Hua-bei
Department of Endocrinology, Airport Road District, 117 Hospital of PLA, Hangzhou 310004, China
This work was supported by the Key Medical Subject of Nanjing Military Command (11Z038)
ObjectiveTo observe the clinical effect of small dose of colchicine combined with glucocorticoid for acute gouty arthritis.MethodsNinety-two patients with acute gouty arthritis were equally and randomly divided into small doses of colchicine combined with dexamethasone treatment group (treatment group) and conventional large dose colchicine treatment group (control group) between January 2009 and December 2013. The articular lesion scoring and clinical efficacy evaluation were performed at 3, 6, 12, 24, 48, and 72h after treatment. Erythrocyte sedimentation rate (ESR), white blood cells, hepatorenal function and glomerular filtration rate (GFR) were determined before and 72h after treatment respectively. The gastrointestinal adverse events and recurrence rate were observed within one month after treatment.ResultsThe articular lesion scores were significantly decreased at 6, 12, 48, and 72h after treatment in treatment group compared with control group (P<0.05 orP<0.01). Compared with that of pre-treatment, ESR and white blood cell count were decreased significantly 72h after treatment (P<0.05), but there was no statistical difference between the two groups (P>0.05). Serum uric acid, glutamic-pyruvic transaminase in serum (SGPT), and GFR did not show any change before and 72h after the treatment, and there was also no significant difference between groups (P>0.05). The incidence of gastrointestinal adverse events were obviously higher in control group (76.1%) compared with that of the treatment group (P<0.05), and the differences was statistically significant. There was no statistical difference in recurrence rate between the control group and treatment group after a follow-up of one month.ConclusionsCompared with conventional large dose colchicine, small dose of colchicine combined with dexamethasone can more rapidly and effectively control acute gouty arthritis, with good tolerability and safety, thus being worthy of popularization clinically.
arthritis, gouty; colchicines; dexamethasone
R589.7
A
0577-7402(2015)08-0652-04
10.11855/j.issn.0577-7402.2015.08.10
2014-12-22;
2015-02-02)
(责任编辑:李恩江)
南京军区医药卫生重点项目(11Z038)
刘颖,医学博士,副主任医师。主要从事内分泌代谢疾病方面的研究
310004 杭州 解放军117医院机场路院区内分泌科(刘颖、李志琛、陈建斌、俞婷婷、崔翠、张华北)
