即时凝血功能监测在弥散性血管内凝血患者治疗中的应用
2015-06-28万鹏余旻童华生苏磊
万鹏,余旻,童华生,苏磊
·临床研究·
即时凝血功能监测在弥散性血管内凝血患者治疗中的应用
万鹏,余旻,童华生,苏磊
目的探讨即时凝血功能监测(Sonoclot分析仪)在弥散性血管内凝血(DIC)个体化治疗中的价值。方法将符合纳入标准的237例显性DIC患者随机分为对照组(n=121,采用传统凝血指标指导替代和抗凝治疗)和Sonoclot组(n=116,采用Sonoclot分析仪指导替代和抗凝治疗)。观察两组患者抗凝、替代治疗以及预后之间的差异。结果治疗前两组患者一般临床资料比较无明显差异(P>0.05)。与对照组相比,Sonoclot组中使用肝素比例增加,抗凝时间缩短,肝素用量减少,局部出血比例下降,血浆、血小板及冷沉淀用量减少(P<0.05),且ICU住院时间缩短,30d生存率显著改善(P<0.05)。结论即时凝血功能监测可对血液制品成分进行合理的选择和数量控制,同时还可有效指导抗凝治疗,降低抗凝治疗致的出血风险,降低DIC患者死亡率。
弥漫性血管内凝血;即时凝血功能监测;输血
弥散性血管内凝血(disseminated intravascular coagulation,DIC)是由不同病理原因引起的、无明确定位的全身性血管内凝血系统激活,临床上出血和血栓并存,以多器官功能衰竭(MODS)为特征[1-2]。目前强调支持治疗尤其是纠正凝血功能紊乱是缓解DIC的重要措施[3-7]。如何在治疗过程中对患者的凝血功能做出及时的客观评价,并对需要替代、抗凝治疗的患者进行动态监测,一直是临床上的难点。传统凝血指标能提供有价值的信息,但操作复杂、耗时长,且单个检测项目只涉及离体血浆凝血级联反应中的部分步骤,其结果是使传统的凝血功能指标失去了动态监测的作用。Sonoclot凝血和血小板功能分析仪作为即时凝血功能监测的仪器可以更加敏感地监测凝血因子、纤维蛋白形成、血小板聚集及纤维溶解的全过程,准确判断DIC所处的凝血功能障碍阶段[8-9],在DIC诊断中具有重要价值[10-11]。Sonoclot分析仪是否可以指导DIC的临床治疗,目前尚未见报道。本研究探讨了Sonoclot分析仪在指导DIC患者个体化治疗中的价值,旨在为Sonoclot分析仪应用于DIC的临床防治提供理论依据。
1 资料与方法
1.1 研究对象 2010年6月-2013年6月入住广州军区总医院重症医学科的患者498例。
1.2 纳入标准 根据ISTH治疗指南[3],将需要行替代治疗或抗凝治疗的DIC患者纳入研究。本研究项目经医院伦理委员会审查批准,所有入选患者家属均了解实验方案并签署知情同意书。
1.2.1 DIC的临床表现 包括严重或多发性出血倾向,不能用原发病解释的微循环障碍或休克,广泛的皮肤、黏膜栓塞,灶性缺血性坏死、脱落及溃疡形成,不明原因的肺、肾、脑等脏器功能衰竭[12]。
1.2.2 疑诊DIC的实验室标准 凝血酶原时间(PT)、活化部分凝血酶原时间(APTT)延长(PT>14.8s,APTT>48s),或血小板计数减少(<150×109/L),或24h内血小板计数下降>50×109/L[12]。
1.2.3 DIC诊断标准 参照2001年国际血栓与止血学会(ISTH)/科学标准化学会(SSC)制定的显性DIC诊断标准[12]。
1.3 排除标准 存在已知的先天性凝血功能障碍;慢性肝功能不全患者Child Pugh C级以上;血液系统恶性肿瘤;引起血小板变化的其他疾病如血小板减少性紫癜、脾功能亢进或服用引起凝血功能异常或致血小板减少的药物;年龄小于18岁;拒绝入组和随访者[13-15]。
1.4 分组 共237例患者纳入研究。按照分层随机抽样原则分为对照组(采用传统凝血指标指导替代和抗凝治疗)121例和Sonoclot组(采用Sonoclot分析仪指导替代和抗凝治疗)116例。
1.5 方法
1.5.1 一般临床资料的收集 收集患者年龄、性别、APACHE Ⅱ评分、ISTH评分、多发性出血情况、ICU住院时间、总住院时间等。
1.5.2 凝血相关指标的检测 入科后采集外周血液标本进行凝血指标检测。常规凝血指标包括血小板计数(PLT)、纤维蛋白原(FBG)、PT、APTT和D-二聚体。Sonoclot分析仪指标测定:通过体外激活内源性凝血途径模拟凝血全过程。分析仪管型探针在全血样本中移动,通过电子信号转换器,依据血液标本结束液态阶段(纤维蛋白多聚体形成)后凝血收缩的强度及速度(凝血收缩过程中曲线各点的微积分值),将位移阻抗变化经由与分析仪相连的Signature viewer电脑软件计算相对值,记录Sonoclot各量化指标,包括激发凝血时间(ACT)、纤维蛋白凝结速率(CR)、血小板功能(PF)。Sonoclot各参数的正常范围分别是:ACT 119~195s,CR 7~23sig/min,PF≥1.5。
1.5.3 治疗方法 根据ISTH DIC的治疗指南以及DIC诊断与治疗中国专家共识进行治疗[3,16]。
1.5.3.1 对照组 根据基础疾病,分别采取控制感染、治疗肿瘤、积极处理病理产科及外伤等治疗措施。抗凝治疗:予以10U/(kg.h)普通肝素持续静脉滴注,根据病情决定疗程,一般连用3~5d。每6h连续监测APTT,肝素治疗使其延长为正常值的1.5~2.0倍,当肝素过量时可用鱼精蛋白中和(鱼精蛋白1mg可中和肝素100U)。根据病情决定抗凝治疗的疗程。替代治疗:血小板输注的初始剂量为1U(含血小板>240×109/L)。在PT、APTT延长并伴出血或接受侵入性治疗的DIC患者,输入新鲜冰冻血浆(FFP)初始剂量为15ml/kg。对严重的低纤维蛋白血症,补充冷沉淀50mg/kg。每6h动态监测凝血功能,根据临床表现及实验室辅助检查结果决定是否再次行替代治疗。其他治疗:抗休克,纠正缺氧、酸碱失衡及电解质紊乱,维护脏器功能稳定等对症支持治疗。若患者出现明显纤溶亢进的临床及实验证据,予以氨甲环酸(1g/8h)治疗,否则不需要进行抗纤溶治疗。
1.5.3.2 Sonoclot组 以ISTH DIC的治疗指南以及DIC诊断与治疗中国专家共识为基础,根据Sonoclot指标调整治疗方案。治疗基础疾病及去除诱因同对照组。抗凝治疗:若Sonoclot分析仪器检测结果显示ACT缩短,CR>正常值,提示严重的高凝倾向或DIC早期,给予10U/(kg.h)肝素持续静脉滴注,每6h进行Sonoclot仪检测。若ACT延长,CR>正常值,提示抗凝不足或肝素抵抗,调整肝素剂量;若ACT延长,CR<正常值,提示为残余肝素作用,停止肝素治疗,并动态监测Sonoclot仪指标,决定是否重新进行规律的抗凝治疗。直至ACT延长至1~1.5倍,CR正常,提示抗凝治疗有效。根据病情决定抗凝治疗的疗程。替代治疗:Sonoclot分析仪检测结果显示,ACT延长,CR≤正常,提示凝血因子缺乏,输注血浆初始剂量为15ml/kg,冷沉淀50mg/kg;ACT正常,CR<正常值,提示低(无)纤维蛋白血症,继续输注冷沉淀。血小板计数下降(<50×109/L)且伴有PF下降时,可考虑输注血小板,血小板输注的初始剂量为1U(含血小板>240×109/L)。每6h动态监测凝血功能,根据临床表现及Sonoclot分析仪检测结果决定是否再次行替代治疗。其他治疗同对照组。
1.6 统计学处理 采用SPSS 19.0软件包建立数据库并进行统计分析。遵循正态分布的计量资料以描述,组间比较采用t检验。偏态分布的计量资料以中位数表示其集中趋势,以最大值、最小值表示其离散趋势,组间比较采用秩和检验。对计数资料采用频数及率表示,组间比较采用χ2检验或确切概率法。采用Kaplan-Meier生存曲线分析两组患者预后情况。P<0.05为差异有统计学意义。
2 结 果
2.1 治疗前两组间一般资料比较 对照组和Sonoclot组患者年龄、性别、体重、治疗前APACHE Ⅱ评分以及ISTH评分均无显著差异(P>0.05),治疗前传统凝血及相关指标(APTT、PT、INR、血小板计数、D-二聚体、纤维蛋白原),Sonoclot分析仪指标(ACT、CR、PF),临床表现为出血、紫癜或肢端出血的患者比例无显著性差异(P>0.05,表1)。
2.2 两组抗凝治疗比较 Sonoclot组使用肝素的比例为32.76%(38/116),明显高于对照组[19.01% (23/121,P=0.018)]。对照组和Sonoclot组肝素使用时间分别为11.0±7.2d、5.2±3.4d,肝素用量分别为65 739.1±43 322.5U、31 263.2±20 222.7U,两组相比差异均有统计学意义(P=0.001)。对照组中有10 例(43.4%)患者出现局部出血,与Sonoclot组(5例,13.1%)相比差异有统计学意义(P=0.003,表2)。两组患者均未使用鱼精蛋白。
2.3 两组替代治疗的比较 与对照组相比,Sonoclot组患者血浆、血小板及冷沉淀的用量显著减少(P<0.05),红细胞悬液用量两组间差异无统计学意义(P=0.054);两组替代治疗的时间差异无统计学意义(P=0.206,表3)。
2.4 两组患者预后比较 与对照组相比,Sonoclot组ICU内治疗时间明显缩短[10(1,29)dvs9(1,30)d,P=0.009),ICU内死亡率明显下降[22.4%(26/116)vs12.4%(15/121),P=0.027)]。Kaplan-Meier生存分析显示,与对照组比较,Sonoclot分析仪指导的替代和抗凝治疗显著缩短了患者ICU住院时间(P=0.027)并提高了30d生存率(P=0.001,图1)。
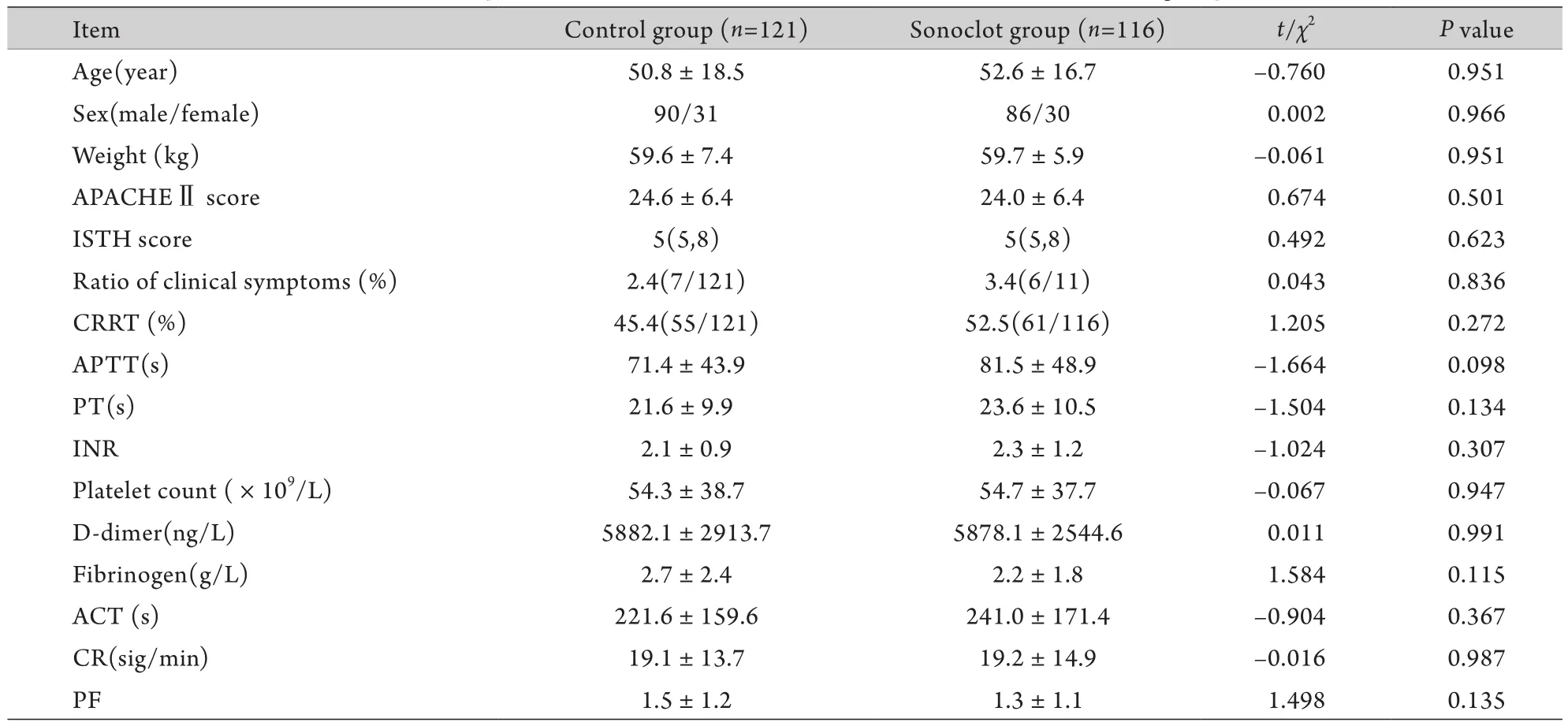
表1 两组治疗前临床资料比较Tab.1 Comparison of clinical data before treatment between the two groups

表2 两组抗凝治疗疗效比较Tab.2 Comparison of anticoagulant therapy between the two groups

表3 两组患者替代治疗疗效比较Tab.3 Comparison of replacement therapy between the two groups
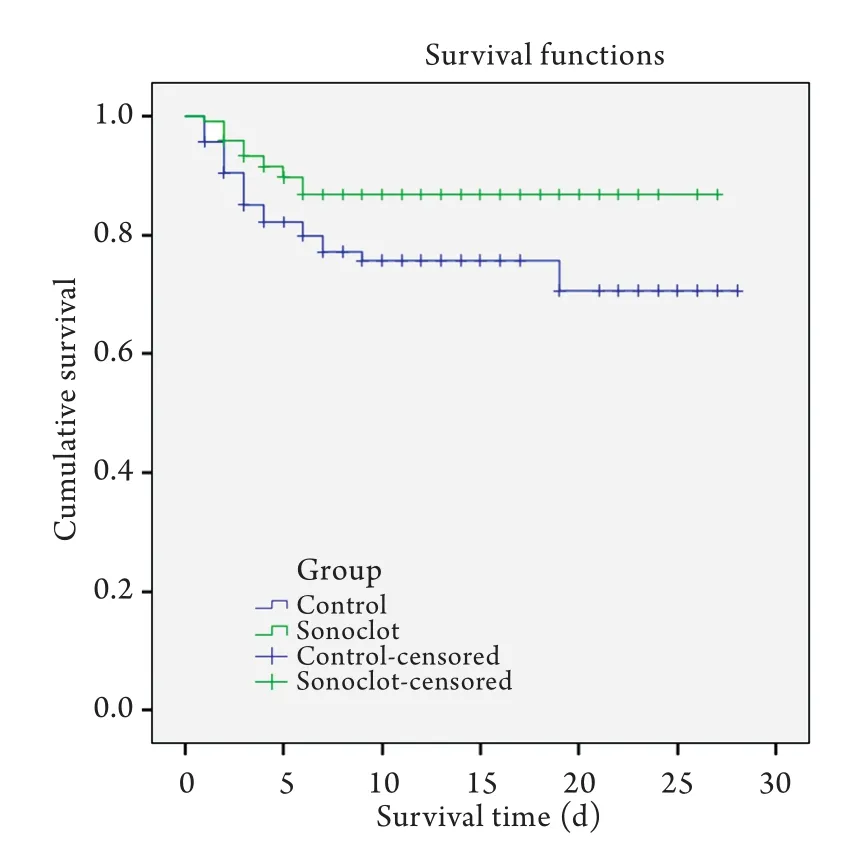
图1 两组患者30d生存分析比较Fig.1 Kaplan-Meier curves for 30d survival in patients of the two groups
3 讨 论
DIC发展迅速,往往是MODS患者中一个极为重要甚至是公认的致死原因,其28d死亡率高达31%~86%[17-18]。因此,早期正确诊断、及时有效治疗是成功救治DIC患者的关键。但临床实践证明,不恰当的替代及抗凝治疗可能导致重要脏器血管微血栓形成、器官功能衰竭甚至死亡。由于传统的凝血功能检测耗时长,且只能体现凝血机制的某一方面,不能反映凝血级联及凝血系统全过程的内部情况,无法有效地指导抗凝治疗,甚至导致抗凝不足或出血[19-20]。随着即时凝血功能分析技术广泛用于临床,DIC药物治疗尤其是抗凝药物的应用时机和剂量调整逐步精确化和可控化。
作为即时凝血功能监测手段之一,Sonoclot分析仪通过探知纤维蛋白形成、纤维蛋白单体聚合、血小板的相互作用、血凝块回缩和溶解而使我们充分了解凝血全过程[21]。动物实验及临床研究均证实,Sonoclot分析仪可以帮助评估凝血功能情况,指导肝素抗凝治疗[22-25]。Ferraris等[26]研究证实Sonoclot分析仪可为心脏手术提供即时准确的凝血功能评价,为肝素抗凝、鱼精蛋白中和、术后止血治疗提供指导,并指导临床合理使用血制品,减少盲目性应用、节约血液资源、降低住院费用。其他研究还发现,Sonoclot分析仪适用于在肝移植术中监测血小板及凝血因子变化,进一步指导凝血底物补充[27-28]。由于Sonoclot分析仪对DIC患者凝血过程的变化和瞬时凝血功能状态有较好的即时分析和解释功能,故而可用于指导DIC患者的临床治疗。
抗凝治疗是DIC治疗的关键环节,肝素剂量调整往往取决于患者的临床表现和医生的经验判断。目前临床常用于监测肝素的指标是APTT,但其仅仅反映了内源性凝血异常的单一阶段,并未反映整个凝血过程的变化,无法判断凝血异常的原因,对于指导肝素的剂量调整存在明显不足[29-30]。本研究利用Sonoclot分析仪指导肝素的抗凝治疗,通过相关参数快速准确判断患者凝血激活、纤维蛋白原形成、纤溶状况及凝血因子和血小板消耗程度,分析DIC的临床进程,准确解读多种凝血异常的原因,从而使DIC的抗凝从试探性治疗走向了目标性治疗,在剂量的调整上也有了相应的依据。在DIC高凝期,Sonoclot分析仪检测结果表现为ACT明显缩短,CR上升,可立即给予肝素进行抗凝治疗而无须等待DIC确诊的实验室结果,从而赢得了宝贵的抢救时间。本研究结果显示,在整个抗凝过程中,Sonoclot组肝素抗凝治疗所致的出血风险显著降低,肝素剂量及使用时间明显减少。
既往替代治疗主要根据患者临床状况来决定[31-32]。替代治疗是否有效主要依靠观察出血症状的改善情况,并反复监测血小板计数和凝血相关实验。大多数指南认为,仅应对出血或有高危出血的患者给予血浆输注,而且不应只根据实验室指标异常来进行判断,以免造成盲目性应用,浪费血液资源,甚至在治疗过程中出现补充过量,导致器官微血栓的可能,增加了住院时间及住院费用[3, 33-34]。
本研究发现,根据Sonoclot分析结果可判断冷沉淀、纤维蛋白原、凝血酶原复合物等凝血因子补充是否到位。如果ACT延长、CR还比较低,表明还缺乏凝血因子,需继续补充,如果ACT低于正常值的低限、CR接近或超出正常值高限,则表明补充过量,应立即停止凝血因子的补充。本研究中,我们通过Sonoclot分析仪指导冷沉淀、纤维蛋白原、凝血酶原复合物等凝血因子的补充,与对照组相比,Sonoclot组替代治疗数量及时间均显著降低。
DIC患者常伴血小板数量减少,反映了凝血物质的消耗。由于反复输注异体血小板会导致输注无效,因此应严格控制血小板输注的指征,尽可能减少输注次数以预防血小板无效或延迟其产生。目前血小板输注的参考标准只涉及了血小板的数量,并没有考虑血小板质量。因此,根据传统的凝血检测结果及临床表现控制输血指征,确定患者是否需要输注血小板存在一定的局限性[35]。与传统的凝血检查项目相比,Sonoclot分析仪的PF值主要反映血小板的质量,是目前唯一能对血小板功能进行准确定量的检测,与血小板计数相比能更好地反映血小板功能。本研究中,我们联合Sonoclot分析仪指标指导血小板输注。对于DIC患者,除了已经有明显出血者积极输注血小板外,对低凝状态患者在血小板计数<50×109/L且PF≤1.5时也进行血小板输注治疗。与对照组相比,Sonoclot组血小板输注量下降。Sonoclot分析仪能检测患者的血小板凝血活性,结合Sonoclot分析仪的其他指标可综合评价患者出凝血状态,能够准确指导治疗。这种精确定点、定位治疗是常规实验室检查和凭临床经验无法办到的。
对于DIC患者,抗纤溶治疗由于可抑制微小血栓溶解的机体防御反应而被认为是禁忌[3,36],除非患者伴有原发性或继发性高纤溶活性时一般不予考虑。纳入本研究的患者中,无一例使用抗纤溶治疗,考虑是由于剔除了易导致高纤溶活性的疾病如急性早幼粒细胞白血病相关的凝血病及恶性肿瘤患者。更重要的是,无论是传统的凝血功能检测,还是Sonoclot分析仪检测均未发现高纤溶患者存在。
此外,本研究比较了两组患者的预后情况,结果显示,Sonoclot组ICU住院时间较对照组明显缩短,生存分析提示Sonoclot组远期预后改善。但由于本研究为单中心研究,样本资料具有一定的偏倚,且临床干预治疗对结果存在影响。因此,还有待于更大规模多中心临床研究进一步证实。
综上所述,即时凝血功能监测能够客观准确地评估患者体内的凝血状况,因而可以对血液制品成分进行合理的选择及数量控制,有利于节约血液资源,避免盲目输注血液制品,防止血液资源浪费。同时,即时凝血功能监测可以有效指导治疗,减少治疗过程中的不良反应,显著改善预后。
[1]Slofstra S, Spek A, Cate H. Disseminated intravascular coagulation[J]. Hematol J, 2013, 4(1): 295-302.
[2]Long ZZ, Nie QH. The current status of clinical diagnosis and treatment on complication of Ebola hemorrhagic fever[J]. Chin J Pract Intern Med, 2014, 34(12): 1180-1184. [龙振昼, 聂青和.埃博拉出血热并发症临床诊治现状[J]. 中国实用内科杂志, 2014, 34(12): 1180-1184.]
[3]Levi M, Toh CH, Thachil J,et al. Guidelines for the diagnosis and management of disseminated intravascular coagulation[J]. Br J Haematol, 2009, 145(1): 24-33.
[4]Thachil J, Toh CH. Current concepts in the management of disseminated intravascular coagulation[J]. Thromb Res, 2012, 129(Suppl 1): S54-S59.
[5]Toh CH, Alhamdi Y. Current consideration and management of disseminated intravascular coagulation[J]. Hematology Am Soc Hematol Educ Program, 2013, 2013(1): 286-291.
[6]Levi M. Pathogenesis and management of peripartum coagulopathic calamities (disseminated intravascular coagulation and amniotic fluid embolism)[J]. Thromb Res, 2013, 131(Suppl 1): S32-S34.
[7]Johansson PI. Anticoagulation, resuscitation, and hemostasis[M]//Clinical review of vascular trauma. Springer Berlin Heidelberg, 2014: 21-32.
[8]Ganter MT, Hofer CK. Point-of-care coagulation monitoring[M]//Monitoring technologies in acute care environments. Springer New York, 2014: 329-342.
[9]DA Hett, D Walker, SN Pilkington,et al. Sonoclot analysis[J]. Br J Anaesthesia, 1995, 75(6): 771-776.
[10] Wan P, Tong HS, Zhang XQ,et al. Diagnosis of overt disseminated intravascular coagulation in critically ill adults by Sonoclot coagulation analysis[J]. Intern J Hematol, 2014, 100(2): 125-131.
[11] Wan P, Tong HS, Su L,et al. Diagnosis of overt disseminated intravascular coagulation in heat stroke by Sonoclot coagulation analysis[J]. J Pract Med, 2014, 30(16): 44-47. [万鹏, 童华生,苏磊, 等. 新型凝血和血小板功能分析仪在重症中暑DIC中的诊断价值[J]. 实用医学杂志, 2014, 30(16): 44-47.]
[12] Taylor FB Jr, Toh CH, Hoots WK,et al. Toward definition, clinical and laboratory criteria, and a scoring system for disseminated intravascular coagulation[J]. Thromb Haemost, 2001, 86(5): 1327-1330.
[13] Wada H, Gabazza EC, Asakura H. Comparison of diagnostic criteria for disseminated intravascular coagulation (DIC): diagnostic criteria of the International Society of Thrombosis and Haemostasis (ISTH) and of the Japanese Minist ry of Health and Welfare for overt DIC[J]. Am J Hematol, 2003, 74(1):17-22.
[14] Gando S, Wada H, Asakura H,et al. Evaluation of new Japanese diagnostic criteria for disseminated int ravascular coagulationin critically ill patients[J]. Clin Appl Thromb Hemost, 2005, 11(1): 71-76.
[15] Gando S, Iba T, Eguchi Y,et al. A multicenter, prospective validation of disseminated intravascular coagulation diagnostic criteria for critically ill patients: comparing current criteria[J]. Crit Care Med, 2006, 34(3): 625-631.
[16] Thrombosis and Hemostasis Group of Chinese Medical Association. Chinese guidelines for the diagnosis and management of disseminated intravascular coagulation expert consensus[J]. Chin J Hematol, 2012, 33(11): 978-979. [中华医学会血液学会分会血栓与止血组. 弥散性血管内凝血诊断与治疗中国专家共识[J] 中华血液学杂志, 2012, 33(11): 978-979.]
[17] Levi M, van der Poll T. Disseminated intravascular coagulation: a review for the internist[J]. Intern Emerg Med, 2013, 8(1): 23-32.
[18] Wada H, Matsumoto T, Yamashita Y,et al. Disseminated intravascular coagulation: testing and diagnosis[J]. Clin Chim Acta, 2014, 436: 130-134.
[19] Levi M, Meijers JC. DIC: which laboratory tests are most useful[J]. Blood Rev, 2011, 25(1): 33-37.
[20] Haas T, Fries D, Tanaka KA,et al. Usefulness of standard plasma coagulation tests in management of perioperative coagulopathic bleeding: is there any evidence[J]? Br J Anaesth, 2015, 114(2): 217-224.
[21] Wang ZQ, Xu Z, Liu XZ,et al. Effects of blood loss during operation on coagulation function in selective noncardiovascular surgery patients[J]. Med J Chin PLA, 2010, 35(7): 877-880, 883. [王卓强, 徐震, 刘秀珍, 等. 择期非心血管手术术中失血对凝血功能的影响[J]. 解放军医学杂志, 2010, 35(7): 877-880, 883.]
[22] Babski DM, Brainard BM, Krimer PM,et al. Sonoclot evaluation of whole blood coagulation in healthy adult dogs[J]. J Vet Emerg Crit Care (San Antonio), 2012, 22(6): 646-652.
[23] Lee B, Al-Waili N, Butler G,et al. Assessment of heparin anticoagulation by Sonoclot Analyzer in arterial reconstruction surgery[J]. Technol Health Care, 2011, 19(2): 109-114.
[24] Nilsson CU, Engström M. Monitoring fondaparinux with the Sonoclot[J]. Blood Coagul Fibrinolysis, 2007, 18(7): 619-622.
[25] Ennent-Brown BS, Epstein KL, Whelchel DD,et al. Use of viscoelastic coagulation testing to monitor low molecular weight heparin administration to healthy horses[J]. J Vet Emerg Crit Care (San Antonio), 2013, 23(3): 291-299.
[26] Ferraris VA, Ferraris SP, Saha SP,et al. Perioperative blood transfusion and blood conservation in cardiac surgery: the society of thoracic surgeons and the society of cardiovascular anesthesiologists clinical practice guideline[J]. Ann Thorac Surg, 2007, 83(5): s27-s86.
[27] Singh S, Nasa V, Tandon M. Perioperative monitoring in liver transplant patients[J]. J Clin Exp Hepatol, 2012, 2(3): 271-278.
[28] Agarwal A, Sharma N, Vij V,et al. Point-of-care coagulation monitoring during liver transplantation[J]. Trend Anaesth Crit Care, 2013, 3(1): 42-48.
[29] Hirsh J. Drug therapy: heparin[J]. N Engl J Med, 1991, 324(22): 1565-1574.
[30] Barochia AV, Li Y, Cui X,et al. Antithrom-bosis trials: Should we test therapeutic heparin adjusted based on activated partial thromboplastin time in septic shock[J]? Crit Care Med, 2009, 37(4): 1486-1487.
[31] Wada H, Matsumoto T, Yamashita Y. Diagnosis and treatment of disseminated intravascular coagulation (DIC) according to four DIC guidelines[J]. J Intensive Care, 2014, 2(1): 15.
[32] Blaisdell FW. Causes, prevention, and treatment of intravascular coagulation and disseminated intravascular coagulation[J]. J Trauma Acute Care Surg, 2012, 72(6): 1719-1722.
[33] Di Nisio M, Baudo F, Cosmi B,et al. Diagnosis and treatment of disseminated intravascular coagulation: Guidelines of the Italian Society for Haemostasis and Thrombosis (SISET)[J]. Thromb Res, 2012, 129(5): 177-184.
[34] Wada H, Thachil J, Di Nisio M,et al. Guidance for diagnosis and treatment of DIC from harmonization of the recommendations from three guidelines[J]. J Thromb Haemost, 2013, 11(4): 761-767.
[35] Szczepiorkowski ZM, Dunbar NM. Transfusion guidelines: when to transfuse[J]. Hematology Am Soc Hematol Educ Program, 2013, 2013: 638-644.
[36] Wunderink RG, Laterre PF, Francois B,et al. Recombinant tissue factor pathway inhibitor in severe community-acquired pneumonia: a randomized trial[J]. Am J Respir Crit Care Med, 2011, 183(11): 1561-1568.
The significance of immediate coagulation monitoring during the treatment for DIC
WAN Peng1, YU Min1, TONG Hua-sheng2, SU Lei2*1Department of Critical Care Medicine, First People's Hospital of Yichang, First Hospital of Sanxia University, Yichang, Hubei 443002, China
2Department of Intensive Care Unit, Military Key Laboratory of Trauma Care in Hot Zone and Tissue Repair of PLA, Guangzhou General Hospital of Guangzhou Command, Guangzhou 510010, China
*< class="emphasis_italic">Corresponding author, E-mail: slei_icu@163.com
, E-mail: slei_icu@163.com
This work was supported by the National Natural Science Foundation of China (81471839)
ObjectiveTo explore the value of application of immediate coagulation monitor, with the use of Sonoclot analyzer in the treatment of disseminated intravascular coagulation (DIC).MethodsTwo hundred and thirty-seven DIC patients were randomly divided into Sonoclot group (n=116, guided by Sonoclot analyzer) and control group (n=121, guided by traditional coagulation indexes) according to the principle of random number. The type, dose and duration of replacement treatment, and the outcomes such as complication rate, ICU stay and 30-day survival rate were recorded and compared.ResultsThere were no difference in the demographic data between two groups (P>0.05). In Sonoclot group, the ratio of heparin used was much higher, though with shorter duration and lower dose than those in control group (P<0.05). The regional bleeding rate was significantly lower in Sonoclot group than that of control group (P<0.05). The replacement doses of the fresh frozen plasma, PLT, and cryoprecipitate were also much lower in the Sonoclot treatment group (P<0.05). A shorter ICU stay was found in the Sonoclot group (P<0.05). In sonoclot group the prognosis was significantly improved as shown by Kaplan-Meier analysis curve (P<0.05).ConclusionsSonoclot analysis is helpful in choosing rational blood products and necessary dosage. It is also useful for effectively guiding anticoagulant therapy in order to reduce the bleeding risk and mortality rate in DIC patients.
disseminated intravascular coagulation; immediate coagulation monitoring; blood transfusion
R554.8
A
0577-7402(2015)08-0632-06
10.11855/j.issn.0577-7402.2015.08.06
2015-01-30;
2015-06-22)
(责任编辑:熊晓然)
国家自然科学基金面上项目(81471839)
443002 湖北宜昌 三峡大学人民医院、宜昌市第一人民医院重症医学科(万鹏、余旻);510010 广州 广州军区总医院重症医学科、全军热区创伤救治与组织修复重点实验室(童华生、苏磊)
苏磊,E-mail: slei_icu@163.com
