体外诱导脂肪来源干细胞向黏膜上皮细胞分化的研究
2015-06-28王程徐潇陈冲李梁闫俊灵汤苏阳
王程,徐潇,陈冲,李梁,闫俊灵,汤苏阳
体外诱导脂肪来源干细胞向黏膜上皮细胞分化的研究
王程,徐潇,陈冲,李梁,闫俊灵,汤苏阳
目的探讨在体外诱导脂肪来源干细胞(ADSCs)分化为黏膜上皮细胞的可能性。方法获取成年人皮下脂肪组织,进行ADSCs的分离、培养,扩增至第三代进行细胞免疫表型、分化情况及遗传稳定性鉴定。分别采用含10%胎牛血清、8μg/L表皮生长因子(EGF)、10%胎牛血清+8μg/L EGF、10%胎牛血清+8μg/L EGF+30%成纤维细胞培养基、10%胎牛血清+30%成纤维细胞培养基的DMEM培养液进行培养,于培养前及培养后7、14d观察各组细胞的光镜特征,采用免疫组织化学染色检测特异性细胞表面标记物的表达以及Western blotting方法检测诱导前后ADSCs中CK-7、CK-14的蛋白表达水平。结果与未加EGF诱导剂培养组比较,经EGF诱导14d后多数ADSCs细胞形态、排列方式发生改变。CK-19免疫组化染色显示呈强阳性。Western blotting检测结果提示诱导后的黏膜上皮细胞特异性蛋白CK7、CK14呈高表达。结论ADSCs在一定诱导条件下可向黏膜上皮样细胞分化。
脂肪干细胞;表皮生长因子;上皮样细胞;细胞分化
脂肪来源干细胞(adipose-derived stem cells,ADSCs)是近年来从脂肪组织中分离得到的一种具有多向分化潜能的干细胞[1],能够在体外稳定增殖且衰亡率低,同时具有取材容易、少量组织即可获取大量干细胞、适宜大规模培养等优点,目前已证实其具有向成骨细胞、软骨细胞、脂肪细胞、肌肉细胞、心肌细胞、神经细胞等方向分化的能力[2],是一种很有前景的组织工程种子细胞。本研究采用表皮生长因子(epidermal growth factor,EGF)作为诱导剂,观察其对脂肪来源干细胞生长分化的影响。
1 材料与方法
1.1 材料
1.1.1 主要试剂及仪器 24孔培养板(Falcon公司),6cm及10cm培养皿、25cm2及75cm2培养瓶(Corning公司),胰蛋白酶、DMEM培养液、胎牛血清(Gibco BRL公司,美国),Ⅰ型胶原酶、PBS缓冲液、EGF(Peprotech Inc.,美国),成纤维细胞培养基(Hyclone公司),CD19、CD34、CD90、CD105抗人单克隆抗体,人抗细胞角蛋白7、14、19(CK-7、CK-14、CK-19)单克隆抗体(Abcam,China),流式细胞仪(Becton Dickinson company,BDFAesAria)。
1.1.2 细胞来源 选取在武警总医院皮肤再生医学科行脂肪抽吸术后废弃的人体腹部、臀部、大腿皮下脂肪组织混悬液。所有患者均签订知情同意书,并经武警总医院伦理委员会批准。
1.2 方法
1.2.1 自体脂肪干细胞的分离、培养与鉴定 入选患者(均为成年人)行血液常规检查及传染病抗原、抗体检查(包括各项肝炎、梅毒、艾滋病抗体)。从患者腹部、臀部或大腿吸取脂肪,均匀分至50ml离心管中,操作中注意无菌原则。放入离心机中,500×g离心5min。离心后将上层脂肪倾倒于50ml离心管中,每个离心管至多25ml。将适量浓度胰蛋白酶和胶原酶加入离心管至50ml,使其在离心管内的终浓度均为0.1%,然后置入水浴振荡器中,37℃、220r/min振荡30~45min,观察脂肪逐渐变为乳糜状,置入离心机,2000r/min离心5min,弃上层脂肪及上清,加入适量PBS重悬细胞沉淀,吹打后接种于H-DMEM培养液(含10%胎牛血清,100U/ml青霉素,100mg/L链霉素)中,37℃、5%CO2、饱和湿度条件下培养,24h后换液,弃去未贴壁的细胞,每隔3~4d换液,倒置显微镜(Leica)观察细胞生长情况,接近80%融合时用0.25%胰蛋白酶(Hyclone公司)室温消化5~10min,按1:3比例传代培养。传至第3代时,观察细胞形态及活性,并采用流式细胞仪进行表型检测(CD34、CD73、CD90、CD105)。
1.2.2 流式细胞仪检测 取第3代ADSCs,经0.25%胰酶室温消化,磷酸盐缓冲液(PBS)洗涤离心后,加入人抗广谱角蛋白多克隆抗体(Maxim公司),工作浓度1:20,4℃孵育30min。PBS洗涤3次,加入异硫氰酸荧光素(FITC)标记的人抗兔二抗(Sigma公司),工作浓度为1:200,4℃孵育30min。PBS洗涤3次后,分别标记CD19、CD34、CD73、CD90,采用流式细胞仪进行检测。
1.2.3 EGF诱导ADSCs分化 取第3代ADSCs接种于24孔板(2000个/孔),分别加入含不同成分的培养液进行培养。A组:DMEM培养液,10%胎牛血清;B组:DMEM培养液,8μg/L EGF(Peperotech);C组:DMEM培养液,10%胎牛血清,8μg/L EGF;D组:DMEM培养液,10%胎牛血清,8μg/L EGF,30%成纤维细胞培养基;E组:DMEM培养液,10%胎牛血清,30%成纤维细胞培养基。
1.2.4 吉姆萨染色 ①涂片的制作与固定:用移液枪吸取10~20μl待检溶液滴在载玻片上,均匀涂布,室温下阴干后,用Camon固定液固定涂片10min。②染色:置吉姆萨工作液30min。③洗脱:染色完成后,涂片立即用ddH2O洗脱。④显微镜观察:用甘油压片,指甲油封固。在100×油镜下观察。
1.2.5 免疫组织化学染色 取诱导前和诱导后7、14d的细胞,采用SP法进行CK-19免疫组织化学染色,严格按照Maxim生物技术有限公司提供的免疫组织化学染色试剂盒说明书操作,二氨基联苯胺(DAB)显色。兔抗广谱角蛋白多克隆抗体(Maxim)工作浓度为1:100,采用苏木素进行复染,以非特异血清代替一抗作为阴性对照。角蛋白19(cytokeratin-19,CK-19)阳性细胞胞质呈深蓝色。
1.2.6 Western blotting检测ADSCs中CK-7、CK-19的蛋白表达水平 取诱导前及诱导后14d的细胞,提取细胞总蛋白,采用NC膜进行蛋白质电转移(转移条件:200mA,2h),然后将NC膜转移至含5%封闭液的托盘中,4℃过夜。弃封闭液,PBST洗膜3次,每次10min。加入一抗(1:100)孵育2h。PBST洗膜3次,每次10min。再加入HRP标记的二抗(用封闭液稀释,1:200)孵育1h。PBST洗膜3次,每次10min。加入配制好的增强化学发光( ECL)底物液,X线片曝光,暗室显影,定影,洗片。BCA法检测蛋白含量,SDS-PAGE凝胶电泳,转膜,脱脂奶粉封闭,吸弃封闭液,立即加入稀释好的一抗,室温或4℃缓慢摇动孵育1h,回收一抗,加入Western洗涤液,缓慢摇动洗涤5~10min,共洗涤3次,吸弃洗涤液,立即加入稀释好的二抗,室温或4℃缓慢摇动孵育1h,回收二抗,加入Western洗涤液,缓慢摇动洗涤5~10min,共洗涤3次。ECL底物发光检测诱导前后ADSCs中CK-7、CK-19的表达水平。

图1 原代ADSCs形态观察(×100)Fig. 1 Morphological observation of primary adipose-derived stem cells (×100)Most of the cells had attached to the wall, spindle shaped, with small amount of non-adherent circular lymphocytes (24h after inoculation, inverted microscope)
2 结 果
2.1 ADSCs的分离、培养、扩增 脂肪细胞悬液接种于培养瓶后,原代细胞经过24h体外培养后有大量贴壁细胞(图1),在4d内呈相对静止状态,之后细胞生长速度加快,并呈克隆样生长,12d左右达到细胞融合,细胞形态呈长梭形,比较均一。
2.2 自体ADSCs免疫表型鉴定结果 流式细胞检测显示,第3代ADSCs表面标记物CD73、CD90阳性率均大于95%,CD19、CD34阳性率低于3%(图2)。
2.3 诱导分化细胞的形态学和免疫组织化学鉴定吉姆萨染色结果显示,诱导分化前各组ADSCs在体外均正常生长和增殖,呈成纤维细胞形态,为长梭形(图3)。诱导7d后对ADSCs进行观察,除单纯EGF诱导组(B组)可见细胞死亡外,其余各组细胞形态无明显变化,仍呈长梭形。在诱导14d后,EGF和成纤维细胞培养基联合诱导组(D组)细胞呈多边形单层生长,呈“鹅卵石样”分布(图4);除D组外,其余各组细胞仍维持其原来的形状,且细胞分层生长,细胞因密度太大发生接触抑制,细胞界限不清,出现老化现象。CK-19免疫组织化学染色显示,EGF和成纤维细胞培养基联合诱导组(D组)细胞CK-19呈强阳性表达,多数细胞胞质呈深蓝色(图4),其余各组呈弱表达。
2.4 Western blotting检测结果 在诱导前的ADSCs中,鼻黏膜上皮细胞特异性蛋白CK-7、CK-14均呈现低表达,而在EGF与成纤维细胞培养基联合培养(D组)14d后,ADSCs中CK-7、CK-14蛋白表达明显增强(图5)。除D组外,其余各组均呈弱表达。

图2 第3代ADSCs的免疫表型鉴定Fig. 2 Identification of immunophenotype of passage 3 adipose-derived stem cells (ADSCs) The expression rate of CD73 and CD90 were >95%, and of CD34 and CD19 were <3% in passage 3 ADSCs

图3 诱导前ADSCs吉姆萨染色结果(×200)Fig. 3 ADSCs before induction (Giemsa staining ×200)
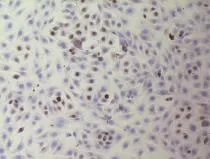
图4 CK19免疫组化染色(×200)Fig. 4 Expression of CK19 in ADSCs (Immunohistochemical staining ×200)
3 讨 论
近年来研究显示,骨髓间质干细胞具有多向分化潜能,可在体内外转化为多种不同类型的细胞,其作为组织工程的种子细胞已得到了广泛应用[3-5]。有研究发现,骨髓间质干细胞、造血干细胞和普通的骨髓细胞均可在体内生成肺组织和其他组织类型的上皮细胞[5-8]。脂肪组织与骨髓一样,均来源于中胚层,故ADSCs在细胞来源、生长增殖、分化潜能等方面与骨髓间质干细胞极为相似。但脂肪组织来源更为广泛,且ADSCs能保持稳定的倍增能力,并有体外扩增简单易行、免疫原性低和无伦理学限制等优点[9-11],已成为目前干细胞诱导分化研究的新热点。ADSCs作为间质干细胞,可向内、中和外三个胚层的细胞分化,在不同诱导条件下的分化方向不同。已有研究证实ADSCs可向软骨细胞、骨细胞、成纤维细胞、脂肪细胞、平滑肌细胞、神经细胞、心肌细胞、肝细胞和内皮细胞等分化[12-16]。ADSCs向上皮细胞定向分化的研究报道不多,如能成功诱导分化,可以为创面修复和组织再生等临床问题提供一种全新的解决方法。本研究通过流式细胞技术检测培养第3代的ADSCs,发现其高表达CD73、CD90,几乎不表达CD19、CD34,与既往研究结果一致[17-18]。
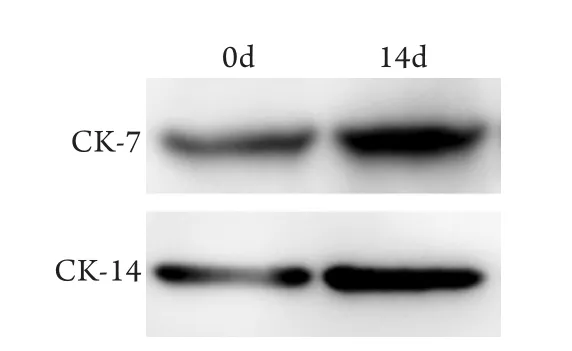
图5 ADSCs中CK-7、CK-14蛋白表达的Western blotting检测结果Fig. 5 Expression of CK-7 and CK-14 protein in ADSCs (Western blotting)
Baer等[19]认为细胞角蛋白(cytokeratin,CK)是在诱导分化过程中合成的第一种上皮细胞特异性结构蛋白,随着分化过程的进展,其他的上皮细胞角蛋白(如上皮细胞角蛋白7、14、19和20)[20-21]和另外一些上皮细胞标志物如卵透明带蛋白1 (zonaocdudensprotein 1,ZO1)[22]也逐渐获得阳性表达,这可作为证实诱导分化成功的检测指标之一[22]。本实验结果也证实,在EGF与成纤维细胞培养基联合诱导下,ADSCs可向黏膜上皮细胞分化。
EGF是最早发现的生长因子之一,它的体外作用主要是促细胞生长[23]。研究显示,EGF可促进表皮及角膜上皮的修复[24]。成纤维细胞培养基含有多种促进表皮细胞生长的因子。本研究结果显示,单纯应用EGF不能使ADSCs向上皮分化,甚至出现细胞死亡,可能是由于在无血清状态下,EGF不能提供足够的营养使细胞存活,因此,ADSCs不能发生转化。但EGF与成纤维细胞培养基联合应用能使其表达角蛋白,在诱导第7天,免疫组织化学染色显示极少的细胞表达角蛋白,至第14天时表达角蛋白的细胞增多,而未诱导和单纯条件培养基诱导的细胞角蛋白表达阴性,可能是由于在成纤维细胞条件培养基中还含有除EGF之外的多种诱导ADSCs分化为上皮细胞的因子,如可以促进上皮细胞增殖的胰岛素样生长因子(IGF)等。
鼻黏膜上皮主要由4类细胞组成:柱状纤毛上皮细胞、无纤毛柱状上皮、基细胞、分泌细胞[25-26]。基细胞位于上皮层的最深面,依靠半桥粒(hemidesmosomes)锚附于基底膜[27],不直接暴露于细胞层的腔面,其表面可特异性表达CK-14[26-28]。既往文献报道CK-7、CK-19是鼻黏膜上皮细胞最基本的细胞角蛋白组合之一[28]。鼻黏膜上皮细胞具有屏障功能及离子、水转运功能等重要生理功能,上皮细胞对表层液体层离子及水正常转运是发挥黏液纤毛传输功能的重要基础,已有临床研究证实,对黏膜受损的空鼻综合征患者,给予自体ADSCs可起到促进黏膜愈合的作用[29],为本研究结果提供了佐证。
综上所述,本研究结果证实,EGF与成纤维细胞培养基联合应用可作为诱导剂,诱导ADSCs向黏膜上皮细胞分化,为后续应用ADSCs作为黏膜上皮组织工程的种子细胞用于上皮缺损的修复提供了实验依据。但黏膜上皮细胞生长的微环境非常复杂,本研究未能完全模拟该环境,且体外诱导的上皮细胞要真正应用于临床还有很多问题需要解决。体内诱导虽可得到组织微环境的支持,通过细胞间的接触加速ADSCs向上皮细胞的分化,但由于干细胞向靶器官归巢的效率较低,且散在分布于上皮细胞之间的干细胞没有较好的方法来采集,因此很难研究干细胞的转归。尽管ADSCs定向分化为上皮细胞的研究还处于早期探索阶段,但随着对干细胞的分化机制、诱导方法及分化后细胞功能评价等问题的深入探讨,今后将会形成比较完善和成熟的干细胞诱导分化体系,以及逐渐完善的方法学鉴定手段,并可利用组织工程技术,探索更有效的诱导手段,最终将研究成果转化为临床所用。
[1]Xu YF, Zhang JW, Bao ZG,et al. Promoting neovascularization of adipose tissue derived stem cells compounding with different cellular scaffold in nude mice subcutaneous stratum[J]. J Zhengzhou Univ (Med Sci), 2013, 48(6): 773-776.[徐永飞, 张建文, 暴志国, 等. 脂肪来源干细胞复合不同生物支架在裸鼠皮下的促血管化作用[J]. 郑州大学学报(医学版), 2013, 48(6): 773-776.]
[2]Yamazaki M, Sato A, Toyoshima KE,et al. Polymorphic CAG repeat numbers in the androgen receptor gene of female pattern hair loss patients[J]. J Dermatol, 2011, 38(7): 680-684.
[3]Wu Y, Feng CJ, En HJRGL,et al. Inhibition effect of bone marrow-derived mesenchymal stem cells on skin scar formation in mice[J]. Med J Chin PLA, 2013, 38(1): 34-38. [武艳, 冯长江, 恩和吉日嘎拉, 等. 骨髓间质干细胞对小鼠皮肤瘢痕形成的抑制作用观察[J]. 解放军医学杂志, 2013, 38(1): 34-38.]
[4]Pittenger MF, Mackay AM, Jaiswal SC,et al. Multilineage potential of adult human mesenchymal stem cells[J]. Science, 1999, 284(5411): 143-147.
[5]Krause DS, Theise ND, Collector MI,et al. Multi-organ, multilineage engraftment by a single bone marrow-derived stem cell[J]. Cell, 2001, 105(3): 369-377.
[6]Kotton DN, Ma BY, Cardoso WV,et al. Bone marrow derived cells as progenitors of lung alveolar epithelium[J]. Development, 2001, 128(24): 5181-5188.
[7]Petersen BE, Bowen WC, Patrene KD,et al. Bone marrow as a potential source of hepatic oval cells[J]. Science, 1999, 284(5417): 1168-1170.
[8]Pereira RF, Halford KW, O'Hara MD,et al. Marrow stromal cells from marrow can serve as long-lasting precursor cells for bone, cartilage,and lung in irradiated mice[J]. Proc Natl Acad Sci U S A, 1995, 92(11): 4857-4861.
[9]Kern S, Eichler H, Stoeve J,et al. Comparative analysis of mesenchymal stem cells from bone marrow, umbilical cord blood, or adipose tissue[J]. Stem Cells, 2006, 24(5): 1294-1301.
[10] Jurgens WJ, Oedayrajsini-Varma MJ, Helder MN,et al. Effect of tissue-harvesting site on yield of stem cells derived from adipose tissue: implications for cell-based therapies[J]. Cell Tissue Res, 2008, 332(3): 415-426.
[11] Bunnell BA, Estes BT, Guilak F,et al. Differentiation of adipose stem cells[J]. Methods Mol Biol, 2008, 456: 155-171.
[12] Zuk PA, Zhu M, Ashjian P,et al. Human adipose tissue is a source of multipotent stem cells[J]. Mol Biol Cell, 2002, 13(12): 4279-4295.
[13] Strem BM, Hicok KC, Zhu M,et al. Multipotential differentiation of adipose tissue-derived stem cells[J]. Keio J Med, 2005, 54(3): 132-141.
[14] De Ugarte DA, Morizono K, Elbarbary A,et al. Comparison of multi-lineage cells from human adipose tissue and bone marrow[J]. Cells Tissues Organs, 2003, 174(3): 101-109.
[15] Ashjian PH, Elbarbary AS, Edmonds B,et al.In vitrodifferentiation of human processed lipoaspirate cells into early neural progenitors[J]. Plast Reconstr Surg, 2003, 111(6): 1922-1931.
[16] Seo MJ, Suh SY, Bae YC,et al. Differentiation of human adipose stromal cells into hepatic lineagein vitroandin vivo[J]. Biochem Biophys Res Commun, 2005, 328(1): 258-264.
[17] Tremolada C, Palmieri G, Ricordi C. Adipocyte transplantation and stem cells: plastic surgery meets regenerative medicine[J]. Cell Transplant, 2010, 19(10): 1217-1223.
[18] Gimble J, Guilak F. Adipose-derived adult stem cells: isolation, characterization, and differentiation potential[J]. Cytotherapy, 2003, 5(5): 362-369.
[19] Baer PC, Bereiter-Hahn J, Missler C,et al. Conditioned medium from renal tubular epithelial cells initiates differentiation of human mesenchymal stem cells[J]. Cell Prolif, 2009, 42(1): 29-37.
[20] Owens DW, Lane EB. The quest for the function of simple epithelial keratins[J]. Bioessays, 2003, 25(8): 748-758.
[21] Baer PC, Brzoska M, Geiger H. Epithelial differentiation of human adipose-derived stem cells[J]. Methods Mol Biol, 2011, 702: 289-298.
[22] Tan T, Qin SJ. Advances in study of adipose-derived stem cells in tissue engineering[J]. Chin Pharm Tech Econ Manag, 2008, 2(12): 58-62.[枟涛, 秦书俭. 脂肪干细胞在组织工程中的研究进展[J]. 中国医药技术经济与管理, 2008, 2(12): 58-62.]
[23] Li M, Guo ZH, Xie YD,et al. Effect of propranolol on the expression of growth factors and apoptotic factors related to infantile hemangiomas[J]. Med J Chin PLA, 2015, 40(2): 121-127.[李铭, 郭志辉, 谢义德, 等. 口服普萘洛尔对婴幼儿血管瘤相关生长因子及凋亡因子表达水平的影响[J]. 解放军医学杂志, 2015, 40(2): 121-127.]
[24] Merkle HP, Ditzinger G, Lang SR,et al.In vitrocell models to study nasal mucosal permeability and metabolism[J]. Adv Drug Deliv Rev, 1998, 29(1-2): 51-79.
[25] Crystal RG, Randell SH, Engelhardt JF,et al. Airway epithelial cells: current concepts and challenges[J]. Proc Am Thorac Soc, 2008, 5(7): 772-777.
[26] Dahl R, Mygind N. Anatomy, physiology and function of the nasal cavities in health and disease[J]. Adv Drug Deliv Rev, 1998, 29(1-2): 3-12.
[27] Rock JR, Onaitis MW, Rawlins EL,et al. Basal cells as stem cells of the mouse trachea and human airway epithelium[J]. Proc Natl Acad Sci U S A, 2009, 106(31): 12771-12775.
[28] Dong Z, Guan GM, Chang WL. Expression of cell proliferation and apoptosis gene associated protein on nasal polyps and its significance[J]. Chin J Otorhinolaryngol, 2000, 35(6): 429-431.[董震, 关桂梅, 常万龙. 鼻息肉组织中的细胞增殖与凋亡相关基因蛋白的表达及意义[J]. 中华耳鼻咽喉科杂志, 2000, 35(6): 429- 431.]
[29] Liu L, Jia DJ, Yan JL,et al. Clinical studies on theex-vivoexpansion of autologous adipose derived stem cells for the functional reconstruction of mucous membrane in empty nose syndrome[J]. Med J Chin PLA, 2014, 39(10): 815-818. [李梁,贾德进, 闫俊灵, 等. 体外扩增的自体脂肪干细胞对空鼻综合征患者黏膜功能重建的临床研究[J]. 解放军医学杂志, 2014, 39(10): 815-818.]
In vitrostudy on differentiation of adipose-derived stem cells into mucosal epithelial cells
WANG Cheng, XU Xiao, CHEN Chong, LI Liang, YAN Jun-ling, TANG Su-yang*
Department of Skin and Hair Regenerative Medicine, General Hospital of Chinese People’s Armed Police Forces, Beijing 100039, China
*< class="emphasis_italic">Corresponding author, E-mail: 2278645614@qq.com
, E-mail: 2278645614@qq.com
ObjectiveTo explore the possibility of inducing the differentiation of adipose-derived stem cells (ADSCs) into mucosal epithelial cellsin vitro.MethodsAdult subcutaneous adipose tissue was obtained for carrying out the isolation, culture, amplification and differentiation of ADSCs, and to identify the genetic stability of the third passage. The cultures were performed with DMEM culture media containing respectively 10% fetal bovine serum (FBS), 8μg/L epidermal growth factor (EGF), 10% FBS+8μg/L EGF, 10% FBS+8μg/L EGF+30% fibroblast cell culture medium, and 10% FBS+30% fibroblast culture medium. The light microscopic characteristics of the cells were observed before culture and 7 and 14 days after culture. The expression of specific cell surface markers and expression levels of CK-7 and CK-14 proteins in ADSCs before and after induction were detected by immunohistochemical staining and Western blotting respectively.ResultsCompared with the group without EGF, the morphology and arrangement of ADSCs induced by EGF for 14d were changed. Immunochemical staining showed CK-19 was strongly positive expressed. Western blotting analysis showed that CK-7 and CK-14 were strongly expressed in the epithelial cells.ConclusionAdipose-derived stem cells can be differentiated into mucosal epithelioid cellsin vitro.
adipose-derived stem cells; epidermal growth factor; epithelioid cells; cell differentiation
Q254
A
0577-7402(2015)10-0798-05
10.11855/j.issn.0577-7402.2015.10.06
2015-05-16;
2015-08-22)
(责任编辑:胡全兵)
王程,医学硕士。主要从事再生医学和整形外科方面的基础与临床研究
100039 北京 武警总医院皮肤再生医学科(王程、徐潇、陈冲、李梁、闫俊灵、汤苏阳)
汤苏阳,E-mail:2278645614@qq.com
