非焦煤炼铁基本原理再研究及最理想工艺与装备的设想(上)
2015-06-27郭汉杰
郭汉杰
(1:北京科技大学冶金与生态工程学院 北京100083;2:高端金属材料特种熔炼与制备北京市重点实验室 北京100083)
·专题综述·
非焦煤炼铁基本原理再研究及最理想工艺与装备的设想(上)
郭汉杰①1,2
(1:北京科技大学冶金与生态工程学院 北京100083;2:高端金属材料特种熔炼与制备北京市重点实验室 北京100083)
对非焦煤炼铁的诸多研究中,最重要的是要非常清楚氧化铁还原的基本原理。对碳素还原Fe2O3、Fe3O4和FeO的热力学原理做了进一步研究,找到了氧化铁碳素还原过程的最低碳素消耗和CO2的最小排放;并由Hess循环的计算,发现了高炉内部的碳还原铁的氧化物还原反应是在700~800K左右就与CO2分压达到了平衡。就C还原Fe2O3、Fe3O4和FeO来说,当CO2平衡分压为1时,与此对应的温度分别为853.06K,994.73K和1013K。在这些温度和CO2分压不大于1的条件下,高炉内部碳素还原铁氧化物的反应总是可以进行的,表明高炉内部得到铁的还原反应的条件是很宽松的,为非焦炼铁工艺发展的提供了参考借鉴和理论研究。
非焦煤炼铁 碳还原铁氧化物 二氧化碳排放
1 引言
长期以来,人们在研究的非焦煤炼铁,逐步演变为非焦煤的直接还原,但漫长的研究和工艺实施,进展似乎总是不能达到预期。本系列文章可以看出,从工艺和装备的角度看,非焦煤炼铁主要分为两大类:第一是800~900℃的中温固态还原,是利用还原性气体CO和H2;第二是在1300℃以上高温熔融还原,其还原剂直接使用煤。笔者认为非焦煤炼铁的研究与工艺实施的进展总是不能达到预期的主要原因,也许还是对碳素还原铁的氧化物的反应机理还没有完全被人们所认识,导致在工艺与装备的配置上多少有些盲目或不知所措。
另外当前世界范围都在关心“低碳”的问题[1],而钢铁的低碳革命被摆在首要位置,铁的氧化物的碳还原的极限到底是多少,似乎也没有一个明确的说法。欧盟启动了低碳制钢的ULCOS计划,提出了20年低碳路线图;日本拟定了低碳排放工业技术路线图及“冷地球50”的COURSE50计划。世界各国不约而同地把钢铁工业的减碳定位低碳革命的首要位置。根据IEA(国际能源机构)的预测,世界经济在低速增长下的钢产量在2015年将为16亿吨、2030年为19亿吨、2050年为23亿吨,而在高速增长下则分别为17亿吨、22亿吨、27亿吨。同时IEA还按照温室气体(按CO2计算)排放量2050年比2005年减半的目标提出了各行业的减排方案,有关钢铁业的目标如下:低速发展方案下,按60年全球钢铁业CO2排放总量为27亿吨的水平计算,到2050年的排放总量将达到47亿吨,而减排目标是降低到13亿吨。降低34亿吨CO2的主要措施是通过提高效率和转换燃料减排13亿吨、用可再生能源电力和节电减排12亿吨、CO2分离回收(CCS)减排9亿吨。在高速发展方案下,CO2总排放量由53亿吨减至13亿吨,应通过提高效率和转换燃料减排15亿吨、用可再生能源电力和节电减排14亿吨、CO2分离回收(CCS)减排11亿吨。因此,单位钢产量的CO2排放量需减至现今的1/3左右,任务相当艰巨。
任何事物的发展规律都应该是科学的发展,不应该脱离科学规律。
全球到目前为止,还没有找到一种材料可以取代钢铁材料,而钢铁材料的制取也没有找到实质上取代碳还原的方法,因此各国都在寻求碳还原过程中更为低碳的方法[3],欧洲低碳钢项目(ULCOS)[4]、生物质还原[5]。就炼铁的方法来说,ULCOS开发的Hisarna[6]和碱性电解炼铁工艺[7]等无疑都在最大限度降低工艺过程的碳消耗,以取得最低的CO2排放。但就热力学原理来说,到底碳还原制取铁的限度是多少?似乎还没有人进行系统的计算。
针对铁的氧化物的碳还原,设计几种在热力学上可能实现的热力学理论模型,提出碳还原过程的碳消耗和CO2排放的极限,以便在进行减碳的工艺设计时有明确的目标。
氧化铁利用碳还原的理论能量消耗及与此相适应的CO2排放都在各教科书中有很多种计算,似乎已经形成定论,没有必要再研究了,但找遍所有的教科书,没有找到碳还原制铁的最低量的计算值及依据。
在对氧化物进行还原时,可以利用C与CO作为还原剂,可以分别利用Ellingham图和计算两个方面讨论其还原性的强弱,如图1所示。以进一步讨论高炉内部的直接还原与间接还原的问题。
直接还原反应的还原剂:
2C+O2=2CO
ΔrGφ=-232630-167.78T
(1)
间接还原反应的还原剂:
2CO+O2=2CO2
ΔrGφ=-558150-167.94T
(2)
由式(2)-(1)得:
2CO=CO2+C
ΔrGφ=-162760+167.86T
(3)
这个反应即是碳的气化反应的逆反应,也表示直接还原与间接还原的转化。

T转=969.6K
C与CO作为还原剂的讨论,可从图1看出,在标准状态下:
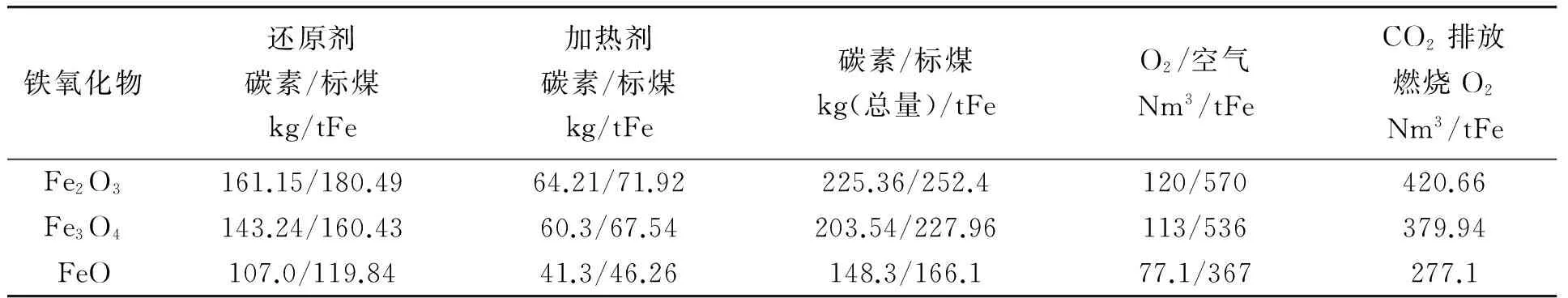
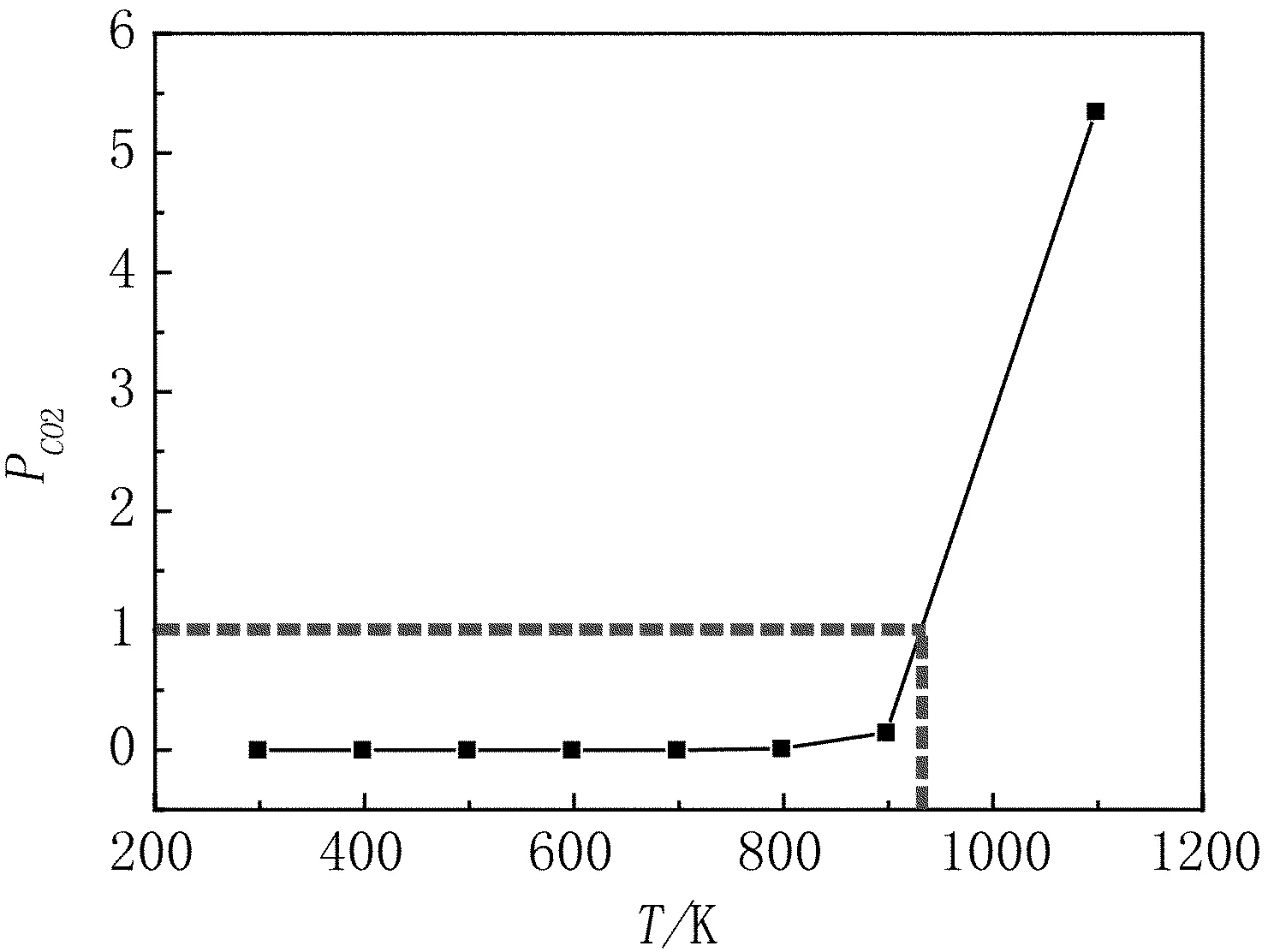
1)当T 2)在T=T转(969.6K),CO与C的还原能力相同,这时C与CO对氧化物的直接还原、间接还原同时进行; 3)T>T转(969.6K),C的还原能力比CO强,体系中发生直接还原反应,但还原反应发生是在2C+O2=2CO线与每一条线交点温度以上的温度范围。 图1 C与CO作为还原剂的还原强弱比较 一定要强烈关注反应(3)!虽然它的正逆反应过程代表了直接还原与间接还原的转化过程,它实际上还是还原气CO中的碳素析出(正反应,所谓的积碳)和碳素气化(逆反应)的原理,由于篇幅的关系,在此不再赘述。 综上所述,对于铁的氧化物还原的热力学原理还有必要进行深入的基础研究,这些都清楚了,非焦煤炼铁也就清楚了。但必须指出,高炉炼铁是人类炼铁历史上迄今为止发展最为成熟的工艺、装备,所以在研究铁还原的基本原理过程中,还必须要对高炉过程进行基础研究,为非焦煤炼铁寻求工艺和装备上的发展依据。 1)利用热力学原理研究问题的便利是只需考虑始态和终态,虽然氧化铁碳还原的工艺都设计在高温下完成的,但使用的原料铁矿和碳素是由常温开始,升高温度到达反应温度(TK),完成还原反应后,得到铁再降低到常温。 (注:以下诸章节中为了研究方便,暂时不研究H2的还原。) 2)最理想铁的氧化物碳还原的热力学原理为: 这其中,组元数C=5,分别为FexOy、CO2、O2、Fe、C;元素数m=3,分别为:Fe、C、O,所以在这个体系中独立的化学反应数为: r=C-m=5-3=2 因此从热力学理论上,只要用两个独立的化学反应描述氧化铁的碳还原,从最原始的状态到获得产物的末态,实际上就反映了全部的工艺过程。 3)另外,就进一步的反应机理研究中,必须注意到一个问题,碳素在反应体系中不仅充当还原剂的角色,由于还原反应需要反应热,它必须进行氧化反应,以提供给体系用以支撑反应体系的运行。因此从理论上将还原铁的氧化物所需的碳分为两部分,一是碳作为还原剂所消耗的量是多少;二是还原过程都是吸热反应,碳作为发热剂所提供的量是多少。理论上还原铁的过程所需的碳是这两部分相加和。 4)因此根据热力学的基本原理,研究铁的氧化物碳还原工艺的理论基础是,建立科学选取2个独立的化学反应的基础上,利用热力学的Hess定律进行工艺设计,而促成Hess循环反应的能量由碳的完全燃烧反应提供。这是最理想的、能源极限利用的及CO2最低排放的炼铁流程,其热力学模型的构成如反应(4)(5)所示。 C+Fe2O3(Fe3O4)→Fe+CO2(298K)ΔHφ (4) ↓ ↑ C+Fe2O3(Fe3O4)→Fe+CO2(K) C+O2=CO2 (5) 5)可以看出,这是一个想象中最理想的碳还原氧化铁的理论模型,其中的能源消耗分为两个部分: (1)按照反应(4)还原的化学计量所需要的碳素; (2)由碳的完全燃烧反应(5)提供给反应(4)需要的化学热所消耗的碳素; (3)CO2的排放由反应(4)及(5)的化学计量算出。 2.1 C还原铁的氧化物的理论消耗及CO2排放的计算 1)首先根据上述设计的最理想的理论模型,从理论上计算还原Fe2O3的耗碳量。以还原1kgFe计算,若碳素还原Fe2O3的反应,计算还原时碳素的理论消耗。由化学反应(6)、(7) C+O2=CO2 ΔH298φ=-393.52kJ/mol (6) ΔH298φ=-825.5kJ/mol (7) 得反应(8) 2Fe2O3+3C=4Fe+3CO2ΔH298φ=470.44kJ (8) 36 223.4 470.44kJ x 1000 y 注:此处36为3mol碳的质量;223.4为4mol铁的质量;470.44kJ为反应热,根据交叉相乘的原理,可以计算还原1000g铁需要的碳的质量和需要提供的热量。 由此计算得: (1)还原1kg铁,理论需要的还原剂碳素为 (2)需要提供的热量为 这些热量如果全部由碳素完全燃烧反应(6)提供,则由 C+O2=CO2ΔH298φ=-393.52kJ/mol 可计算得,提供这些热量需要碳的质量和O2的量分别为 或空气 综合以上两项,在碳素同时作为还原剂和发热剂两个角色时,发生的反应都是完全的前提下,则还原1kgFe2O3的总消耗为 WC=161.15+64.21=225.36g 所以,热力学理论意义上,还原反应和碳的燃烧反应都进行完全的前提下,用Fe2O3还原1t铁需要碳素为225.36kg(其中还原剂碳161.15kg,发热剂碳为64.21kg);需要O2为120Nm3(或空气570Nm3)。 2)以下还有两项需要计算: (1)1kg的碳素和1kg标煤的区别与换算 在工业统计时一般都用标准煤Ce的概念,理论意义上的碳素和标煤Ce的关系如何?有必要首先推算标准煤Ce和碳素C热值的关系。理论上1kg碳素完全燃烧的发热量为: 而1kg标煤的发热量的定义为: 这样的话,如果按照发热值计算,1kg标煤Ce与1kg碳素C的换算为: 1kgC=1.12kgCe 现在的各种工业统计都是以标煤计量的,可以将上述碳素还原铁的氧化物的理论消耗折算为标煤,最理想的氧化铁碳还原理论碳耗为252.4kgCe/tFe。 (2)CO2的生成 从反应(6)和反应(8)可以看出,不管是碳素还原铁的反应还是碳素的燃烧反应,碳的消耗与O2的消耗的化学计量是相同的,这两部分分别为: 碳素还原产生的CO2为: 碳素燃烧产生的CO2为: 二者合计,即为理论上用碳素还原一吨铁产生的CO2排放为:420.66Nm3/tFe。 3)同理,可以计算碳素还原Fe3O4的理论能耗及其他相关数据,与Fe2O3的计算结果一并列于表1中。 从表1可以看出,不同的铁氧化物的理论碳素消耗差别很大,使用磁铁矿(Fe3O4)比使用赤 表1 两种铁的氧化物碳还原的理论能耗、用氧及CO2排放 铁矿(Fe2O3)炼铁时,理论上吨铁少消耗21.82kg的碳素(24.44kgCe)和7Nm3的氧气(33.33Nm3空气)。 2.2 理想的铁氧化物碳还原过程趋势推测 在上面提出的理想的铁氧化物碳还原的热力学模型能否进行,需要用热力学理论进行验证,并对反应的趋势进行预测。 2.2.1 碳素还原Fe2O3的反应热力学 1)利用标准自由能计算碳素还原Fe2O3的趋势。设Fe2O3的碳还原反应为 2Fe2O3+3C=4Fe+3CO2 (9) 计算其标准自由能,使用的热力学数据[8]: ΔGφ=-540570+170.29T (298-1809K) CS+O2=CO2 ΔGφ=-395390+0.08T (298-3400K) 得式(10) ΔrGφ=435540-510.63T (10) 利用化学反应的等温方程式 ΔGφ=-RTInPCO2 整理,得(11) (11) 2)可以做T与PCO2的关系图,如表2及图2。 可以看出,用碳还原Fe2O3生成CO2的反应,是随着温度的增加,平衡的CO2压强也逐渐增加。有以下规律: (1)在温度为700K之前,CO2平衡压强都非常小,趋于零。说明此时体系稍微有压强很小的CO2,碳都是不可能还原Fe2O3的; (2)当温度大于700K,随着温度的增加,CO2平衡压强迅速增加,当温度增加到850K左右时,CO2平衡压强接近1。也就是说,CO2平衡压强随温度的变化都基本上在这150K的温度范围内,这 表2 氧化铁碳还原理想模型T与PCO2的关系 图2 Fe2O3的碳还原理想模型CO2压强与温度的关系 段范围,只要体系中的CO2压强小于平衡压强,碳还原Fe2O3的反应都是可以进行的; (3)当反应产生的CO2压强PCO2=1时,温度增加到T=853.06K。这就是说,当温度大于T=853.06K,即使CO2压强恒等于1,在体系中存在碳素的情况下,稍微增加反应温度,碳还原Fe2O3的反应都将继续进行。 3)以上讨论说明,按照理想的热力学模型,在任何反应器中,只要提供体系中T=853.06K的温度,用碳与Fe2O3的反应都是可以无条件进行的。因为产生的CO2压强绝对不会超过、甚至远低于图2中的平衡值。 2.2.2 碳素还原Fe3O4的反应热力学 利用标准自由能计算碳素还原Fe3O4的趋势。设反应为 Fe3O4+2C=3Fe+2CO2 (12) 使用的热力学数据[8]: 3Fe+2O2=Fe3O4 ΔGφ=-1085540+296.39T(1500~1650K) C(S)+O2=CO2 ΔGφ=-395390+0.08T(298~3400K) 得反应(12)的标准自由能表达式,如式(13) ΔrGφ=294760-296.23T (13) 由(13)及化学反应等温方程式整理,得式(14) (14) 由式(14),可得反应时(12)平衡温度T与PCO2的关系,如表3所示。 表3 碳素还原Fe3O4的平衡温度T与PCO2的关系 可以做T与PCO2的关系图,如图4所示。 图3 碳素还原Fe3O4的平衡温度T与PCO2的关系 由表2和图3可以看出,碳还原Fe3O4的反应趋势与还原Fe2O3的反应趋势差不多,所不同的是温度与压强的关系整体提高了100K左右,CO2压强增加到1的温度范围也延长了50K左右;当平衡的PCO2=1时,与此对应的T=994.73K。 2.2.3 碳素还原FeO的反应热力学 1)利用标准自由能计算碳素还原FeO的趋势。设反应为 2FeO+C=2Fe+CO2 (15) 使用的热力学数据[8]: ΔGφ=-261920+63.51T(1500~1650K) C(S)+O2=CO2 ΔGφ=-395390+0.08T(298~3400K) 得反应(15)的标准自由能表达式,如式(16) ΔrGφ=128450-126.94T (16) 由(16)及化学反应等温方程式整理,得式(17) (17) 由式(17),可得反应时(15)平衡温度T与PCO2的关系,如表4所示。 2)由表3和图4可以看出,碳还原FeO的趋势与还原Fe2O3、Fe3O4的趋势差不多,所不同的是,温度与压强的关系整体又提高了,当平衡的PCO2=1时,与此对应的温度由Fe3O4的T=994.73K增加到T=1013K。 3)可以看出,以上三个氧化物Fe2O3、Fe3O4和FeO的碳还原的讨论虽然简单,但从热力学原理上更为直观,反映了热力学的本质,还原了铁冶炼的始态和状态。就高炉而言,铁的氧化物还原就是把含有碳素的固体焦炭和固态的铁的氧化物加入,在生成铁和CO2(当然还有CO)。从高炉出来的CO2的分压(一般为0.2~0.3),由此可以得到两点结论: (1)高炉内部的碳还原铁的氧化物还原反应是在700~800K左右就与CO2分压达到了平衡; (2)就C还原Fe2O3、Fe3O4和FeO来说,当平衡的PCO2=1时,与此对应的温度分别为T=853.06K、T=994.73K和T=1013K。 图4 碳还原FeO平衡温度T与PCO2的关系 T/KPCO23001.82E-164007.12E-115001.61E-076002.78E-057000.0011018000.0173799000.14857510000.82695910100.96364810110.97833910120.99322510131.00830711003.368762120010.85906 通过对碳素还原铁的三种氧化物Fe2O3、Fe3O4和FeO的热力学研究,找到氧化铁碳素还原过程的最低碳素消耗和CO2的最小排放,研究 发现了如下结论: 1)不同的铁氧化物的理论碳素消耗差别很大,使用磁铁矿(Fe3O4)比使用赤铁矿(Fe2O3)炼铁时,理论上吨铁少消耗21.82Kg的碳素(24.44KgCe)和7Nm3的氧气(33.33Nm3空气) 2)利用热力学的Hess循环计算发现高炉内部的碳还原铁的氧化物还原反应是在700~800K左右就与CO2分压达到了平衡; 3)就C还原Fe2O3、Fe3O4和FeO来说,当平衡的PCO2=1时,与此对应的温度分别为T=853.06K、T=994.73K和T=1013K。也就是说,如果高炉内部铁的氧化物在这些温度时,PCO2≤1的情况下,碳素还原氧化铁的反应总是可以进行的,说明高炉内部铁的还原反应的条件是很宽松的。 [1]徐匡迪. 低碳经济与钢铁工业钢铁[J]. 钢铁,2010(3):1-12. [2]郭廷杰. 低碳炼铁的潜能有多大[N]. 中国冶金报,2014年6月26. [3]王东彦. 超低碳炼钢项目中改造型炼铁工艺研发进展[J]. 世界钢铁,2011(1):29-37. [4]Koen Meijer, Mark Denys, Jean Lasar, et al. ULCOS: ultra-low CO2steelmaking[J]. Ironmaking and Steelmaking, 2009, Vol.36 (4): 249-251. [5]Birat J P, Lorrain J P, de Lassat Y. The “CO2Tool”:CO2emissions & energy consumption of existing & breakthrough steelmaking routes [J]. Revue deMétallurgie, 2009 (9): 325-336. [6]Bellevrat E,Menanteau Ph. Introducing carbon constraint in the steel sector:ULCOS scenarios and economic modeling [J]. Revue deMétallurgie, 2009 (9): 318-324. [7]Link J.IRMA-flow sheet model examples of application [J]. Revue deMétallurgie, 2009 (10): 398-403. [8]张家芸. 冶金物理化学[M]. 北京:冶金工业出版社,2004. Future Study on the Basic Principle and the Imagination on the Ideal Technology and Equipment for Non-coking coal Ironmaking Process (Ⅰ) Guo Hanjie1,2 (1:School of Metallurgical and Ecological Engineering, University of Science and Technology Beijing, Beijing 100083;2:Beijing Key Laboratory of Special Melting and Reparation of High-end Metal Materials, Beijing 100083) For the study on the non-coking coal ironmaking, the most important thing is to make clear the basic principle of iron oxide reduction. Further research on the thermodynamic principle of Fe2O3, Fe3O4and FeO reduction by carbon was made, to search the minimum carbon consumption and the minimum CO2emission. By Hess Cycle calculation, the result that when temperature was around 700~800K, CO2partial pressure could reach a balance for the iron oxide reduction reaction inside the blast furnace, was found. For C reducing Fe2O3, Fe3O4and FeO, when CO2partial pressure reaches a balance, the corresponding temperature are 853.06K, 994.73K and 1013K. At these temperatures and CO2partial pressure≤1, the iron oxide reduction reaction can always carry through, which turns out that the reduction condition inside blast furnace is very loose, and provides reference for non-coking coal ironmaking process. Non-coking coal ironmaking Reduction of iron ores with C CO2emission 郭汉杰,男,1957年出生,1992年3月毕业于北京科技大学获得博士学位,教授,博士生导师,主要研究方向:冶金物理化学;冶金能源综合利用;导磁与磁性材料等 TF557 A 10.3969/j.issn.1001-1269.2015.05.001 2015-06-22)
2 氧化铁碳还原最理想的热力学模型




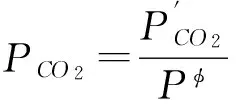





3 结论
