新型1, 2, 4-三唑重金属离子荧光淬灭剂的合成、表征与性能
2015-06-27陈连清谢林波钟柔潮兰少花雷小萍陆俭洁
陈连清,谢林波,钟柔潮,兰少花,雷小萍,陆俭洁
(中南民族大学 催化材料科学国家民委-教育部共建重点实验室, 武汉 430074)
新型1, 2, 4-三唑重金属离子荧光淬灭剂的合成、表征与性能
陈连清,谢林波,钟柔潮,兰少花,雷小萍,陆俭洁
(中南民族大学 催化材料科学国家民委-教育部共建重点实验室, 武汉 430074)
为寻找快速显示重金属离子并生成沉淀去除的新型荧光淬灭剂,以4-氨基-3,5-二(2-羟基苯基)-1,2,4-三唑[NH2C2N3(C6H4OH)2]为配体,合成重金属(Co, Cr, Mn, Ni)配合物,通过IR,1H NMR,13C NMR, MS和元素分析等确认其配位方式和结构,并测试了配合物的热重、紫外和荧光淬灭性能.结果表明:此类金属配合物热稳定性较好,Mn和Ni配合物高温下分解为氧化物;配合物的紫外吸收强度较配体有所减弱;配体荧光与重金属离子配位后发生淬灭,说明重金属离子Co, Cr, Mn, Ni是1,2,4-三唑配体优良的荧光淬灭剂,可通过配位生成沉淀去除.
1, 2, 4-三唑;金属配合物;合成;热性能;荧光淬灭剂
重金属离子特别是Co, Cr, Mn, Ni等对环境积累效应所致危害日趋严重,而目前对其荧光显示和去除技术极为有限[1]. 三唑配合物具有特殊的磁学、光学、电学等性质,在荧光传感领域中具有极大的潜在应用价值[2]. 如1, 2, 4-三唑配合物可应用于光学材料、染料、信息储蓄、抗肿瘤和重金属离子荧光传感等[3].1, 2, 4-三唑衍生物是富含N原子的杂环化合物,是很好的荧光材料,其三氮杂环与苯环共轭形成较大π-电子共轭体系,离域电子较易激发,导致很强的荧光发射;而当它的共轭体系被破坏或由富电子基团(三唑环)向缺电子基团(金属离子)发生电子转移,会导致荧光淬灭,其中重金属离子、氧分子和硝基化合物等均可作为1, 2, 4-三唑的淬灭剂[4].
4-氨基-3,5-二(2-羟基苯基)-1,2,4-三唑[NH2C2N3(C6H4OH)2]具有多个配位点,有丰富的配位模式(末端、桥联、螯合),易与重金属离子络合形成金属配合物[5-7]. NH2C2N3(C6H4OH)2含有2个羟基和1个氨基,与金属离子配位能力强,但由于N和O原子与部分金属离子络合形成配合物后,破坏了三唑杂环与苯环形成的共轭体系,三唑环的电子云向金属离子偏移,导致金属配合物发生荧光淬灭,可快速指示环境中重金属离子的存在,并生成沉淀去除.本文利用NH2C2N3(C6H4OH)2具有较强荧光发射,与重金属离子络合后,荧光发生淬灭,可快速显示重金属离子的存在;同时生成配合物沉淀,可将重金属离子捕获并去除的特性,首次设计合成了NH2C2N3(C6H4OH)2的重金属离子(Co, Cr, Mn和Ni)配合物,并探究其热稳定性和荧光淬灭性能,合成路线如图1.

图1 NH2C2N3(C6H4OH)2配体和金属配合物的合成路线Fig.1 Synthetic route of 3, 5-bis(o-hydroxyphenyl)-4-amino-1,2,4-triazole ligand and metal complexes
1 实验部分
1.1 主要试剂和仪器
水杨酸、水合肼等(上海国药集团化学试剂公司),三水合醋酸锰、六水合三氯化铬、六水合氯化钴、四水合醋酸镍等购(阿拉丁公司),均为市售分析纯,使用前未进一步纯化.
傅里叶红外光谱仪(KBr压片, Nexus 470 FTIR型,日本岛津),GC-Mass (Agilent 6890N- 5973N型,美国),元素分析仪(VarioEL III CHNS型,美国),质谱仪(ZAB 3F-HF型,美国),核磁共振仪(Bruker AVANCE 400 MHz型,德国),紫外-可见光谱分光光度计(Lambda-Bio35,日本岛津),荧光分光光度计仪(PE LS-55型,美国),热分析仪(TGS-2 型,美国Perkin-Elmer),X射线光电子能谱仪(VG Multilab 2000,美国Thermal Electron),CCD单晶衍射仪(Bruker Smart-APEX II,德国).单晶用惰性油粘在玻璃丝上作晶胞测定,所有数据在Bruker AXS Smart CCD衍射仪上用石墨单色化的MoKα射线 (λ=0.71073 Å)收集.所有的非氢原子用各向异性的参数描述,在SHELXL-97 程序上用F2全矩阵最小二乘法优化,氢原子在计算的位置导入.所有的晶体结构图由ORTEP-3软件画出.
1.2 4-氨基-3, 5-二(2-羟基苯基)-1,2,4-三唑[NH2C2N3(C6H4OH)2](L)的合成
100 mL烧瓶中加入4.08 g (0.015 mol)N,N′-二(2-羟基苯甲酰)肼和20 mL水合肼搅拌回流3 h,旋蒸出过量的水合肼,剩余油状物中加入冰水,即析出沉淀[8],抽滤,粗产物用无水乙醇重结晶,得粉红色晶体1.83 g,产率49.0 %,熔点: 259~260℃. IR (KBr, cm-1): 3425(O-H), 3332 (N-H), 2920, 2676, 2557 (=C-H), 1582 (C=N), 1525, 1485 (苯环骨架), 1380(O-H面内弯曲), 1248 (C=N-N), 1162, 1011 (芳醚C-O).1H NMR(400 MHz, DMSO-d6)δ:11.27 (s, 2H, OH), 8.06 (q, 2H, Ph-H), 7.43 (m, 2H, Ph-H), 7.04 (q, 4H, Ph-H), 6.14 (s, 2H, NH2).13C NMR (400 MHz, DMSO-d6)δ: 156.53,153.46,132.05,130.24,119.59,116.95,113.20; MS (FAB):m/e,267 (M+). 晶体数据见表1.

表1 配体L的晶胞参数
注:1)R= ∑||Fo|─|Fc||∕ ∑|Fo|; 2)wR= [∑w(|Fo│2─|Fc|2)2]/ ∑w|Fo|2]1/2
1.3 三唑金属(Co,Cr,Mn,Ni)配合物的合成
将0.268 g (1 mmol) NH2C2N3(C6H4OH)2的15 mL甲醇溶液滴加到氯化钴(0.2380 g,1.0 mmol),三氯化铬(0.2664 g),醋酸锰(0.2270 g),醋酸镍(0.2488 g)的 3 mL甲醇溶液中,室温搅拌1 h,得到沉淀,抽滤、水洗、真空干燥,即得配合物,产量分别为0.23 g (0.21 g,0.26 g,0.20 g).
Co[NH2C2N3(C6H4OH)(C6H4O)]3(1):紫红色粉末,产率80.1%. IR (KBr,cm-1): 3414 (O-H),3329 (N-H),2698,2588 (=C-H),1620 (C=N),1526,1482 (苯环骨架),1427 (O-H面内弯曲),1254 (C=N-N),1160,1111,1019 (芳醚C-O).1H NMR (400 MHz,DMSO-d6)δ: 11.24 (s,3H),8.05 (d,6H),7.42 (q,6H),7.06 (m,12H),6.15 (s,3H).13C NMR (400 MHz,DMSO-d6)δ: 206.90,156.56,132.05,130.21,119.59,113.24,79.66,31.12. Anal. Calc for C42H33N12O6Co:8.61,H 3.86,N 19.53; Found C 58.87,H 3.95,N 19.31. MS (FAB):m/e,861 (M+).
Cr2[NH2C2N3(C6H4O)2]3(2):浅蓝色粉末,产率70.0%. IR (KBr,cm-1): 3437 (H2O),3360 (N-H),2975,2367 (=C-H),1621 (C=N),1522,1485 (苯环骨架),1256 (C=N-N),1156,1089,1045 (芳醚C-O).1H NMR (400 MHz,DMSO-d6)δ: 7.96 (d,6H),7.43 (t,6H),7.00 (q,12H),6.18 (s,6H).13C NMR(400 MHz,DMSO-d6)δ: 156.61,132.78,130.82,119.69,116.95. Anal. Calc for C42H30N12O6Cr2: C 55.88,H 3.35,N 18.62; Found C 56.47,H 3.51,N 17.56. MS (FAB):m/e,903 (M+).
Mn2[NH2C2N3(C6H4O)2]2(3):浅红色粉末,产率81.0%. IR (KBr,cm-1): 3420 (H2O),2972 (=C-H),1623 (C=N),1482 (苯环骨架),1253 (C=N-N),1088,1047 (芳醚C-O).1H NMR (400 MHz,DMSO-d6)δ: 8.04 (s,4H),7.39 (s,4H),7.02 (d,8H).13C NMR(400 MHz,DMSO-d6)δ: 206.93,79.67,31.15. Anal. Calc for C28H20N8O4Mn2: C 52.35,H 3.14,N 17.10; Found C 52.93,H 3.20,N 16.73. MS (FAB):m/e,643 (M+).
Ni2[NH2C2N3(C6H4O)2]2(4):深绿色粉末,产率62.1%. IR (KBr,cm-1): 3425 (H2O),2850,2650,2390 (=C-H),1610 (C=N),1485,1463 (苯环骨架),1264 (C=N-N),1150,1121,1028 (芳醚C-O).1H NMR (400 MHz,DMSO-d6)δ: 8.04(d,4H),7.41~7.38 (t,4H),7.07 (d,4H),7.00~6.96 (t,4H).13C NMR(400 MHz,DMSO-d6)δ: 156.67,153.54,132.04,130.24,119.51,117.02,113.26. Anal. Calc for C28H20N8O4Ni2: C 51.75,H 3.10,N 17.24; Found C 52.13,H 3.27,N 17.08. MS (FAB):m/e,650 (M+).
2 结果与讨论
2.1 配体L及金属配合物合成
合成配体NH2C2N3(C6H4OH)2时,因邻羟基苯甲酰氯与水合肼反应剧烈难控制,而采用单酰肼法合成三唑环,即将邻羟基苯甲酰氯酯化后与水合肼交换反应得到单酰肼-邻羟基苯甲酰肼,再与邻羟基苯甲酰氯缩合环化得到取代三唑.化合物中的N或O周围丰富的孤对电子易与金属离子中的空轨道配位形成配位键,且含N的配体属于硬碱,含O的配体是软碱,易与金属离子进行络合配位生成难溶的沉淀.反应条件温和,易控制,时间短,副产物少,产率高.
2.2 红外光谱表征
配体L和金属配合物的红外光谱见图2.由图2可知,5个化合物在1580~1480 cm-1范围内均有吸收峰,归属为苯环骨架振动峰;1620 cm-1附近是C=N的伸缩振动吸收峰 (L: 1582 cm-1, 1: 1620 cm-1, 2: 1621 cm-1, 3: 1623 cm-1, 4: 1610 cm-1),比普通C=N键的吸收(1630 cm-1)偏低,这是由于C=N与苯环形成π-π共轭导致C=N向低波数移动.1260 cm-1附近是三唑环体系C=N-N的伸缩振动峰[9];配体L在3425 cm-1的伸缩振动吸收峰,表明分子存在-OH,在3300 cm-1附近的吸收峰,与分子中存在-NH2相符.配合物1在3414 cm-1处出现-OH的伸缩振动峰,1427 cm-1出现-OH面内弯曲振动峰,说明1存在游离-OH,在1160和1111 cm-1出现Ar-O的伸缩振动峰,说明1中只有1
个-OH参与Co离子配位.配合物2在3437 cm-1处出现-OH的伸缩振动峰,在1156和1089 cm-1出现Ar-O的伸缩振动峰,说明-OH均参与Cr离子配位;在3360 cm-1处出现N-H伸缩振动峰, 1522 cm-1处出现伯胺特征吸收峰,说明-NH2未参与配位.配合物3和4在3330 cm-1附近N-H伸缩振动峰消失,在1522 cm-1处无N-H面内弯曲振动峰,说明-NH2参与配位;在3420 和3425 cm-1处出现-OH的伸缩振动峰,未见羟基面内弯曲振动峰,在1156和1089 cm-1出现Ar-O的伸缩振动峰,说明-NH2均参与Mn或Ni离子配位;配合物2,3和4在3437,3420 cm-1和3425 cm-1有吸收,是样品置于空气中水的-OH干扰所致.具体数据见表2.

σ/cm-1图2 配体L及金属配合物的红外谱图Fig.2 FT-IR spectrum of ligand L and metal complexes

不同配合物σ/cm-1-OH芳醚N-H伸缩N-H面内=C-H;苯环骨架;C=N-NC=NL3425(1380)1162,101133321525(-NH2)2920,2676,2557;1485;1248158213414(1427)1160,1111,101933291526(-NH-)2698,2588;1482;1254162023437(游离)1156,1089,104533601522(-NH2)2975,2367;1485;1256162133420(游离)1088,1047--2972;1482;1253162343425(游离)1150,1121,1028--2850,2650,2390;1485,1463;12641610
注:- 表示吸收峰消失
2.3 NMR表征
从配体L和配合物核磁氢谱可知,苯环上羟基质子的化学位移为L:11.27(1: 11.24),8.05~7.00处多重峰,归属于苯环上H的化学位移;L:6.14(1: 6.15; 2: 6.18)处单峰,归属于-NH2氨基上H的化学位移. 在配体L和配合物核磁碳谱中,由于O原子的电负性较大,诱导效应使与O相连的两个C带部分正电荷,其δ值向低场位移;与N相连的C诱导效应和共轭效应的共同作用δ值向低场位移. 结合IR和NMR数据,证实Co配合物以一个-OH和-NH2的配位模式被成功合成;Cr配合物以-OH配位,-NH2游离的配位模式;Mn和Ni配合物以-OH和-NH2均络合的配位模式.图3中XPS数据进一步证实Ni配合物被成功合成.
配体和金属配合物的1H NMR和13C NMR结果见表3.由表3可知,4种金属离子与三唑的配位模式均采用-OH中的O或-NH2中的N孤对电子进行配位,与三唑环中的N关系不大,核磁和红外数据等证实Co离子与配体中-OH和-NH2的O和N进行配位,存在游离-OH,分子式为Co[NH2C2N3(C6H4OH)(C6H4O)]3;Cr离子只与配体中OH的O进行配位,存在游离-NH2,分子式为Cr2[NH2C2N3(C6H4O)2]3;Mn和Ni金属离子与配体中-OH和-NH2的O和N原子进行配位,不存在游离-OH和-NH2,分子式Mn2[NH2C2N3(C6H4O)2]2和Ni2[NH2C2N3(C6H4O)2]2.

表3 配体和金属配合物的1H NMR和13C NMR
注:- 表示吸收峰消失
2.4 配合物4的XPS表征
由Ni配合物的XPS能谱(见图3)可知,配合物中存在Ni、O、N、C元素的特征能谱峰,其电子结合能分别为868(Ni2p),532(O1s),400 (N1s) 和285(C1s) eV,进一步说明Ni离子与3, 5-二(2-羟基苯基)-4-氨基-1,2,4-三唑配位成功.

图3 配合物4的XPS全谱图和各元素的高分辨能谱图 (插图)Fig.3 XPS spectrum of complex 4 and high-resolution energy spectrum of each element (illustration)
2.5 晶体结构
配体NH2C2N3(C6H4OH)2的晶胞图和分子堆积结构结果见图4和图5,部分键长和键角见表4.C2N3(C6H4OH)2NH2配体分子中有3个芳环,其中1个苯环和三唑环在同一平面,并与另一个苯环所在的平面成90°角.三唑环两边为对称结构,C(7)-N(1)、C(8)-N(2) 是双键,其键长1.317(3)Å比C(7)-N(3)、C(8)-N(3)键长1.369(3)Å短;N(1)-N(2)键长1.386(3)Å比N(3)-N(4)的键长1.416(3)Å短,主要是N(1)-N(2)与C(7)、C(8)之间存在键长平均化.

图4 配体L的分子结构图Fig.4 The molecular structure of ligand L
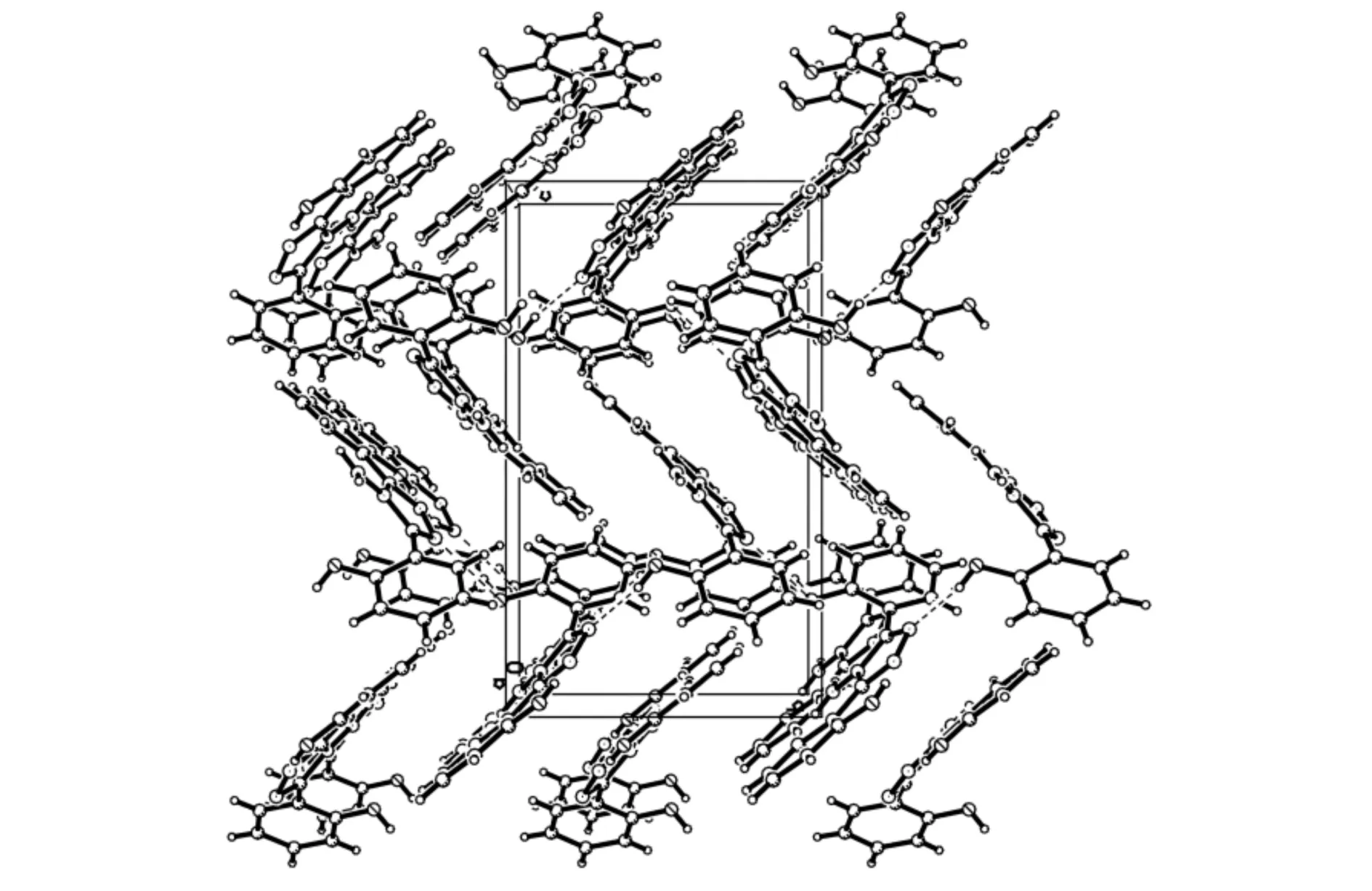
图5 配体L的分子堆积结构 Fig.5 Molecular Packing structure of ligand L

成键原子键长/Å键角原子键角/(°)键角原子键角/(°)C(1)-O(1)1.356(4)N(1)-C(7)-N(3)108.2(2)C(8)-N(2)-N(1)107.3(2)C(7)-N(1)1.317(3)N(2)-C(8)-N(3)109.0(2)H(4A)-N(4)-H(4B)120.0C(7)-N(3)1.369(4)O(2)-C(14)-C(9)118.1(2)N(3)-C(8)-C(9)124.9(2)C(8)-N(2)1.317(3)C(7)-N(1)-N(2)108.6(2)O(2)-C(14)-C(13)122.9(3)C(8)-N(3)1.369(3)C(8)-N(3)-N(4)125.7(2)C(8)-N(3)-C(7)106.9(2)C(14)-O(2)1.355(3)N(1)-C(7)-C(6)123.2(2)N(3)-N(4)-H(4)120.0N(1)-N(2)1.386(3)N(2)-C(8)-C(9)126.0(2)C(1)-O(1)-H(1)109.5N(3)-N(4)1.416(3)C(7)-N(3)-N(4)127.1(2)
2.6 性能研究
2.6.1 热重分析
配合物3和4的热重分析结果分别见图6 a、6 b.由Mn、Ni配合物的TGA-DTA曲线可知,Mn配合物在138~178℃失重,Ni配合物在178~242℃失重,这是样品失去吸附水所致.Mn配合物在187~324℃第1次剧烈分解质量减少57.29%在385~526℃第2次分解质量减少32.83%,均为配体失重;579~659℃第3次分解质量减少 3.23%,残留产物为MnO2,残留质量为5.50%(计算值:5.00%).Ni配合物在290~451℃第1次剧烈分解质量减少53.12%,452~620℃第2次分解质量减少26.19%,265~778℃第3次分解质量减少23.99%,均为配体失重;残留产物为NiO,残留质量为3.70%(计算值:4.00%).从热重分析可知,此类金属配合物热稳定性较好.
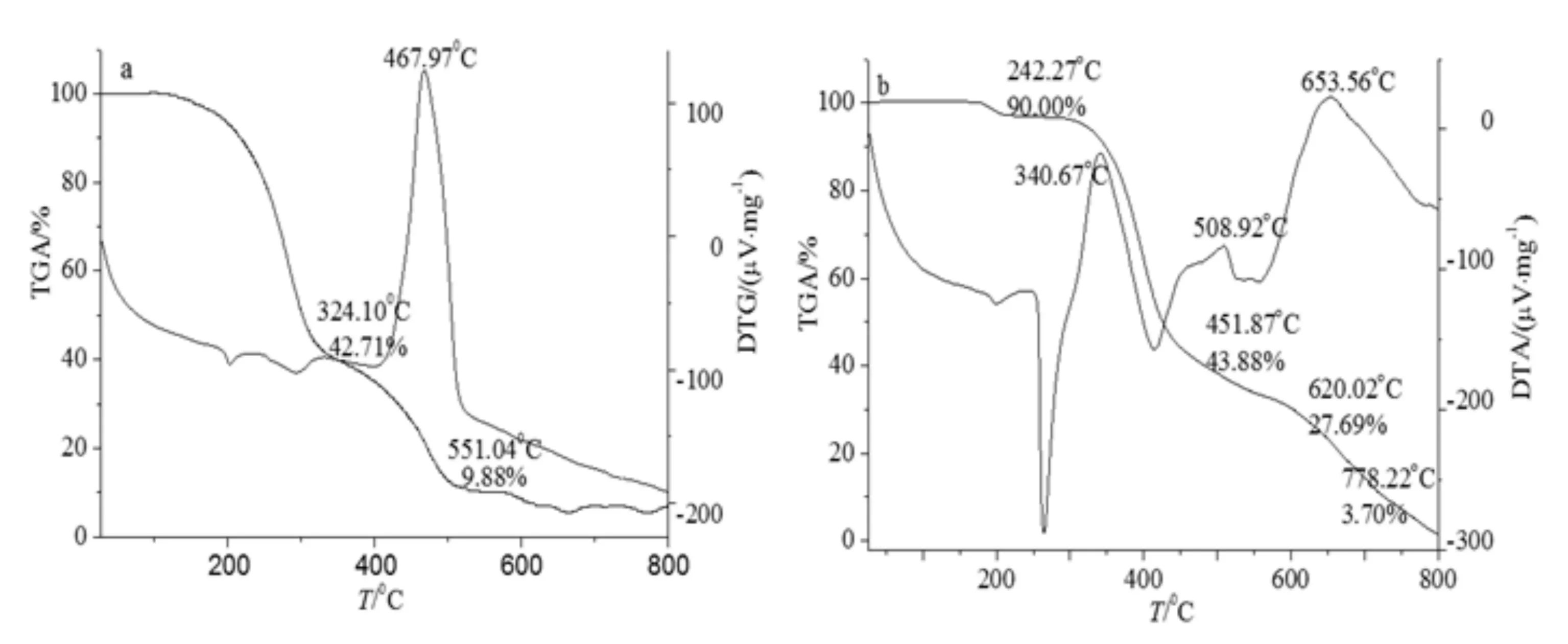
图6 配合物3(a)和4(b)的TGA-DTA曲线Fig.6 TGA-DTA curve of complex 3(a) and 4(b)
2.6.2 紫外光谱
配体L和配合物的紫外光谱见图7.由图7可知,配体L和配合物在218 nm出现苯环特征吸收峰,在252 nm处有吸收,是各化合物中三唑环的特征吸收峰[10];而在292 nm处吸收,归结于苯环上2个羟基氧和三唑环上氨基氮孤对电子与苯环和三唑环上π电子形成p-π共轭,扩大了共轭程度,使体系吸收红移.金属配合物的紫外吸收强度较配体本身弱,说明金属离子与配体中N或O原子配位,使N和O电子云密度减少,体系共轭程度有所破坏.

λ/nm图7 配体L及金属配合物的紫外光谱Fig.7 Uv-vis spectra of ligand L and metal complexs
2.6.3 荧光光谱
配体L和配合物的PL光谱见图8.由图8可知,配体荧光发射峰Em = 449 nm(Ex = 339 nm),荧光强度比较大,说明该化合物的三氮杂环与苯环共轭形成较大π-电子共轭体系,离域电子较易激发,具有较好的发光性能.当NH2C2N3(C6H4OH)2与重金属(Cr、Co、Mn、Ni)配位后,N和O原子与金属离子络合,破坏了三唑杂环与苯环形成的共轭体系,三唑环的电子云向金属离子偏移,电子的π-π*跃迁受阻,导致荧光淬灭,可快速指示环境中重金属离子的存在,并生成沉淀去除.故NH2C2N3(C6H4OH)2金属(Cr、Co、Mn、Ni)配合物是良好的光淬灭剂.

图8 配体L及金属配合物的PL光谱Fig.8 PL spectra of ligand L and metal complexes

配合物λ(abs)/nmλ(Em)/nmλ(Ex)/nmIL218(3.280),252(2.743),292(2.36)4493394241214(2.197),251(1.516),291(1.187)449339512211(2.634),243(2.112),287(1.937)44933933216(2.308),250(1.682),292(1.451)449339344213(2.548),242(1.894),291(1.587)44933916
3 结语
本文以水杨酸、水合肼为初始原料,采用单酰肼法缩合环化生成4-氨基-3,5-二(2-羟基苯基)-1,2,4-三唑,并在温和的反应条件下,成功合成了4种金属配合物,利用IR、1H NMR、13C NMR、MS、单晶结构和元素分析等表征手段确认了其配位方式和结构.此类金属配合物热稳定性较好,Mn和Ni配合物高温下分解为氧化物.三唑化合物本身具有较好发光性能,但与金属离子Co、Cr、Mn、Ni配位形成沉淀后荧光淬灭,在常温下即能快速显示重金属离子的存在,同时生成沉淀很方便除去重金属离子.故4-氨基-3,5-二(2-羟基苯基)-1,2,4-三唑金属配合物是良好的光淬灭剂和重金属离子捕获剂,可降低环境污染.
[1] 吕桂兰, 郝宪彬, 马秀芳. 水土重金属污染的危害及防治对策[J]. 辽宁农业科学, 2013(6): 40-43.
[2] Dong Y B, Wang P, Ma J P, et al. Coordination-driven nanosized lanthanide "molecular lantern" with tunable luminescent properties [J]. J Am Chem Soc, 2007, 129 (16): 4872-4873.
[3] Haasnoot J G. Mononuclear, oligonuclear and polynuclear metal coordination compounds with l,2,4-triazole derivatives as ligands [J].Coord Chem Rev,2000,200/202:131-185.
[4] 许金钩, 王尊本. 荧光分析法[M]. 3版. 北京: 科学出版社, 2006:11-72.
[5] Huang Y G, Wu B L, Yuan D Q, et al. New lanthanide hybrid as clustered infinite nanotunnel with 3D Ln-O-Ln framework and (3, 4)-connected net [J]. Inorg Chem, 2007, 46 (4): 1171-1176.
[6] Xue M, Zhu G S, Li Y X, et al. Structure, hydrogen storage and luminescence properties of three 3D metal-organic frameworks with NbO and PtS topologies[J]. Cryst Growth Des, 2008, 8(7): 2478-2483.
[7] Li X Z, Qu Z R. Synthesis and characterization of a novel 2D zinc (II) coordination polymer[J]. Inorg Chem Commun, 2010, 13(2): 220-222.
[8] 陈连清, 李群丽, 施 超, 等. 4-氨基- 3, 5-二(2-羟基苯基)-1, 2, 4-三唑的合成、表征及其光物理性能研究[J]. 中南民族大学学报: 自然科学版, 2009, 28(3):19-24.
[9] 陈水生, 杨 松, 李慧泉, 等. 含杂环基团的1,2,4-三唑衍生物的合成及其结构表征[J]. 化学试剂, 2009, 31(7): 507-510.
[10] Crawford J C. 2(2-hydroxyphenyl)-2H-benzotriazole ultraviolet stabilizers[J]. Prog Polym Sci, 1999, 24(1): 7-43.
Synthesis, Characterization and Properties of Novel 1, 2, 4-Triazole Heavy Metal Ion Fluorescence Quencher
ChenLianqing,XieLinbo,ZhongRouchao,LanShaohua,LeiXiaoping,LuJianjie
(Key Laboratory of Catalysis and Materials Science of the State Ethnic Affairs Commission &Ministry of Education, South-Central University for Nationalities, Wuhan 430074, China)
To find out a novel fluorescent quencher that may rapidly detect and remove heavy metal ions, a series of heavy metal (Co, Cr, Mn, Ni) complexes with 4-amino-3,5-bis (o-hydroxyphenyl)-1, 2, 4-triazole as ligand were synthesized. Their structures and coordination modes were confirmed by IR,1H NMR,13C NMR, MS and element analysis. The TGA, ultraviolet spectra and fluorescence quenching properties were also discussed. The results showed these complexes had good thermal stability. The Mn and Ni complexes were decomposed into stable oxide at high temperatures. The UV absorption intensity of the complexes was weaker than that of the ligand. The fluorescence of ligand was quenched when the ligand was coordinated with metal ions, which indicated heavy metal ions (Co, Cr, Mn, Ni) are good fluorescence quenchers for 1, 2, 4-triazole ligand and could be removed as precipitate.
1, 2, 4-triazole; metal complexes; synthesis; thermal performance; fluorescence quencher
2014-06-05
陈连清(1979-),男,副教授,博士,研究方向:有机光电材料,E-mail: lqchen@mail.scuec.edu.cn
国家自然科学基金资助项目(20702064, 21177161);人事部留学人员科技活动择优资助项目(BZY13007);湖北省杰出青年基金资助项目(2013CFA034);武汉市青年科技晨光计划(201271031422);湖北省高等学校省级教学研究项目(JYS11001);中南民族大学实验室开放与技改项目(KF2013007)
TQ031.2
A
1672-4321(2015)03-0015-07
