MTS比色法测定小球藻细胞活性的研究
2015-06-27王海英
王海英,许 燕,王 溢,甘 科
(中南民族大学 生命科学学院, 武汉 430074)
MTS比色法测定小球藻细胞活性的研究
王海英,许 燕,王 溢,甘 科
(中南民族大学 生命科学学院, 武汉 430074)
为探讨MTS法用于小球藻细胞活性快速测定的可行性,研究了小球藻光合作用,细胞密度和温育温度对MTS法测定细胞活性的影响,分析了铜离子胁迫中不同生理状态小球藻的MTS细胞活性值与最大光化学量子产量的相关性.结果表明:MTS能通过小球藻细胞壁在胞内参加反应,反应产物能被检测到,叶绿体光合作用的电子传递及其酶系对MTS测定细胞活性值无影响.MTS细胞活性测定值与藻细胞的密度成线性关系,在37 ℃ 时MTS的反应速率加快,同时藻细胞的MTS细胞活性值和最大光化学量子产量的值呈近似的线性关系,故MTS法能够快速便捷地测定小球藻细胞的活性.
小球藻;细胞活性;MTS;最大光化学量子产量
小球藻(Chlorella)是一类普生性单细胞绿藻,其培养过程简单、生长繁殖速度快、生态分布广,可利用光能进行自养生长,还可在异养条件下生长;小球藻含有多糖和糖蛋白,具有抗肿瘤、抗病源菌、抗病毒感染和增强免疫力等活性[1,2],在逆境环境条件下(如氮短缺),小球藻细胞会大量积累油脂[3];藻细胞还能有效地固定空气、工业废气和可溶性碳酸盐中的CO2[4],因此小球藻的应用价值很高.为筛选活力强、生长快、活性代谢产物产量高的小球藻,方便、快捷、准确地检测在特定环境下生长的藻细胞活性的方法显得尤为重要.
一般通过分析光合速率和荧光释放量来测定藻类光合生物细胞活性,但通常需要昂贵的设备仪器,技术操作要求高[5].动物细胞的活性检测主要通过间接观察DNA的合成含量和直接检测细胞代谢活性,前者常用同位素3H-TdR掺入法,设备昂贵且操作复杂,存在放射性污染[6];而后者常用四甲基偶氮唑盐(MTT)比色法,在测定时产生不溶于水的结晶物,需要加有机溶剂溶解后方能比色,若溶解不全则会影响测定结果[7],为解决这一问题,Buttke等设计了一种新型的MTT类似物MTS,它能被活细胞线粒体的琥珀酸脱氢酶降解而产生棕黄色水溶性甲臢,这种带颜色的物质通过酶联免疫检测仪在492 nm处捕捉到其光谱吸收,通过吸光度反映活细胞数量和状态[8], MTS法快速准确,已被广泛应用于动物细胞活性的测定.相比动物细胞,小球藻细胞具有细胞壁和叶绿体,用MTS比色法测定小球藻细胞活性时,细胞壁是否会阻碍MTS进入藻细胞,叶绿体内相关酶和光合作用是否干扰MTS反应等,本文针对这些问题,对MTS法测定小球藻细胞活性的可行性进行了系统研究.
1 材料与方法
1.1 材料和仪器
实验藻种蛋白核小球藻(Chlorellapyrenoidosa)来自中南民族大学生命科学学院发酵工程实验室,经抗生素法制备无菌藻株. MTS (Promega Corporation, WI, USA),3-(3,4-二氯苯基)-1,1-二甲基脲(DCMU, Sigma Chemical Co),酶标仪(Multiskan Ascent, Thermo Electron corporation, Shanghai, China),脉冲调制荧光仪(WATER-PAM, WALZ Germany).
1.2 小球藻的培养
用Bristol培养基进行藻的培养,主要成分为:0.25 g/L NaNO3, 0.075 g/L K2HPO4·3H2O, 0.075 g/L MgSO4, 0.025 g/L CaCl2·2H2O, 0.175 g/L KH2PO4,0.025 g/L NaCl,0.005 g/L FeCl3·6H2O, 1mL Fe-EDTA溶液,40 mL土壤提取液和1 mL/L A5微量元素,A5中包含有以下成分:0.22 g/L ZnSO4·7H2O,2.86 g/L H3BO3,1.81 g/L MnCl2·4H2O,0.079 g/L CuSO4·5H2O,0.039 g/L(NH4)6Mo7O24·4H2O.取对数生长的小球藻以无菌方式接种到新鲜灭菌的Bristol培养基中,用渔用泵通气,空气过滤器过滤空气,荧光灯提供照明,光照强度为4 klx,温度为25~27℃,连续照明培养.
1.3 铜离子处理
藻生长至对数生长期后进行铜离子胁迫,浓度梯度分别为5, 15, 25, 30, 35 μmol/L,设置对照组,置于摇床中光照强度为4 klx,温度为25~27℃,连续照明培养40 h.
1.4 细胞密度和细胞活性的测定
用血球计数板法计量细胞密度;细胞活性的测定方法为:取400 μL藻液加上80 μL MTS溶液于1.5 mL的EP小管中.另以400 μL的培养基加上80 μL MTS溶液在相同的条件下作为对照.充分混合后在一定温度下保温.以15000 r/min离心1 min,取其上清于96孔板中.置于酶标仪中,在492 nm处测定吸光值.
1.5 叶绿体光合作用抑制
以3-(3,4-二氯苯基)-1,1-二甲基脲作为叶绿体光合作用抑制剂,MTS测定活性前在藻细胞中加入3 μM的DCMU保温5 min,抑制叶绿体光合作用,另外以不加DCMU的作为对照组.
1.6 叶绿素荧光的测定
[9],采用脉冲调制荧光仪测定不同浓度铜离子胁迫下的藻细胞的叶绿素荧光.测定前吸取2 mL藻液放入反应小室中,暗适应10 min后测定.光化光为100 μmol·m-2·s-1,闪光时间为1 s,测得藻细胞的最大光化学量子产量(Fv/Fm).
2 结果与分析
2.1 叶绿体对MTS测定细胞活性的影响
图1为加有叶绿体电子传递链抑制剂DCMU与对照组藻细胞活性的比较.DCMU是一种叶绿体电子传递链抑制剂,它抑制了从PSII上的Q向PQ的电子传递,进而抑制叶绿体光合作用.结果显示,经DCMU预处理的藻细胞活性与未经DCMU预处理的对照组细胞无显著性差异(p>0.05),可见叶绿体光合作用的电子传递及其酶系对用MTS测定细胞活性值不构成影响,即在有光和无光条件下MTS比色法测定细胞活性可用于有光合作用的藻细胞.
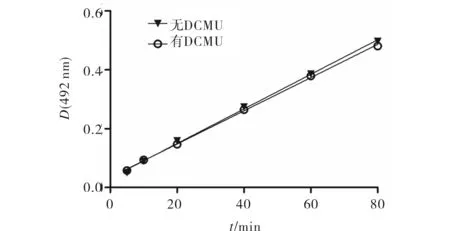
图1 加DCMU与对照藻细胞MTS反应的对比Fig.1 MTS reaction of DCMU-treated Chlorella cells compared with control
2.2 细胞密度对MTS测定细胞活性的影响
活性细胞产生的NADH和NADPH参与 MTS的颜色反应,故492nm处的也吸光值依赖于细胞密度[5].图2为不同细胞密度的蛋白核小球藻在相同MTS体系下测定的藻细胞活性,经MTS试剂与藻细胞保温后,在492 nm处测得的吸光值与藻细胞的密度成线性关系(R2=0.9975,n=7).说明用MTS测定藻细胞活性时,每个样品需要通过稀释或浓缩将藻细胞密度调整到相同或至少相近的值以确保MTS细胞活性值的可比性.
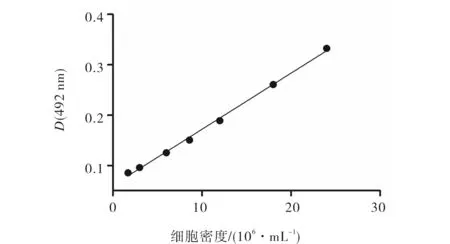
图2 藻细胞密度与MTS藻细胞活性间的关系Fig.2 Relationship between MTS cell viability and cell density of Chlorella
2.3 温度对MTS测定细胞活性的影响
MTS还原反应是一个酶介导的反应[5],颜色反应与保温温度密切相关.图3为反应的温度对MTS测定细胞活性的影响.由图3可见,37℃ 较27℃ 更有利于MTS反应,颜色反应速率明显加快,为缩短测定时间,当细胞密度较低时反应温度可选择在约37℃,若细胞密度高时可适当降低温度测定细胞活性. 保温20 min时颜色反应值已能被酶联仪所捕捉而显示数据,说明MTS能顺利进入有细胞壁的小球藻细胞参加反应并能在一定的反应时间后被检测,细胞壁不是MTS反应的屏障.
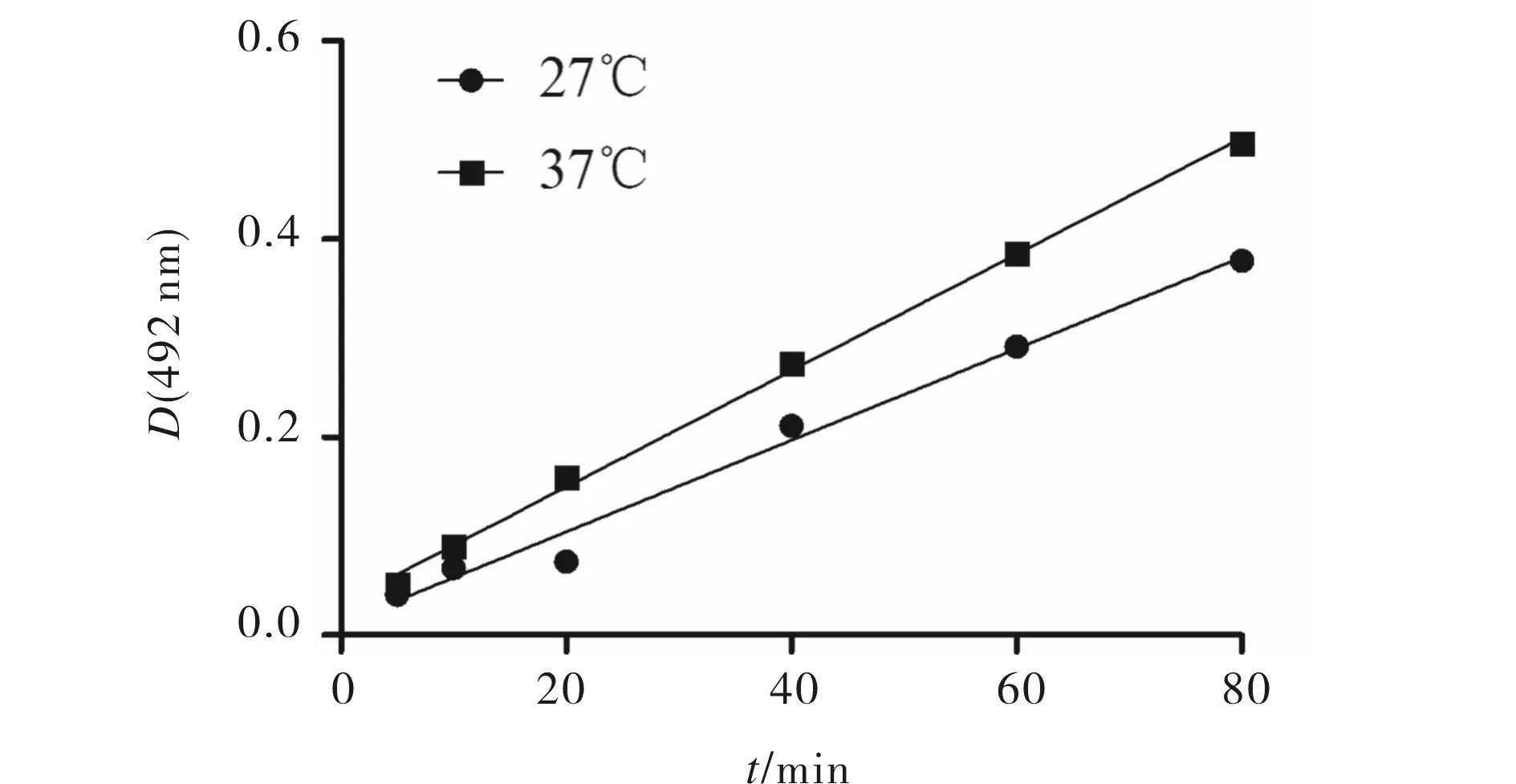
图3 温度对MTS测定藻细胞活性的影响Fig.3 Effect of temperature on MTS cell viability of Chlorella
2.4 藻细胞MTS活性与最大光化学量子产量的关系
最大光化学量子产量(Fv/Fm)反映了PSII反应中心光化反应的最大潜在量子产率,多数光合生物在无胁迫的情况下为常数,但当光合生物受到胁迫或伤害时会明显下降,Fv/Fm具有高灵敏度和特异性,常用于反映藻细胞代谢活性和光合作用效率的大小[9,10].
为了表征MTS法测定的细胞活性对小球藻的光合损伤状态,本文利用脉冲调制荧光仪测定了不同浓度Cu2+胁迫下的藻细胞的最大光化学量子产量(Fv/Fm),见图4中Cu2+浓度为30 μmol/L时藻细胞的492 nm处的吸光值为0.07,Fv/Fm的值降低至0.495,Cu2+浓度为35 μmol/L时,MTS细胞活性值和Fv/Fm变化不大,且藻液发黄出现沉淀,出现藻细胞死亡的现象.电子探测显微分析显示,海洋藻类在0.05 mg/L Cu2+中暴露5d 后,代谢作用受阻[11].本文中高于30 μmol/L的Cu2+浓度连续胁迫处理40 h后,MTS法不能很好地表征藻细胞活性,可能由于蛋白核小球藻的代谢作用受阻,导致藻细胞的细胞膜的通透性发生变化,不能把MTS送至线粒体处发生反应,或由于藻细胞线粒体中的琥珀酸脱氢酶在高浓度Cu2+作用下变性,不能把MTS降解成黄色水溶性甲臢,未能测定到MTS细胞活性.当Cu2+≤30 μmol/L时处理的藻细胞MTS活性值与最大光化学量子产量(Fv/Fm)呈良好线性关系(R2=0.9151,n=5),说明MTS细胞活性值在小球藻存活状态下的测定值可很好地表征细胞的光合活性,作为损伤度不高的小球藻活性测定的替代方法.
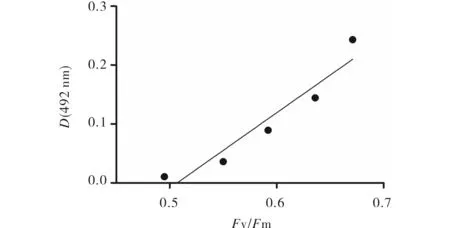
图4 藻细胞的最大光化学量子产量(Fv/Fm)与 MTS测定藻细胞活性间的关系Fig.4 Relationship between MTS reduction and Fv/Fm of Chlorella
3 结语
小球藻细胞壁不会阻碍MTS进入细胞内参与反应,光合作用的电子传递及其酶系对MTS测定细胞活性值没有影响;测定细胞活性时需要将藻细胞稀释到相近的浓度,37℃的温度有利于MTS的反应速率加快,缩短测定时间;在藻细胞存活状态下,藻细胞的MTS细胞活性值和脉冲调制荧光仪测定的藻细胞样品的最大光化学量子产量的值间有较好的线性关系,可以很好地用来表征藻细胞的活性.
参 考 文 献
[1] 刘学铭, 梁世中. 小球藻在食品工业中的应用及小球藻食品的研制[J]. 武汉食品工业学院学报, 1999(1): 47-52.
[2] 陈 颖, 李文彬, 孙勇如. 小球藻生物技术研究应用现状及展望[J]. 生物工程进展, 1998, 18(6):12-16.
[3] Chisti Y. Biodiesel from microalgae[J].Biotechnol Adv, 2007, 25(3):294-306.
[4] Wang B, Li Y Q, Wu N, et al. CO2bio-mitigation using microalgae[J]. Apply Microbiol Biotechnol, 2008, 79(5):707 -718.
[5] Capasso J M, Cossío B R, Berl T, et al. A colorimetric assay for determination of cell viability in algal cultures[J].Biomol Eng, 2003, 20(4/6):133-138.
[6] 郭莉霞,侯青青.细胞活性测定方法研究进展[J]. 重庆工商大学学报: 自然科学版, 2006, 23(6):564-567.
[7] 宋锦平, 钟 萍, 汪 涛, 等. 测定淋巴细胞增殖的MTS和XTT比色法的建立[J]. 细胞与分子免疫学杂志, 2001,17(3):292-295.
[8] Buttke T M, McCubrgy J A, Owen T C. Use of an soluble tetraxolium/formazan assay to measure viability and pro1iferation of lymphokine dependent cell lines[J]. J Immunol Methods, 1993, 157(1/2):233-240.
[9] 光应芝, 张 芳, 张前前, 等. 10种极地微藻叶绿素荧光特征分析[J]. 极地研究, 2011, 3(23): 184-187.
[10] Björkman O, Demming B. Photo yield of O2evolution and chlorophyll fluorescence characteristics at 77K among vascular plants of diverse origins[J]. Planta, 1987, 170(4):489-504.
[11] 刘丽华.微藻的重金属耐受性及固定化保种研究[D]. 济南: 山东师范大学, 2006: 30-34.
Research on the Cell Viability ofChlorellaDetermined by MTS Colorimetric Assay
WangHaiying,XuYan,WangYi,GanKe
(Collage of Life Sciences, South-Central University for Nationalities, Wuhan 430074, China )
To investigate the feasibility of MTS colorimetric assay for cell viability determination ofChlorella, the effect of photosynthesis, cell density and incubation temperature were studied. The relation between the MTS cell viability value and the maximal photochemical efficiency (Fv/Fm) under different growing status with the stress of heavy metal (Cu2+) was analyzed. The results showed that MTS solution could diffuse across the cell wall ofChlorellaand the reaction product could be detected. The photosynthetic electron transport and the enzyme of chloroplasts had no impact on the determination of MTS cell viability. The cell viability value was linearly proportional with cell density and the MTS reaction rate was accelerated at 37℃. There was approximately linear dependency between the maximal photochemical efficiency (Fv/Fm) and the value of MTS. This showed that MTS assay could be used for the rapid and convenient determination of cell viability ofChlorella.
Chlorella; cell viability; MTS; the maximal photochemical efficiency
2014-11-05
王海英(1974-),女,教授,博士,研究方向:微藻生物技术,E-mail: wanghaiying@mail.scuec.edu.cn
质检公益性行业科研专项(201310141)
Q28; Q2-33
A
1672-4321(2015)03-0033-04
