蛇床子素对神经干细胞体外分化的影响*
2015-06-27李少恒胡昱姚璎珈教亚男孔亮杨青平陶震宇杨静娴
李少恒,胡昱,姚璎珈,教亚男,孔亮,杨青平,陶震宇,杨静娴
(辽宁中医药大学研究生院,大连 116600)
蛇床子素对神经干细胞体外分化的影响*
李少恒,胡昱,姚璎珈,教亚男,孔亮,杨青平,陶震宇,杨静娴
(辽宁中医药大学研究生院,大连 116600)
目的 探讨蛇床子素(Ost)对神经干细胞(NSCs)分化的影响及机制。方法 体外分离并培养新生小鼠脑源NSCs,免疫细胞化学法鉴定;取第5代NSCs置于含不同浓度(0,10,50,100 μmol·L-1)Ost的分化培养液中,免疫荧光细胞化学法检测NSCs分化为神经元、星形胶质细胞和少突胶质细胞情况;RT-PCR检测Notch 1基因及其靶基因Mash 1和Neurogenin 2(Ngn2)表达情况。结果 免疫荧光细胞化学法显示神经球显Nestin/Sox2阳性,即所培养的细胞为NSCs;Ost可促进NSCs更多地向神经元(P<0.01)和少突胶质细胞(P<0.05)分化,而非星形胶质细胞。Ost可减少Notch 1(P<0.01)并增加Ngn 2(P<0.01)mRNA表达,其中以Ost 100 μmol·L-1组最明显。结论 Ost可促使NSCs更多地向神经元和少突胶质细胞分化,其机制可能与Ost抑制Notch信号通路有关。
蛇床子素;神经干细胞;分化;Notch信号通路
神经干细胞(neural stem cells,NSCs)是一种具有自我更新能力和多向分化潜能的干细胞,可分化成神经元、星形胶质细胞和少突胶质细胞[1]。随着技术的发展,NSCs移植治疗中枢退行性疾病受到研究者关注,其中最基础的是NSCs在体外的增殖和分化。蛇床子素(osthole,Ost)是从伞形科植物独活和蛇床子等中提取分离出来的香豆素类化合物[2-3]。研究证明,Ost具有抗肿瘤[4]、抗肝炎[5]和抗炎[6]等多种药理活性。明磊国等[7]发现Ost对骨髓基质干细胞成骨性分化有一定影响,但对NSCs的分化是否有影响笔者较少见到报道。笔者在本实验中给予NSCs不同浓度Ost,观察NSCs分化情况,观察Ost对NSCs分化的影响和作用机制。
1 材料与方法
1.1 动物 清洁级昆明种小鼠,购于大连医科大学实验动物中心,实验动物生产许可证号:SCXK(辽):2008-0002。孕鼠饲养环境为每笼1只,室温(23±2) ℃,给予自来水以及鼠粮(辽宁长生生物技术有限公司),光照与黑暗时间比例为7:5,待生产后取新生48 h内小鼠用于实验。
1.2 试药 Ost(7-methoxy-8-isopentenoxycoumarin,C15H16O3)购于中国食品药品检定研究院(批号:110822-200705),溶于二甲亚砜(dimethyl sulfoxide,DMSO,Sigma公司,批号:302A035),终浓度<0.01%,用DMEM/F12(Dulbecco's modified eagle medium:nutrient mixture F-12 ,Gibco公司,批号:8114303)培养液配成各浓度待用。胎牛血清(fetal bovine serum,FBS,Gibco公司),青-链霉素(penicillin-streptomycin,P/S,Thermo公司,批号:J140031),一抗分别为巢蛋白(Nestin,Millipore公司)、Sox2(Invitrogen公司)、神经元核抗原(neuronal nuclei ,NeuN)一抗(Millipore公司)、胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP,北京博奥森生物公司)、NG2(Upstate公司);二抗分别为Cy3标记羊抗小鼠IgG(Jackson公司)、Cy3标记驴抗兔IgG(Jackson公司)、异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记驴抗兔IgG(Jackson公司);4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)染液(Sigma公司),RevertAidTM First Strand cDNA Synthesis Kit试剂盒(Thermo公司),PCR Master Mix Kit试剂盒(Thermo公司)。
1.3 仪器 倒置荧光生物显微镜(NIB-100F,宁波永新光学股份有限公司),超低温冰箱(DIV-86L386,青岛海尔股份有限公司),二氧化碳(CO2)培养箱(BPN,NUAIRE), PCR仪(MG96G,杭州朗基科学仪器有限公司),凝胶成像系统(Gene Genius,UVP,上海天能科技有限公司)。
1.4 NSCs的分离、培养与鉴定 取新生(48 h内)小鼠大脑并分离海马和侧脑室下区,剪碎并用0.05%胰蛋白酶于37 ℃消化15 min,终止消化后经筛网过滤,得到细胞悬液。细胞悬液以5×106个·mL-1接种于经多聚赖氨酸包被过的24孔板中,加入含有20 ng·mL-1表皮生长因大(epidermal growth factor,EGF)、20 ng·mL-1碱性成纤维细胞生长固(basic fibroblast growth factor,bFGF)、2%B27和1%P/S的DMEM/F12培养液,置于37 ℃,5% CO2-95% 空气培养箱中培养。每隔3 d换液一次,7 d后取出细胞球,机械吹打为单细胞进行传代培养,取对数生长期细胞用于以下实验。取第5代神经球打散为单细胞,用抗小鼠Nestin抗体和Sox2抗体进行免疫荧光细胞化学染色,显微镜下进行检测鉴定[8-9]。
1.5 免疫荧光细胞化学法检测NSCs分化能力 将第5代NSCs以5×106个·mL-1的密度置于96孔板含有不同浓度(0,10,50,100 μmol·L-1)Ost的DMEM/F12完全分化培养液(含有10% FBS和1% P/S 的DMEM/F12培养液)中培养,每孔100 μL,并相应分为对照组(control组)、Ost 10 μmol·L-1组、Ost 50 μmol·L-1组、Ost 100 μmol·L-1组[10]。7 d后,用免疫荧光细胞化学染色法鉴定分化细胞中神经元、星形胶质细胞和少突胶质细胞的特异性蛋白表达[11],重复3次。
1.6 RT-PCR检测Notch及其靶基因表达 将对照组、Ost 10 μmol·L-1组、Ost 50 μmol·L-1组、Ost 100 μmol·L-1组NSCs以5×106个·mL-1密度置于6孔板含有DMEM/F12完全分化培养液中,每孔4 mL。Trizol 法提取上述4组RNA,按照RevertAidTM First Strand cDNA Synthesis Kit合成cDNA;按照PCR Master Mix Kit 所示比例构建PCR反应。Notch通路相关基因序列见表1。反应条件:预变性95 ℃ 2 min;变形95 ℃ 30 s,退火(Tm-5)℃ 30 s,延伸72 ℃ 1 min,扩增40个循环;终延伸72 ℃ 5 min。以β-actin 作为内参。结果用琼脂糖凝胶电泳及凝胶成像系统分析,Image J图像分析软件对条带进行吸光度扫描,结果用相对吸光度表示,相对吸光度=吸光度目的基因/吸光度β-actin,重复3次。

表1 Notch通路相关基因序列
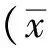
2 结果
2.1 NSCs的培养与鉴定 第5代NSCs在增殖培养基中逐渐变大成球,经免疫荧光细胞化学法染色神经球呈Nestin/Sox2阳性,核蓝色(图1A、B、C)。经过多次传代,原代神经球形成新的神经球,第2~18代神经球无显著差异(图1D、E)。
2.2 Ost对NSCs分化的影响 见图2A。经免疫荧光染色检测,NSCs形成3种不同类型神经细胞:神经元(NeuN阳性)、少突胶质细胞(NG2阳性)和星形胶质细胞(GFAP阳性),均为红色,核为蓝色。定量分析显示,Ost100 μmol·L-1组NeuN阳性细胞率31.9%,模型对照组17.4%(t=4.699,P<0.01);Ost100 μmol·L-1组NG2阳性细胞率17.2%,模型对照组9.3%(t=2.841,P<0.05)(图2B)。提示Ost可促进NSCs向神经元和少突胶质细胞分化。
2.3 Ost调节NSCs内Notch通路相关基因的表达 见图3。RT-PCR结果显示,Ost 100 μmol·L-1组相对吸光度0.382,模型对照组0.822(t=4.625,P<0.01);Ost 100 μmol·L-1组Ngn2相对吸光度0.934,模型对照组0.268(t=8.291,P<0.01)。说明Ost显著减少Notch1 mRNA表达并且增强Ngn 2 mRNA表达,但是其对Mash mRNA的表达无显著改变。
A.光镜下典型神经球;B.Nestin/Sox2 (绿色/红色) 免疫荧光双染神经球;C.DAPI (蓝色) 染色细胞核;D、E.光镜下图像显示从第2到第18代培养的神经球
图1 免疫荧光鉴定(×40)以及传代扩增的神经球(×20)
A.typical neurosphere under the microscope;B.Neurosphere was immunostained with antibodies against nestin (green) and Sox2 (red);C. Nuclei was stained by DAPI (blue);D,E.Neurospheres at 2nd passage and 5th passage under the microscope
Fig.1 Neurospheres (×40) identified by immunofluorescence and amplifiable neurospheres after passaged(×20)

神经干细胞分化为NeuN阳性神经元(A)、GFAP阳性星形胶质细胞(B)和NG2阳性少突胶质细胞(C),DAPI染核;D.不同浓度Ost对NSCs 分化为3种细胞的百分比;与模型对照组比较,*1P<0.05,*2P<0.01
图2 Ost对NSCs分化程度百分比比较
NSCs differentiated into NeuN+ neurons(A), GFAP+ astrocytes, NG2+ oligodendrocyte precursors(C), Nuclei were stained with DAPI;D.Percentages of three cells by different concentrations of Ost; Compared with the model control group,*1P<0.05,*2P<0.01
Fig.2 Differentiation percentage of NSCs by Ost
3 讨论
自从REYONDS等[12]从成年小鼠的纹状体中获得能不断增殖的NSCs后,NSCs就受到关注[13]。由于NSCs具有自我更新及多向分化潜能,使其有可能成为治疗中枢退行性疾病的一种有效手段[14]。然而,对NSCs的增殖和分化进行有效调控是需要面对的首要问题。
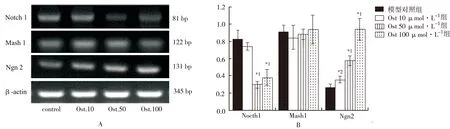
A.RT-PCR检测NSCs中Notch 1,Mash 1和Ngn 2 mRNA的表达(β-actin作为内参);B.Image J 检测并比较Notch 1,Math 1和Ngn 2 mRNA 的表达;与模型对照组比较,*1P<0.01,*2P<0.05
图3 4组细胞中Notch 1及其靶基因mRNA表达的比较
A.mRNA expressions of Notch 1 and its target genes Math 1 and Ngn 2 were assessed by RT-PCR, normalized with β-actin internal control;B.The mRNA expressions were assessed and compared by Image J;Compared with the model control group,*1P<0.01,*2P<0.05
Fig.3 Compared with the mRNA expression of Notch 1 and its target genes among four groups of cells
Notch基因由MORGAN等在果蝇中发现,因其部分丧失功能性突变在果蝇翅的边缘造成缺口而得名。研究表明,动物中相邻细胞可通过Notch受体传递信号,调节增殖、分化及凋亡等过程,影响器官的形成及形态的发生[15]。有证据表明细胞表面的Notch 1可被相邻细胞表面的配体激活,经蛋白水解后的活化形式(NICD)释放入核内,并与其上的CSL DNA结合蛋白结合形成复合物,激活Hes等靶基因产生转录因子。后者通过抑制碱性螺旋-环-螺旋转录因子(basic helix-loop-helix-domain,bHLH)家族与神经产生的相关基因如Mash 1、Neurogenin 2等的转录,体现“旁侧抑制”,进而抑制细胞分化,维持NSCs的原始状态[16-18]。
本实验按照YANG等[11]介绍的方法成功培养NSCs,经鉴定该细胞为实验所需要的NSCs。在此基础上,笔者加入不同浓度Ost来观察其分化情况,发现Ost能使NSCs更多地向神经元和少突胶质细胞分化并与浓度呈正相关。为此笔者还研究了在NSCs分化过程中Ost对Notch 1及其靶基因Mash 1和Ngn 2的作用。结果发现Ost能使Notch 1表达下降,Ngn 2表达上升,提示Ost可能通过抑制Notch信号通路来促使NSCs向神经元和少突胶质细胞分化,其作用机制有待进一步研究。
[1] OSTENFELD T,SVENDSEN C N.Recent advances in stem cell neurobiology[J].Adv Tech Stand Neurosurg,2003,28:83-89.
[2] HOULT J R,PAYA M.Pharmacological and biochemical actions of simple coumarins:natural products with therapeutic potential[J].Gen Pharmacol,1996,27(4):713-722.
[3] 马玉明.蛇床子素的药理进展及剂型开发[J].中国现代药物应用,2008,2(15):112-114.
[4] 周俊,程维兴,许永华,等.蛇床子素对肺腺癌、肺鳞癌生长抑制作用的实验研究[J].癌变·畸变·突变,2002,14(4):231-233.
[5] HUANG R L,CHEN C C,HUANG Y L,et al.Osthole increase glycosylation of hepatitis B surface antigen and suppresses the secretion of hepatitis B virus ofinvitro[J].Hepatology,1996,24(3):508-515.
[6] LIU J H,ZSCHOCKE S,REININGER E, et al.Inhi-bitory effects ofAngelicapubescensf.biserrata on 5-lipoxygenase and cyclooxygenase[J].Planta Med,1998,64(6):525-529.
[7] 明磊国,葛宝丰,陈克明,等.蛇床子素对体外培养骨髓基质干细胞增殖与成骨性分化的影响[J].中国药理学通报,2010,26(8):1098-1163.
[8]YANG J,YAN Y,CIRIC B,et al.Evaluation of bone marrow- and brain-derived neural stem cells in therapy of central nervous system autoimmunity[J].Am J Pathol,2010,177(4):1989-2001.
[9] 胡昱,郝海光,张晓丹,等.CCR5基因转染对骨髓源神经干细胞生物学行为的影响[J].中国细胞生物学学报,2012,34(10):976-982.
[10] 姚璎珈,胡昱,李少恒,等.蛇床子素可促进体外培养神经干细胞的增殖[J].中国组织工程研究,2014,18(32):5184-5189.
[11] YANG J,JIANG Z,FITZGERALD D C,et al.Adult neural stem cells expressing IL-10 confer potent immunomodulation and remyelination in experimental autoimmune encephalitis[J].J Clin Invest,2009,119(12):3678-3691.
[12]REYNOLDS B A,WEISS S.Generation of neurons and astrocytes from isolated cells of the adult mammalian nervous system[J].Science,1992,255(5052):1707-1710.
[13] GOLDMAN S.Stem and progenitor cell-based therapy of the human central nervous system[J].Nat Biotechnol,2005,23(7):862-871.
[14] 钱晓丹,罗春霞,朱东亚.神经干细胞移植研究进展[J].中国细胞生物学学报,2012,34(3):212-217.
[15] ARTAVANIS-TSAKONAS S,RAND M D,LAKE R J.Notch signaling:cell fate control and signal integration in development[J].Science,1999,284(5415):770-776.
[16] ROSS D A,KADESCH T.Consequences of Notch-mediated induction of Jagged1[J].Exp Cell Res,2004,296(2):173-182.
[17] OHTSUKA T,ISHIBASHI M,QADWOHL G,et al.Hesl and Hes5 as notch effectors in mammalian neuronal differentiation[J].EMBO J,1999,18(4):2196-2207.
[18] ZHOU S,FUJIMURO M,HSIEH J J,et al.SKIP,a CBF1-assoeiated protein,interacts with the ankyrin repeat domain of NotchIC to facilitate NotchIC function[J].Mol Cell Biol,2000,20(7):2400-2410.
DOI 10.3870/yydb.2015.07.003
Effects of Osthole on Differentiation of Neural Stem Cellsinvitro
LI Shaoheng,HU Yu,YAO Yingjia,JIAO Yanan,KONG Liang,YANG Qingping,TAO Zhenyu,YANG Jingxian
(GraduateSchool,LiaoningUniversityofTraditionalChineseMedicine,Dalian116600,China)
Objective To investigate the effects of osthole on neural stem cells (NSCs) differentiation and explore the potential mechanism. Methods Brain-derived NSCs from newborn mice were isolated and culturedinvitroand determined by immunofluorescence.The P5 generations of NSCs were placed in culture solution with osthole at concentrations of (0,10,50,100 μmol·L-1).The neuron, astrocyte and oligodendroglia cell differentiation were determined by immunofluorescence.The mRNA expression of Notch 1 and its target genes Mash 1 and Neurogenin 2 were assessed by RT-PCR. Results The neurosphere displayed Nestin and Sox 2-postive by immunofluorescence, suggesting that the cultured cells were NSCs.Osthole promoted NSCs differentiating into more neuron(P<0.01) and oligodendrocyte(P<0.05), but not astrocyte.Meanwhile, osthole significantly reduced the mRNA expression of Notch 1(P<0.01) and increased Ngn 2(P<0.01)at the dose of 100 μmol·L-1. Conclusion Osthole enhances NSCs differentiating into more neuron and oligodendrocyte via probablly inhibiting Notch signal pathway.
Osthole;Neural stem cells;Differentiation;Notch signal pathway
2014-07-05
2014-08-12
*国家自然科学基金资助项目(81173580);国家自然科学基金国际合作交流项目(81210108050);沈阳市科技专项资金项目(F11-264-1-42)
李少恒(1992-),男,黑龙江鹤岗人,在读硕士,专业方向:中药药理学。E-mail:lsh199242@163.com。
杨静娴(1963-),女,辽宁大连人,教授,博士,从事神经药理学研究。电话:0411-87586009,E-mail:jingxianyang@yahoo.com。
R285.5;R965
A
1004-0781(2015)07-0856-05
