嗜酒合并病毒性肝炎患者对丙泊酚的敏感性
2015-06-27周旋张涛
周旋,张涛
(华中科技大学同济医学院附属同济医院麻醉科,武汉 430030)
嗜酒合并病毒性肝炎患者对丙泊酚的敏感性
周旋,张涛
(华中科技大学同济医学院附属同济医院麻醉科,武汉 430030)
目的 观察嗜酒合并病毒性肝炎患者对丙泊酚的敏感性。方法 选择择期手术患者45例,分为3组:嗜酒合并病毒性肝炎组(A组)、非嗜酒病毒性肝炎组(B组)和非嗜酒非病毒性肝炎组(C组),各15例。入室后常规建立静脉通道,进行监护,手持充水50 mL注射器,诱导给予咪达唑仑、枸橼酸芬太尼后,以恒定速度静脉泵注丙泊酚至睫毛反射消失,对言语刺激无反应。记录丙泊酚诱导用量、意识丧失时间、注射器掉落时间和各监测指标。结果 A组丙泊酚平均诱导剂量(1.511±0.035)mg·kg-1,B组(1.430±0.037)mg·kg-1,C组(1.503±0.045)mg·kg-1,B组显著低于A组和C组(P<0.01);A组与C组差异无统计学意义。A组标准化体质量后意识丧失时间(0.454±0.011)s,B组(0.429±0.011)s,C组(0.451±0.013)s,B组显著低于A组与C组(P<0.01);A组与C组差异无统计学意义。A组标准化平均诱导剂量后手持注射器掉落时间(2.177±0.297)s,B组(2.191±0.253)s,C组(2.170±0.236)s,3组差异无统计学意义。结论 嗜酒合并病毒性肝炎患者对丙泊酚的敏感性较单纯病毒性肝炎患者差,但与非嗜酒且非病毒性肝炎患者比较,对丙泊酚的敏感性未见明显变化。
丙泊酚;肝炎,病毒性;嗜酒;敏感性
嗜酒影响机体多个系统和器官,尤其是神经系统、肝脏及血液系统的功能,增加了麻醉的复杂性。部分饮酒者较非饮酒者对麻醉药物更耐受,麻醉时需要更大剂量的药物和更长的麻醉时间,但苏醒时间却较非饮酒者短[1]。饮酒者一旦发展到肝硬化阶段,肝功能受损,需要调整麻醉药用量[2]。我国酒精性肝病患者有其自身特点,这类患者往往合并病毒性肝炎。我国是肝炎大国[3-4],酒精性肝病合并肝炎病毒感染的患者多,酒精和肝炎病毒存在协同损伤肝功能的作用,可加速肝损伤进程,导致早期肝硬化甚至肝癌[5]。因此,对于饮酒合并肝炎病毒感染的群体,多大剂量的麻醉药才能取得满意效果,成为临床亟待解决的问题。丙泊酚注射液是临床常用静脉麻醉药,具有起效快、作用时间短的特点,常被用于麻醉诱导和维持[6]。笔者在本试验中比较嗜酒合并病毒性肝炎患者与非嗜酒者对丙泊酚的敏感性,以期为指导嗜酒合并病毒性肝炎患者的临床麻醉提供参考。
1 资料与方法
1.1 临床资料 选择我院2014年7~12月拟在全身麻醉下行择期手术的男性患者45例,纳入标准:①美国麻醉医师协会(American Society of Anesthesiology,ASA)Ⅰ~Ⅲ级;② 30~60岁;③体质量46~90 kg;④通过CAGE[CAGE问卷由4个问题组成,即1.你曾否想停止饮酒(cut);2.你曾否因别人责怪你的饮酒而觉得困扰(annoyed);3.你曾否因饮酒而觉得有罪恶感(guility);4.你是否于早晨醒来一睁开眼睛就想饮酒(eye-opener)]问卷筛选嗜酒者与非嗜酒者[7];⑤术前检查血、尿常规,肝、肾功能,心电图,胸部X线片。排除标准: ①既往有严重心肺疾病者;②既往有精神病、肌无力病史、不能配合者。根据患者具体情况分成3组:嗜酒合并病毒性肝炎组(A组),非嗜酒病毒性肝炎组(B组)和非嗜酒非病毒性肝炎组(C组),每组15例。3组患者年龄、体质量和ASA分级等均差异无统计学意义(P>0.05)。本试验通过同济医院伦理委员会审查,患者签署知情同意书。
1.2 研究方法 患者入室后常规吸氧,建立静脉通道,连接脑电双频指数 (bispectrail index,BIS)监护仪,多功能心电监护仪,即三导心电图(electrocardiogram,ECG)、无创血压(blood pressure,BP)、心率(heart rate,HR)和脉博血氧饱和度(pulse oximetry,SpO2)。嘱其输液侧拇、食指夹持注水50 mL注射器。开始麻醉诱导:依次静脉注射咪达唑仑(宜昌人福药业有限公司,批准文号:国药准字H20067040)剂量0.03~0.04 mg·kg-1,枸橼酸芬太尼(宜昌人福药业有限公司,批准文号:国药准字H20003688)4 μg·kg-1后,再以速度为200 mg·min-1缓慢静脉注射丙泊酚(阿斯利康制药有限公司,批准文号:国药准字H20130504),直至睫毛反射消失,对言语刺激无反应,充水注射器掉落。罗库溴铵(商品名:爱可松,荷兰欧加农公司,批准文号:国药准字H20080506)0.6 mg·kg-1。经口气管插管,成功后,连接Dräger麻醉机控制通气,潮气量为8~10 mL·kg-1,通气频率10~14次·min-1,氧流量为1~2 L·min-1,吸呼比1:2。麻醉维持:吸入七氟烷(商品名:凯特力,上海恒瑞制药有限公司,批准文号:国药准字H20070172)或异氟烷(商品名:艾思美,Baxter Healthcare of Puerto Rico,批准文号:国药准字H20080537),静脉持续泵入丙泊酚,2~6 mg·kg-1·h-1,瑞芬太尼(宜昌人福药业有限公司,批准文号:国药准字H20030197)0.1~0.2 μg·kg-1·min-1。按需追加罗库溴铵。手术结束前30 min停用七氟烷或异氟烷,结束前10 min停用丙泊酚和瑞芬太尼。术毕待恢复自主呼吸后,静脉注射阿托品和新斯的明拮抗肌松药的残余作用,待患者清醒后,拔除气管导管,送术后恢复室观察。
1.3 观察指标 记录丙泊酚诱导用量、意识丧失时间、注射器掉落时间以及各监测指标在诱导前后的变化,记录术后苏醒情况。
2 结果
2.1 一般情况 3组患者诱导前后血流动力学及BIS值结果见表1。
2.2 丙泊酚平均诱导剂量 A组麻醉时丙泊酚平均诱导剂量(1.511±0.035)mg·kg-1,B组(1.430±0.037) mg·kg-1,C组(1.503±0.045) mg·kg-1。经单因素方差分析,F值为19.122。与A组、C组比较,B组诱导剂量明显较低,提示B组患者对丙泊酚更敏感(P<0.01);A组与C组比较,差异无统计学意义(P>0.05)。
2.3 意识丧失时间 A组麻醉诱导时患者标准化体质量后的意识丧失时间为(0.454±0.011)s,B组为(0.429±0.011)s,C组为(0.451±0.013)s 。经单因素方差分析,F值为20.022。与A组、C组比较,B组患者丧失意识较快,差异有统计学意义(P<0.01);A组与C组比较,差异无统计学意义。
2.4 手持注射器掉落时间 A组麻醉诱导时患者标准化平均诱导剂量后的手持注射器掉落时间为(2.177±0.297)s,B组为(2.191±0.253)s,C组为(2.170±0.236)s。经单因素方差分析,F值为0.025。3组比较差异无统计学意义。
2.5 苏醒期躁动 A组术后发生苏醒期躁动2例,B组0例,C组1例,3组发生率两两比较,经Fisher精确卡方检验,差异无统计学意义。
3 讨论
酒精在人体内主要有乙醇脱氢酶系(alcohol dehydrogenase,ADH)、微粒体乙醇氧化酶系统(microsomal ethanol oxidizing system,MEOS)和过氧化氢酶(catalase,CAT)系统3种代谢路径。当肝组织乙醇浓度较低时,大部分乙醇由ADH系统氧化代谢。而在长期酗酒者中,当血浆乙醇浓度过高时,则激活MEOS系统,并对乙醇的代谢起主要作用[8]。嗜酒者由于长期饮酒,MEOS径路的酶活性异常增强,从而加速了酒精的代谢速度。而该径路为许多药物的代谢路径,也使相应的药物降解增快[9], 因而无明显肝损伤的嗜酒者手术时,丙泊酚用量相应增加[1]。
长期饮酒增加了酒精性肝病(alcoholic liver disease,ALD)的发病率。值得注意的是,酒精性肝损害可增加机体对乙型肝炎病毒(hepatitis B virus,HBV)、丙型肝炎病毒(hepatitis C virus,HCV)的易感性。反之,慢性病毒性肝炎也会使患者对酒精的敏感性增高,易患酒精中毒和使慢性肝炎加重[10]。但不管何种途径造成肝功能受损,当肝功能下降到一定程度时,对经肝代谢的药物的降解率将会产生影响,这时则需要适量减少药物剂量,在达到理想麻醉效果时,尽量减轻肝脏负担,避免不必要的损害[11]。此外,酒精既是N-甲基-D-天冬氨酸(N-methyl-D-aspartic acid,NMDA)受体的拮抗剂,又是γ-氨基丁酸(γ-aminobutyric acid,GABA)受体的兴奋剂,可以在快速发育期非常明显地引起广泛的神经元凋亡[12-13]。神经功能、神经影像和神经病理学对长期嗜酒者的研究表明:慢性酒精中毒会导致广泛性大脑、小脑灰质和白质萎缩[14-15],并引起记忆力减退[16],在此基础上患者神经系统兴奋性降低,麻醉药物适当减量即可实现满意的麻醉效果。
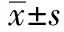
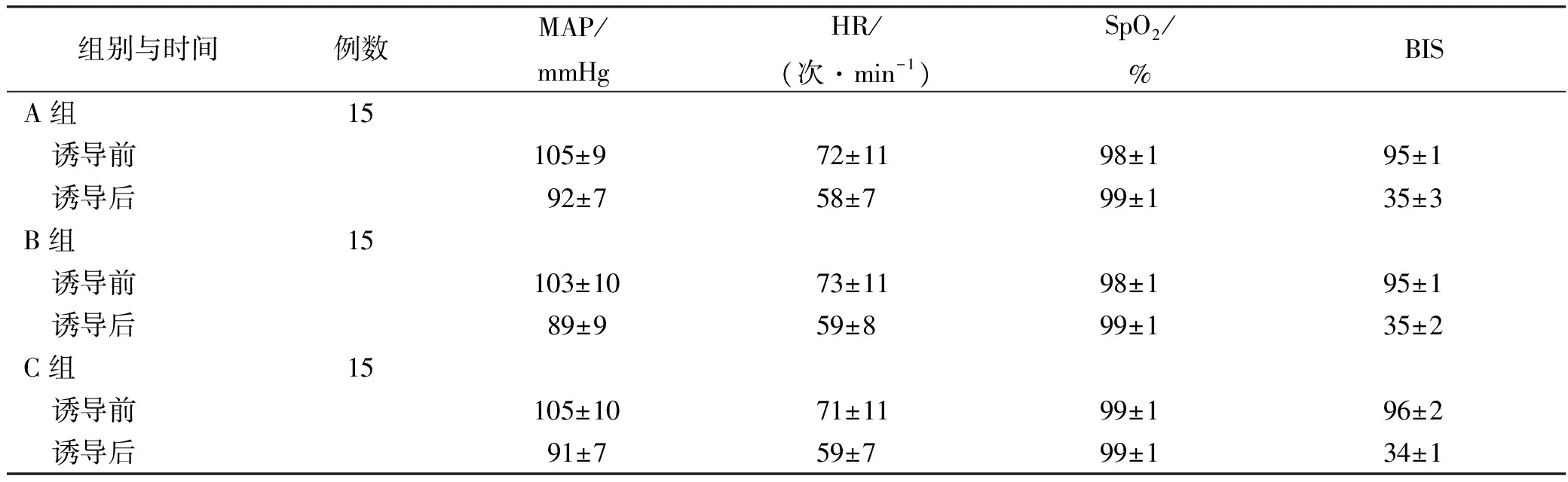
组别与时间例数MAP/mmHgHR/(次·min-1)SpO2/%BISA组15 诱导前 105±9 72±11 98±1 95±1 诱导后 92±7 58±7 99±1 35±3B组15 诱导前 103±10 73±11 98±1 95±1 诱导后 89±9 59±8 99±1 35±2C组15 诱导前 105±10 71±11 99±1 96±2 诱导后 91±7 59±7 99±1 34±1
丙泊酚作为一种短效静脉全麻药,通过激活GABA受体-氯离子复合物发挥镇静催眠作用。虽然肾、肺和肠道等也参与了丙泊酚的代谢[17],但肝脏仍然是丙泊酚体内代谢的主要器官和场所。丙泊酚静脉输注后约38%转化为羟基代谢物而失去活性,53%在肝脏以与葡萄糖苷酸结合的形式最终经肾脏排泄[18]。
本研究中,A组与C组比较,丙泊酚诱导剂量与标准化体质量后的意识丧失时间差异无统计学意义,可能因为饮酒虽然引起MEOS径路酶活性增强,但饮酒合并病毒性肝炎导致肝功能损害,当二者处于平衡时,则既不会表现出对麻醉药的耐受,也不会表现出敏感。A组在本实验中较B组耐受,可能因为MEOS系统酶活性增强。B组较C组敏感,可能因为病毒性肝炎损害肝功能。3组标准化平均诱导剂量后手持充水注射器掉落时间差异无统计学意义,可能与麻醉深度、个体肌力及持注射器手势等因素有关。3组术后苏醒期躁动发生率差异无统计学意义,但A组患者术后躁动患者较多,值得引起注意。
本研究结果表明,嗜酒合并病毒性肝炎患者较单纯病毒性肝炎患者对丙泊酚的敏感性差,需要较大诱导剂量。但与非嗜酒非病毒性肝炎患者比较,对丙泊酚敏感性无明显差异。饮酒合并病毒性肝炎未改变患者对丙泊酚的敏感性。然而随着病情发展,这一平衡是否会被打破,有待进一步研究。
[1] 肖骏.嗜酒对丙泊酚用药量和麻醉效果影响的临床观察[J].中国医药导刊, 2012,14(12):2142-2143.
[2] 刘世良.肝硬化患者复合瑞芬太尼时异丙酚的药代动力学研究[J].中国医药指南, 2012,10(1):64-65.
[3] 贺淑萍,梁琴,赵臻.1992-2013年我国病毒性肝炎死亡数和死亡率变化过程及发展趋势分析[J].临床肝胆病杂志,2014,30(9):899-902.
[4] 梁晓峰.我国病毒性肝炎流行特征及对策[J].临床肝胆病杂志,2010,26(6):561-564.
[5] 龚晓莹,王炳元.嗜酒与慢性病毒性肝炎[J].肝脏,2010,15(1):62-64.
[6] 曹勤,姚瑶,葛卫红.丙泊酚群体药动学研究与临床个体化给药[J].医药导报, 2012,31(12):1604-1606.
[7] BATAILLE V,RUIDAVETS J B,ARVEILER D,et al.Joint use of clinical parameters, biological markers and CAGE questionnaire for the identification of heavy drinkers in a large population-based sample[J].Alcohol Alcohol,2003,38(2):121-127.
[8] 孙庆文.酒精饮料在人体内的代谢及适宜饮量[J].酿酒科技,2006,(8):126-127.
[9] KONISHI M,ISHII H.Role of microsomal enzymes in dev-elopment of alcoholic liver diseases[J].J Gastroenterol Hepatol,2007,22(Suppl 1):S7-S10.
[10] 陈传杰,王艳巧,游旭东.嗜酒对慢性乙型肝炎肝硬化预后的影响分析[J].肝脏, 2012,17(7):530-531.
[11] 侯芝绮,张兴安.肝功能障碍患者异丙酚药代动力参数的Meta分析[J].循证医学,2011,23(5):282-288.
[12] IKONOMIDOU C,BITTIGAU P,ISHIMARU M J,et al.Eth-anol-induced apoptotic neurodegeneration and fetal alcohol syndrome[J].Science,2000,287(5455):1056-1060.
[13] POHL D,BITTIGAU P,ISHIMARU M J,et al.N-Methyl-D-aspartate antagonists and apoptotic cell death triggered by head trauma in developing rat brain[J].Proc Natl Acad Sci U S A,1999,96(5):2508-2513.
[14] ALEXANDER-KAUFMAN K,HARPER C,WILCE P,et al.Cerebellar vermis proteome of chronic alcoholic individuals[J].Alcohol Clin Exp Res,2007,31(8):1286-1296.
[15] ALEXANDER-KAUFMAN K,JAMES G,SHEEDY D,et al.Differential protein expression in the prefrontal white matter of human alcoholics: a proteomics study[J].Mol Psychiatry,2006,11(1):56-65.
[16] SCHOTTENBAUER M A,HOMMER D,WEINGARTNER H.Memory deficits among alcoholics: performance on a selective reminding task[J].Neuropsychol Dev Cogn B Aging Neuropsychol Cogn,2007,14(5):505-516.
[17] HIRAOKA H, YAMAMOTO K, MIYOSHI S, et al.Kid-neys contribute to the extrahepatic clearance of propofol in humans, but not lungs and brain[J].Br J Clin Pharmacol,2005,60(2):176-182.
[18] AL-JAHDARI W S, YAMAMOTO K, HIRAOKA H, et al.Prediction of total propofol clearance based on enzyme activities in microsomes from human kidney and liver[J].Eur J Clin Pharmacol,2006,62(7):527-533.
DOI 10.3870/yydb.2015.07.012
2014-12-21
2015-01-22
周旋(1985-),女,湖北襄阳人,住院医师,硕士,研究方向:麻醉药物的肝脏保护。E-mail:zhouxuan_530@163.com。
张涛(1961-),女,湖北武汉人,主治医师,学士,研究方向为肝脏保护。E-mail:zhangtao_tjmzk@163.com。
R971.2;R575.1
B
1004-0781(2015)07-0892-04
