甘肃野生草地早熟禾原生质体分离与培养研究
2015-06-24牛奎举李玉珠马晖玲
牛奎举,俞 玲,李玉珠,马晖玲
(甘肃农业大学草业学院 草业生态系统教育部重点实验室 中-美草地畜牧业可持续发展研究中心,甘肃兰州 730070)
甘肃野生草地早熟禾原生质体分离与培养研究
牛奎举,俞 玲,李玉珠,马晖玲
(甘肃农业大学草业学院 草业生态系统教育部重点实验室 中-美草地畜牧业可持续发展研究中心,甘肃兰州 730070)
建立高效的原生质体再生体系是通过原生质体融合技术培育草地早熟禾(Poapratensis)新品种的重要前提。以甘肃陇西野生草地早熟禾(LX)和定西野生草地早熟禾(DX)胚性愈伤组织为材料,探索其原生质体游离和培养条件。结果表明,LX和DX原生质体分离的最佳酶液组合为1.5%纤维素酶R-10+0.5%果胶酶Y-23+1.0%离析酶R-10+0.3%崩溃酶;酶解时间为16 h;LX原生质体最适宜的甘露醇浓度为0.6 mol·L-1,而DX原生质体的最适甘露醇浓度为0.5 mol·L-1。LX原生质体的产量最高可达6.59×106个·g-1,DX可达5.95×106个·g-1。DX原生质体培养的最适密度为3.0×105个·mL-1,最适2,4-D浓度为1.0 mg·L-1,此时,DX原生质体再生细胞的分裂频率可达9.56%,植板率为4.62%。
野生草地早熟禾;原生质体;分离;培养
草地早熟禾(Poapratensis)作为一种优良的冷地型草坪草种,在温带地区使用非常广泛。但由于其抗旱性差、易感病,且我国的草种几乎全部靠进口,引进品种难以很好的适应我国当地环境,使得草地早熟禾的应用受到严重限制。我国分布有大量草地早熟禾的野生种和近缘种,且具有许多优良性状[1-2],是良好的育种材料。利用育种技术来培育具有优良性状的草地早熟禾新品种是解决以上问题的途径之一。由于草地早熟禾是兼性无融合生殖植物,有些品种的无融合生殖率高达98%[3],故利用常规杂交在品种选育和性状改良方面存在一定的困难和局限性。植物原生质体融合技术可以针对性地将早熟禾野生种中的优良性状向栽培种中转移,特别是对于转移那些多基因控制的性状而言,原生质体融合技术将是一条捷径。
植物原生质体融合技术是以原生质体的分离和培养为基础的。目前,国内外已建立起一些草地早熟禾栽培品种的原生质体再生体系。1988年,Van der Valk等[4]建立了‘Kimono’与‘Merion’这两个草地早熟禾品种的悬浮细胞原生质体再生体系; 随后,Nielsen等[5]对草地早熟禾‘Geronimo’进行原生质体培养,得到了127株再生植株;马晖玲等[6]和赵小强等[7]分别建立了草地早熟禾‘MidnightⅡ’和‘Nuglade’愈伤组织的原生质体培养体系,并获得了再生植株。然而,不同品种的原生质体分离和培养条件差别较大[5-6]。Van der Valk等[4]和Nielsen[5]等选用悬浮细胞系作为原生质体的分离材料,而由悬浮细胞分离得到的原生质体,存在其再生植株发生染色体数目和倍性变化的概率较大的问题。另外,在前期的研究中曾尝试将马晖玲等[6]和赵小强等[7]建立的草地早熟禾商用品种原生质体的分离和培养体系应用于本研究,但所得原生质体的产量很少,不能满足后续试验的要求。因此,本研究以具有较强抗旱性的陇西和定西野生草地早熟禾[8]的胚性愈伤组织为材料,对其原生质体分离和培养条件进行一定的探索,以期为进一步开展草地早熟禾商用品种与野生种的原生质体融合奠定基础。
1 材料和方法
1.1 供试材料及胚性愈伤组织的获得
以陇西野生草地早熟禾(LX)和定西野生草地早熟禾(DX)的种子为材料,诱导胚性愈伤组织。愈伤组织的诱导和培养条件及方法同俞玲和马晖玲[9]的报道,愈伤组织每25 d左右继代一次,每次继代时挑选胚性愈伤组织(淡黄色、颗粒状、质地坚硬),连续继代7~8次后,愈伤组织生长能力明显提高,此时,显微镜下可观察到细胞多为小椭圆形细胞,其大小均一、细胞质浓、分裂旺盛,并且细胞排列紧密,这种愈伤组织即为胚性愈伤组织。
1.2 原生质体分离和纯化
取继代培养8~10次,且在新鲜培养基上生长10 d左右的胚性愈伤组织约1.0 g,放入10 mL酶液中。酶溶剂同马晖玲等[6]和赵小强等[7]的报道,为CPW溶液,pH为5.8,经0.22 μm微孔滤膜过滤灭菌。酶解混合物静置30 min后,置于25 ℃、黑暗条件、50 r·min-1的恒温摇床上震荡酶解16 h。经过一定时间的酶解,将酶液混合物经无菌尼龙网筛(76、40 μm)过滤,滤液经常温低速离心机离心8 min(500 r·min-1),收集原生质体,去掉上清液,用清洗液(CPW溶液+0.6 mol·L-1甘露醇)重新悬浮,再离心,这样反复两次,最后用原生质体培养液洗涤一次。
本试验共设定7个酶处理组合(表1),其他酶解条件参照赵小强等[7]的报道。酶解时间为16 h,甘露醇的浓度为0.7 mol·L-1甘露醇。
在上述研究的基础上,在Ⅳ号酶组合处理下分别对甘露醇浓度(酶解16 h)和酶解时间(0.7 mol·L-1甘露醇)进行研究。甘露醇浓度为0.4、0.5、0.6、0.7 mol·L-1共4个梯度,酶解时间为8、10、12、14、16、18、20 h共7个处理。所有处理均重复3次。
1.3 原生质体产量和活力的测定
原生质体产量和活力的测定及计算方法同李玉珠等[10]的报道。
1.4 原生质体培养
将分离和纯化后的2 mL DX原生质体悬浮液以不同的密度(1×105、2×105、3×105和5×105个·mL-1)培养于60 mm培养皿中进行静置浅层培养。液体培养基为添加了1.0%蔗糖、100 mg·L-1水解酪蛋白、200 mg·L-1水解乳蛋白、0.4 mol·L-1甘露醇、1.0 mg·L-12,4-D和0.1 mg·L-16-BA的KM8P培养基,pH为5.8,培养温度为(25±1) ℃,暗培养,每隔一周,添加0.4 mL左右甘露醇浓度依次减半的新鲜培养基,并于显微镜下观察细胞的生长情况,统计原生质体再生细胞的分裂频率(15 d后)和植板率(30 d后)。另外,以3×105个·mL-1的密度将原生质体培养于含有不同2,4-D浓度(0.5、1.0、2.0和3.0 mg·L-1)的培养基中,培养条件同上,统计细胞分裂频率和植板率。

表1 不同的酶处理组合
1.5 统计分析
用SPSS 13.0对试验数据进行单因素方差分析。
2 结果与分析
2.1 野生草地早熟禾愈伤组织原生质体的分离
2.1.1 甘露醇浓度对原生质体分离的影响 0.5和0.6 mol·L-1的甘露醇有利于DX和LX原生质体的游离,但对两种草地早熟禾原生质体产量与活力的影响不同(图1)。DX原生质体游离的最适甘露醇浓度为0.5 mol·L-1,此时其产量和活力均达到最高,分别为3.60×106个·g-1和65.12%,但与0.6 mol·L-1的甘露醇处理下相比差异不显著(P>0.05);对LX而言,当甘露醇浓度为0.6 mol·L-1时,其原生质体的产量和活力均达到最高,分别为3.84×106个·g-1和68.43%。因此,0.6和0.5 mol·L-1可分别作为LX和DX原生质体分离所需的最适甘露醇浓度。
2.1.2 不同的酶处理组合对原生质体分离的影响 在不同酶液处理下,原生质体的分离结果相差很大(图2)。酶组合Ⅱ下,LX和DX原生质体的产量和活力均高于Ⅰ和Ⅲ,表明1.5%的纤维素酶更有利于原生质体的游离;组合Ⅳ和Ⅵ的LX和DX原生质体的产量和LX的原生质体活力均分别显著高于Ⅱ和Ⅲ(P<0.05),表明1.0%的离析酶会提高原生质体的产量与活力;同样,处理Ⅴ和Ⅶ下DX和LX原生质体的产量显著高于Ⅳ和Ⅵ(P<0.05),表明0.3%的崩溃酶可提高原生质体的产量;在组合Ⅴ下,LX原生质体的产量和活力最高,分别为5.35×106个·g-1和82.70%,在组合Ⅶ下,DX原生质体的产量高于组合Ⅴ,但是活力却明显低于组合Ⅴ。综上所述,组合Ⅴ即1.5%纤维素酶+0.5%果胶酶+1.0%离析酶+0.3%崩溃酶最有利于LX和DX原生质体的游离。
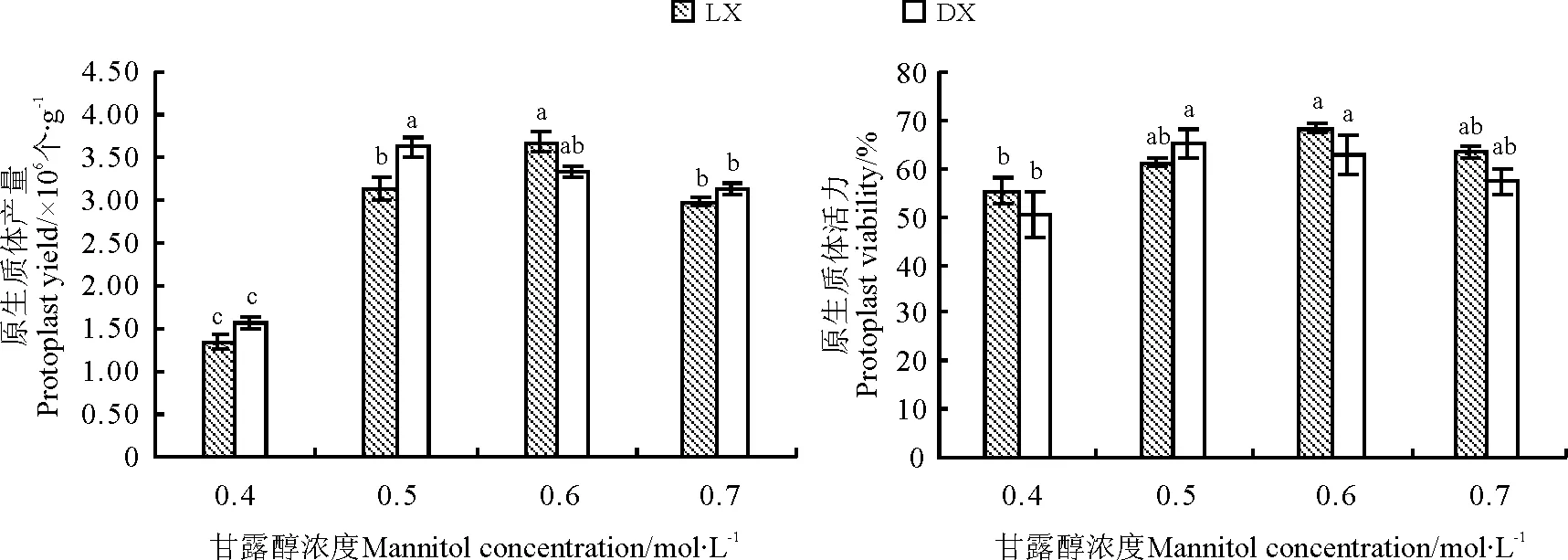
图1 甘露醇浓度对LX和DX原生质体产量及活力的影响Fig.1 Effect of mannitol concentration on protoplast yield and viability of LX and DX
注:不同字母表示同一种不同处理间差异显著(P<0.05);LX表示陇西野生草地早熟禾,DX表示定西野生草地早熟。下同。
Note: Different lower case letters for the same variety indicate significant difference among different treatments at 0.05 level. LX represents Longxi wild kentucky bluegrass. DX represents Dingxi wild kentucky bluegrass. The same below.

图2 不同的酶处理组合对LX和DX原生质体产量和活力的影响Fig.2 Effect of enzyme compositions on protoplast yield and viability of LX and DX
2.1.3 酶解时间对原生质体分离的影响 在8~18 h内,LX和DX原生质体的产量随着酶解时间的延长而逐渐增高(图3),其活力先缓慢增加(8~16 h),后降低(18 h)。8 h不利于甘肃野生草地早熟禾原生质体的分离,此时LX和DX原生质体产量均为最低,并且原生质体的细胞壁有残留,原生质体多粘成一团,不利于观察统计;当酶解时间为16 h时,LX原生质体的产量显著地提高(P<0.05),当时间延长到18 h时,其产量虽有所增加,但活力则开始明显地降低,并且有大量的碎片产生;当酶解时间在14~18 h内,DX原生质体的产量虽逐渐增高,但差异并不显著(P>0.05),其活力同样在18 h时有明显的下降。上述结果表明,16 h是LX和DX原生质体的最佳酶解时间,此时LX和DX原生质体产量分别为6.92×106和6.03×106个·g-1,活力分别为89.6%和85.3%。
2.2 DX原生质体培养
2.2.1 培养密度对原生质体培养的影响 不同原生质体培养密度对其再生细胞分裂频率和植板率的影响各异(表2),较高的培养密度有利于提高再生细胞分裂频率和植板率,当培养密度较低时(1.0×105、2.0×105个·mL-1)时,再生细胞的分裂频率和植板率均较低,尤其是植板率(仅为0.17%和0.55%);当培养密度为3×105个·mL-1时,细胞分裂频率和植板率显著地高于其他处理(P<0.05),其植板率约为1×105个·mL-1的24倍;但当培养密度继续增加到5×105个·mL-1,再生细胞分裂频率和植板率都开始降低。故DX原生质体的最佳培养密度为3×105个·mL-1。
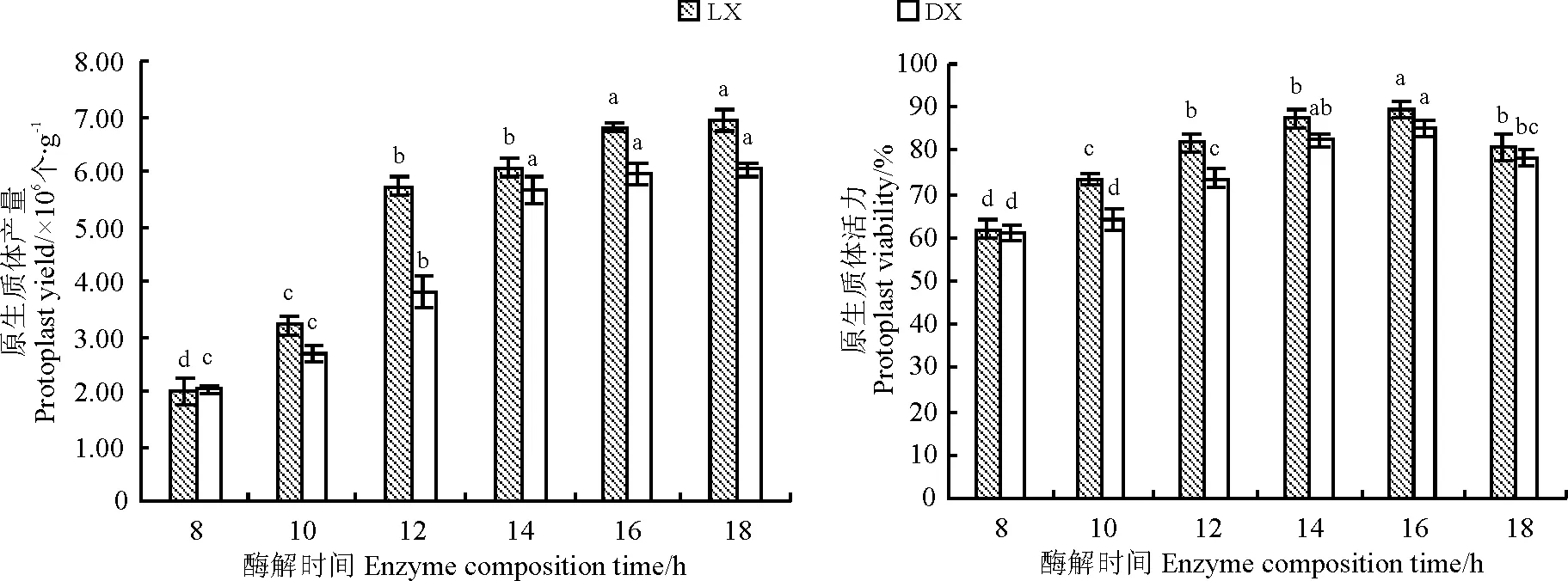
图3 酶解时间对LX和DX原生质体产量和活力的影响Fig.3 Effect of enzyme digestion time on protoplast yield and viability of LX and DX 表2 培养密度对DX原生质体再生细胞 分裂频率及植板率的影响 Table 2 Effects of protoplast density on the cell division frequencies and planting efficiencies of DX protoplasts

原生质体密度Protoplastdensity/×105number·mL-1细胞分裂频率Celldivisionfrequencies/%植板率Platingefficiencies/%1.02.08±0.44c0.17±0.04c2.03.91±0.35bc0.55±0.09c3.08.87±0.69a4.02±0.87a5.05.10±0.48b1.79±0.31b
注:同列不同字母表示不同处理间差异显著(P<0.05)。下同。
Note: Different lower case letters within the same column indicate significant difference among different treatments at 0.05 level. The same below.
2.2.2 2,4-D对原生质体培养的影响 2,4-D对DX原生质体再生细胞的分裂频率及植板率也有一定的影响(表3),当2,4-D的浓度从0.5 mg·L-1增至1.0 mg·L-1时,细胞分裂频率由3.89%提高到9.56%,而当2,4-D过高(≥2.0 mg·L-1)时,反而会抑制细胞生长,导致分裂频率和植板率均显著地降低(P<0.05)。由此可见,过高或过低的2,4-D浓度均不利于原生质体再生细胞的分裂,DX原生质体培养最适的2,4-D浓度为1.0 mg·L-1。

表3 2,4-D对DX原生质体再生细胞分裂频率及植板率的影响
2.2.3 原生质体培养形成小愈伤组织 DX胚性愈伤组织(图4-A)经酶解后可产生大量活力较高的原生质体(图4-B、图4-C),将这些原生质体以3×105个·mL-1的密度培养于添加1.0 mg·L-12,4-D的培养基上培养3~4 d后,可观察到原生质体再生细胞的第1次分裂(图4-D),随后继续观察可以看到第2、3次分裂和形成小细胞团(图4-E、图4-F、图4-G),4周后,可产生肉眼可见的小愈伤组织(图4-H)。
3 讨论
3.1 供试材料的选择
对于禾本科植物而言,用于原生质体分离的材料通常是悬浮细胞系和胚性愈伤组织。由于愈伤组织取材方便,且使用不受时间和季节的限制[11],陈东方和夏镇澳[12]用棒头草(Polypogonfugax)胚性愈伤组织作为材料,游离出了大量活力较高的原生质体,其研究结果表明,以胚性愈伤组织作为材料更具有优越性。这主要是由于获得胚性愈伤组织比建立细胞悬浮系所需的时间要短得多,有利于植株再生能力的保持,且培养后容易诱导植株再生。马晖玲等[6]也利用草地早熟禾‘午夜Ⅱ号’的胚性愈伤组织作为原生质体游离材料,获得了大量原生质体,并再生出完整植株。本试验以胚性愈伤组织为分离LX和DX原生质体的材料,得到了大量的、活力较高的原生质体。
3.2 酶液组合、酶解时间和甘露醇对LX和DX原生质体分离的影响
影响原生质体分离的主要因素有:酶的种类及浓度、酶解时间和甘露醇的浓度。植物材料不同,其酶解条件不同,即使是同一种植物,外植体的选择不同,酶解条件也会不同[5-7,10-12]。本研究探索了7个酶液组合对LX和DX原生质体分离的影响,试验结果表明,最适宜的酶液组合为1.5%纤维素酶+0.5%果胶酶+1.0%离析酶+0.3%崩溃酶,1.0%的离析酶和0.3%的崩溃酶的添加,可显著地提高原生质体的产量,这与赵小强等[7]的研究结果相似,但李玉珠等[10]研究表明,0.3%离析酶可降低百脉根(Lotuscorniculatus)子叶和愈伤组织原生质体产量。另外,本试验表明当纤维素酶的浓度由1.5%增高到2.0%时,原生质体的产量和活力表现出下降的趋势,这说明酶的浓度要适宜,过高或过低均不利于原生质体的分离,张小红等[13]研究同样表明,低浓度酶液组合下小麦(Triticumaestivum)愈伤组织原生质体的产量和活力要高于高浓度酶液组合的。

图4 DX原生质体分离与培养过程Fig.4 Progress of DX protoplast isolation and culture
注:A,胚性愈伤组织;B,分离的原生质体;C,有活力的原生质体;D,原生质体第1次分裂;E,原生质体第2次分裂;F,原生质体第3次分裂;G,小细胞团;H,小愈伤组织。
Note: A,embryogenic calli; B,freshly isolated protoplasts from calli; C,viable protoplasts; D,first division of protoplast-derived cell; E,second division of protoplast-derived cell; F,third division of protoplast-derived cell; G,cell cluster formed from protoplast-derived cell; H,Microcalli formed from protoplast-derived cell.
酶解时间的长短会非常明显地影响原生质体的产量与活力,过短会导致原生质体的产量大幅度地降低,而过长会导致原生质体的活力下降,且会导致分离出的原生质体破碎,进而使得产量也随之降低[14]。本研究中,当酶解时间由8 h延长到18 h时,原生质体产量逐渐增加;当酶解时间为18 h时,原生质体的产量均达到最高,但是与16 h时相比,原生质体的活力均显著下降。
适宜的渗透压是获得高活力原生质体的必要条件,植物材料不同适宜的渗透压不同,一般植物的渗透压都在0.4~0.7 mol·L-1[15-16],本研究结果表明,DX和LX愈伤组织原生质体分离最适宜的甘露醇浓度不同,分别为0.5和0.6 mol·L-1。
3.3 培养密度和2,4-D对DX原生质体培养的影响
原生质体的起始培养密度对原生质体培养影响很大,过高或过低的培养密度均不易获得较高的分裂频率和植板率[11]。Inokuma等[17]研究表明,日本结缕草(Zoysiajaponica)原生质体的最适培养密度为10×105个·mL-1;陈文品等[18]研究表明,只有当多年生黑麦草(Loliumperenne)原生质体密度达到一定值(≥1.0×105个·mL-1)时,才能产生细胞团,最适的培养密度为8.0×105个·mL-1。本研究结果显示,当DX原生质体的培养密度较高时(3.0×105个·mL-1),其分裂频率最高,可达8.87%。大量的研究表明,物种不同,原生质体的最适培养密度也不相同[17-19]。
2,4-D 是原生质体再生细胞分裂、愈伤组织和诱导体细胞胚形成不可缺少的一种生长激素之一。本研究结果表明,较低浓度的2,4-D(1.0 mg·L-1)最有利于DX原生质体再生细胞分裂。许多研究者[12,17-21]在原生质体起始培养时,都采用较低浓度(0.5~2.0 mg·L-1)的2,4-D。
4 结论
LX原生质体分离的最佳条件为:1.5%纤维素酶R-10+0.5%果胶酶Y-23+1.0%离析酶R-10+0.3%崩溃酶,16 h,0.6 mol·L-1甘露醇;DX原生质体分离的最佳条件为:1.5%纤维素酶R-10+0.5%果胶酶Y-23+1.0%离析酶R-10+0.3%崩溃酶,16 h,0.5 mol·L-1甘露醇;DX原生质体培养的最适密度为3.0×105个·mL-1,最适2,4-D浓度为1.0 mg·L-1。
致谢:该论文是第二届全国草业生物技术大会评选出的优秀论文,并得到中国草业生物技术专业委员会提供的版面费支持。
[1] 方强恩,孙英,白小明,王靖婷,孙吉雄.甘肃早熟禾属野生植物资源分布研究[J].中国草地学报,2010,32(6):39-45.
[2] 黄丽,王璐,李存福,陈浩,郭明章,黄体冉,李连芳.北京地区早熟禾属植物种质资源研究[J].草地学报,2011,19(5):760-765.
[3] 田晨霞,马晖玲,张咏梅.草地早熟禾胚发育类型及无融合生殖特征[J].中国农业科学,2013,46(13):2633-2642.
[4] Van der Valk P,Zaal M,Creemers-Molenaar J.Regeneration of albino plantlets from suspension culture derived protoplasts of Kentucky bluegrass (PoapratensisL.)[J].Euphytica,1988,39(3):169-176.
[5] Nielsen K A,Larsen E,Knudsen E.Regeneration of protoplast-derived green plants of Kentucky bluegrass (PoapratensisL.)[J].Plant Cell Report,1993,12(10):537-540.
[6] 马晖玲,赵小强,白小明.草地早熟禾午夜Ⅱ号原生质体培养及植株再生[J].草地学报,2010,18(1):103-107.
[7] 赵小强,马晖玲,林栋,周万海,吴翔.草地早熟禾品种新格莱德原生质体培养及植株再生的研究[J].草业学报,2010,19(2):55-60.
[8] 白利国,俞玲,马晖玲.野生草地早熟禾对干旱胁迫的生理响应[J].草原与草坪,2014(2):86-91.
[9] 俞玲,马晖玲.甘肃陇西野生草地早熟禾植株的再生体系[J].草业科学,2014,31(6):1063-1069.
[10] 李玉珠,陶茸,王娟,师尚礼,马晖玲,赵小强.百脉根原生质体的分离和酶解条件的研究[J].草地学报,2010,18(6):798-804.
[11] 文峰,肖诗鑫,聂扬眉,马秋香,张鹏,郭文武.木薯脆性胚性愈伤组织原生质体培养与植株再生[J].中国农业科学,2012,45(19):4050-4056.
[12] 陈东方,夏镇澳.从棒头草(PolypogonfugaxNees ex Steud)原生质体培养获得再生成熟植株[J].中国科学(B辑 化学 生物学 农学 医学 地学),1987(1):54-60.
[13] 张小红,闵东红,邵景侠.小麦愈伤组织诱导及原生质体的分离与纯化[J].中国农学通报,2010,26(21):49-53.
[14] 陶茸,师尚礼,李玉珠,李剑锋.‘陇东’紫花苜蓿原生质体最佳分离条件[J].植物生理学报,2011,47(5):495-500.
[15] Xu Z Q,Jia J F.Callus formation from protoplasts ofArtemisiasphaerocephalaKrasch and some factors influencing protoplast division[J].Plant Cell,Lissue and Organ Culture,1996,44(2):129-134.
[16] Thomas T D.Isolation,callus formation and plantlet regeneration from mesophyll protoplasts ofTylophoraindica(Burm.f.) Merrill:An important medicinal plant[J].In Vitro Cellular & Developmental Biology-Plant,2009,45(5):591-598.
[17] Inokuma C,Sugiura K,Cho C,Okawara R,Kaneko S.Plant regeneration from protoplasts of Japanese lawngrass[J].Plant Cell Reports,1996,15(10):737-741.
[18] 陈文品,吴琴生,刘大钧.黑麦草原生质体培养条件的初步研究[J].南京农业大学学报,1992,15(2):59-60.
[19] 程肖蕊,李彦舫,李喜文,张亚兰.野大麦原生质体培养形成愈伤组织[J].中国农业科学,1998,31(5):85-87.
[20] Wang Z Y,Valles M P,Montavon P,Potrykus I,Spangenberg G.Fertile plant regeneration from protoplasts of meadow fescue (FestucapratensisHuds.)[J].Plant Cell Reports,1993,12(2):95-100.
[21] 董晋江,夏镇澳.谷子原生质体培养再生植株[J].科学通报,1990(7):538-540.
(责任编辑 王芳)
2015年第6期《草业科学》审稿专家
安 渊 包爱科 柴 琦 常文环 陈先江 邓 馨 干友民 郭良栋 韩云华
侯扶江 胡小文 李惠霞 李建龙 李彦忠 梁天刚 林恭华 林慧龙 刘金荣
刘文献 刘文献 刘兴元 马伟强 毛祝新 毛祝新 穆春生 彭 燕 蒲小鹏
任安芝 孙 会 孙玉诚 田 沛 万怡震 王桔红 王晓娟 王兆龙 翁秀秀
伍国强 席杰军 徐云远 杨培志 杨允菲 于应文 袁明龙 张 博 张卫国
赵 军 赵萌莉
承蒙以上专家对《草业科学》期刊稿件的审阅,特此表示衷心的感谢!
Protoplast isolation and culture of wild Kentucky Bluegrass in Gansu
NIU Kui-ju, YU Ling, LI Yu-zhu, MA Hui-ling
(Pratacultural College, Gansu Agricultural University, Key laboratory of Grassland Ecosystem, Ministry of Education, Sino-U.S. Centers for Grazingland Ecosystem Sustainability, Lanzhou 730070, China)
In the present study, the conditions of protoplast isolation and culture were explored using embryogenic callus from wild Kentucky Bluegrass variety Longxi (LX) and Dingxi (DX). The results showed that the optimal conditions for protoplast isolation was enzyme composition including 1.5% Cellulase R-10+0.5% Pectolase Y-23+1.0% Macerozyme R-10+0.3% Driselase with 16 h digestion. The optimal mannitol concentration was 0.6 mol·L-1for LX protoplast and 0.5 mol·L-1for DX protoplast. The highest yield of protoplasts was 6.59×106number·g-1for LX and 5.95×106number·g-1for DX. After purification, DX protoplasts were cultured in KM8P liquid medium. With 3.0×105number·mL-1plating density and 1.0 mg·L-12,4-D, DX protoplasts had highest cell division frequency of 9.56% and plating efficiency of 4.62%.
wild Kentucky bluegrass; protoplast; isolation; culture
MA Hui-ling E-mail:mahl@gsau.edu.cn
10.11829j.issn.1001-0629.2014-0575
2014-12-18 接受日期:2015-03-25
国家自然科学基金——草地早熟禾种间体细胞杂交的研究(31160482)
牛奎举(1991-),男,甘肃通渭人,在读硕士生,研究方向为草种质资源及育种。E-mail:niukuiju@163.com
马晖玲(1966-),女(回族),甘肃兰州人,教授,博士,研究方向为牧草及草坪草育种。E-mail:mahl@gsau.edu.cn
S543+.904.3;Q943.1
A
1001-0629(2015)06-0927-08
牛奎举,俞玲,李玉珠,马晖玲.甘肃野生草地早熟禾原生质体分离与培养研究[J].草业科学,2015,32(6):927-934.
NIU Kui-ju,YU Ling,LI Yu-zhu,MA Hui-ling.Protoplast isolation and culture of wild Kentucky Bluegrass in Gansu[J].Pratacultural Science,2015,32(6):927-934.
