溶酶体和泛素-蛋白酶体途径在前列腺癌中的研究进展
2015-06-24巩艳青郭应禄
巩艳青,彭 鼎,郭应禄
(北京大学第一医院泌尿外科,北京大学泌尿外科研究所,国家泌尿男生殖系肿瘤研究中心,北京 100034)
·综 述·
溶酶体和泛素-蛋白酶体途径在前列腺癌中的研究进展
巩艳青,彭 鼎,郭应禄
(北京大学第一医院泌尿外科,北京大学泌尿外科研究所,国家泌尿男生殖系肿瘤研究中心,北京 100034)
前列腺癌是男性泌尿生殖系常见的恶性肿瘤之一,在我国的发病率虽然远低于西方,但随着人口老龄化、生活水平和诊断技术的不断提高,前列腺癌的发病率呈上升趋势。泛素-蛋白酶体途径(UPS)是细胞生理过程的一种重要调节机制,在细胞内普遍存在;它与疾病的发生发展密切相关,如肿瘤、病毒感染、神经变性疾病、代谢性疾病及炎症等。本文对UPS在前列腺癌发生进展中的作用及应用进行了相关综述。
前列腺癌;UPS;治疗靶点
溶酶体和泛素-蛋白酶体途径(ubiquitin proteasome system, UPS)是真核细胞内两种不同的蛋白酶解系统。溶酶体途径的主要功能是降解细胞内膜相关蛋白以及一些由于应激状态而产生的蛋白质,以及从胞外摄取的通过内吞过程入胞的蛋白质。UPS则是高选择性地降解泛素标记的蛋白质;这些蛋白质的产生可能是在应激也可能是在非应激条件下;UPS在细胞中发挥着重要的功能和作用。细胞内的蛋白质,如细胞膜、细胞质、细胞核以及内质网腔等,均可以通过泛素化酶从而受到蛋白酶体的监测。UPS甚至可以通过蛋白降解过程,调节mRNA的稳定性。
UPS通过对特殊蛋白质的降解在真核细胞的分化、增殖、凋亡、基因转录、信号转导、新陈代谢调节、免疫监视等生命活动中起至关重要的作用。UPS与疾病的发生发展也密切相关,如肿瘤、病毒感染、神经变性疾病、代谢性疾病及炎症等。由于泛素化系统在细胞活动中的重要作用,认识细胞内蛋白泛素化降解作用机制,对认识由泛素系统失调引起的各种疾病尤其是恶性肿瘤具有重要意义。
1 UPS的组成及功能
泛素-蛋白酶体发挥作用是一个蛋白质的级联反应,其降解蛋白质需要以下几个步骤:①靶蛋白被识别;②泛素分子通过共价结合到蛋白质底物上,并形成多泛素链;③靶蛋白被26 S蛋白酶体复合物降解,泛素分子可以被释放并可参与下一次识别过程。通过这一过程,在真核细胞中可以实现两方面的作用:一方面降解细胞内的蛋白;另一方面是非降解作用,调节细胞内不同蛋白的定位和活性。
泛素是真核细胞中普遍存在且序列高度保守的小分子球形蛋白质,其分子质量约8.5 ku,由76个氨基酸残基组成,能够共价结合细胞中的受体蛋白,在不同生物细胞中广泛存在且保守性较高。蛋白质泛素化过程就是指通过泛素共价结合到靶蛋白上,标记靶蛋白,使靶蛋白最终被蛋白酶体降解的过程。细胞的多种生理过程都需要蛋白的泛素化作用参与,如:蛋白质的转运、各种细胞器的产生、内质网蛋白质的调控、细胞周期过程、细胞增殖和分化、细胞凋亡、炎症反应、抗原提呈、DNA修复以及细胞应激反应等[1]。
蛋白的泛素化需要3种酶,每种酶都有其特异性的作用。包括:泛素激活酶(ubiquitin-activating enzyme, E1)、泛素结合酶(ubiquitin-conjugating enzyme, E2)、泛素连接酶(ubiquitin ligase, E3)。泛素化是将蛋白质通过这一途径降解的第一步,也是一个蛋白的级联反应,三种酶依次作用,最终将泛素加到目标蛋白质上。在这个过程中,首先,在E1的作用下,通过消耗ATP,泛素被激活,之后结合到E2s的半胱氨酸活化位点,使E2s与泛素形成E2s-泛素的中间体;之后E3s可以将泛素与底物靶蛋白相结合。而泛素分子连接在蛋白质上是依靠位于泛素C-末端的甘氨酸残基与靶蛋白的赖氨酸残基的ε氨基基团之间形成的异肽键。在这个过程中,E3s起着关键的作用,人体细胞中存在着约1 000种不同的E3s,它们能够特异性地识别底物蛋白并且将泛素从E2s上转移到底物蛋白上。泛素分子连接到靶蛋白上后,之后的其他泛素分子在E3s的作用下相继连接到其第48 位赖氨酸残基,最终多个泛素分子形成多聚泛素化链。这一多聚泛素化链被26S蛋白酶体识别,可以促进靶蛋白的降解。于是,泛素-底物蛋白质复合体形成后,底物蛋白质进入26S蛋白酶体的催化中心,被20S蛋白酶体降解成多个短肽(图1)。通常泛素化的信号被折叠在正常的蛋白质结构中,所以在正常状态下不被降解;但是一旦蛋白质的正常结构出现变化或者受损,如折叠异常和突变蛋白,这些信号就会暴露出来,被泛素系统识别,激活接下来的泛素-蛋白酶体降解过程。与泛素化过程相对的,细胞内还有泛素解离酶(DUBs),其作用就是促进蛋白的去泛素化。这两个过程同时存在,构成了一个相对的负向调节[2-3]。
正因为泛素化及去泛素化在细胞内的蛋白质水平的重要作用,针对这一过程研究通过调节这一过程而影响蛋白质的功能成为蛋白质研究的热点之一。例如,抑癌基因P53就可受到 MDM2的E3连接酶的作用,而被泛素化;同时,特异性的蛋白酶能使其去泛素化,减少P53的降解,增强其稳定性,从而抑制肿瘤细胞的生长[4]。前列腺癌中SKP2的过表达可以促进P27的UPS降解,从而使前列腺癌细胞不受P27的生长控制[5]。
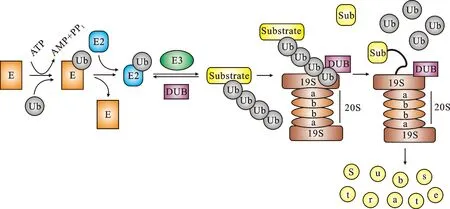
图1 UPS[6]
2 UPS在前列腺癌去势抵抗性进展中的作用
肿瘤细胞在雄激素缺乏的环境中仍保持雄激素受体AR的转录促使前列腺癌去势抵抗性的产生,此时的雄激素受体如同在正常生理状态下一样,仍进行功能性转录。在剥夺雄激素的情况下,雄激素受体信号通路仍被激活提高的机制有:AR基因的扩增、AR突变、AR辅助因子平衡的变化、类固醇前体的增加、旁路信号通路的激活或异常等,表观遗传修饰的改变、microRNA和肿瘤干细胞的调控同样参与了去势抵抗前列腺癌的进展过程[7-9]。UPS作为其中的一部分,与多种蛋白相互作用,促进AR的核转录,清除共抑制子以促使起始复合物的形成。或许UPS的功能失活,使得去势抵抗前列腺癌细胞系中AR的蛋白稳定性增加,进而对低浓度雄激素产生应答[10]。
前列腺癌去势抵抗产生的机制之一是通过信号转导途径的激活,转导生长信号,或在无需配体存在的情况下激活AR,或者不通过AR而激活肿瘤细胞的生长。神经肽,如内皮素、蛙皮素及其它们的膜受体,是这些信号转导途径的启动元素之一,与神经-内分泌特质相关,同时与前列腺癌去势抵抗性的产生有关[11-12]。细胞膜相关的切割并使细胞外神经肽失活的中性肽链内切酶(neprilysin,NEP)的缺失,使得内皮素1、蛙皮素、胃泌素释放肽、神经肽这些多肽的自分泌和旁分泌增加,结合各自的受体后启动信号级联,从而促进细胞的生长和肿瘤细胞的迁移[13]。神经肽启动的促生长信号包括了PI3K和Akt激酶的激活,进而磷酸化I-κB后激活促生长转录因子NF-κB;磷酸化的I-κB通过UPS被降解,以使NF-κB进核,发挥转录活性[13-14]。NEP和肿瘤抑制子PTEN的直接相互作用在去势抵抗前列腺癌中也有所研究;它们之间的相互作用将PTEN带到细胞质膜附近,抑制靶蛋白Akt激酶[15]。AKT激酶也是蛋白酶体的作用底物,可以磷酸化AR,使得AR在没有雄激素结合的情况下转录激活。抑癌基因PTEN调节许多生理过程包括生存、增殖、能量代谢、细胞形态及细胞命运;通过其脂磷酸酶活性抑制磷脂酰肌醇三激酶(PI3K)-AKT-mTOR(mammalian target of rapamycin )通路[16]。在前列腺癌中PTEN经常缺失,它可以通过UPS途径受到E3连接酶介导的蛋白酶体降解的调控,已报道的Nedd 4-1, XIAP和WWP2 都可以介导其降解;进而使AKT活性增加,凋亡蛋白BAD、procaspase-9等水平下降,P27水平下调,最终抑制前列腺癌细胞凋亡,促进增殖[17]。CHIP, 是分子伴侣相关的E3连接酶,也可以导致PTEN降解;过表达CHIP可以导致PTEN泛素化增加并使其半衰期缩短[18]。NEP还可以增加去势抵抗前列腺癌细胞PC3中PKC的同工型PKCδ,它可以促进细胞凋亡,并增加细胞对化疗药物的敏感性;PKCδ是各种刺激诱导磷酸化后的泛素化靶点,进而被蛋白酶体降解[29];研究已发现PC3细胞中的PKCδ蛋白的稳定性降低,可能是因为PC3细胞中蛋白酶体的活性,与LNCaP细胞相比有所增加[20]。因此,神经肽启动的信号通路促进了去势抵抗性前列腺癌细胞的生长,不管其是AR依赖还是非依赖的。其他起始于受体的转导通路,如EGFR和IGF-1R,其最终也是激活PI3K/Akt,以一种病理生理过程类似于神经肽的方式促进去势抵抗前列腺癌的生长;这些级联信号通路中的多种成分蛋白是蛋白酶体降解的底物。UPS还调控了Wnt信号转导,激活转录因子β-catenin的Wnt-1信号通路,在胚胎发育过程中具有非常重要的作用,同时在许多肿瘤病变中表达下调[21]。
产生去势抵抗的另外一种机制是胁迫反应的激活。在雄激素受到抑制的环境下,这种反应将上调伴侣分子,如hsp27和分泌型 clusterin,以保护肿瘤细胞避免凋亡[22-23]。这种抗凋亡产生的机制包括I-κB被蛋白酶体降解的促进,从而激活促生长转录因子NF-κB;还有变性蛋白的再折叠和逃脱蛋白酶体的破坏[24-25]。总之,在AR的转录仍旧对肿瘤细胞的存活很重要的情况下和其他转录途径激活并发挥功能的情况下,UPS在前列腺癌向去势抵抗性转变过程中具有非常重要的作用。
3 UPS在前列腺癌治疗中的应用及前景
目前针对局限性前列腺癌的治疗(如雄激素剥夺、根治性切除术、放疗、近距离放疗等)对晚期前列腺癌效果有限,而转移性激素抵抗的前列腺癌目前仍难治愈。UPS在细胞的动态平衡和前列腺癌的进展相关过程中发挥了重要的作用,UPS的抑制在前列腺中具有抗肿瘤效用,并成为前列腺癌治疗的靶标[26]。实验证实,恶性增殖细胞对蛋白酶体阻断的敏感性比非肿瘤细胞更为强烈,如乳胞素(lactacystin)对正常的淋巴细胞无明显的作用[27]。研究结果显示,蛋白酶体抑制剂通过影响NF-κB、MAPK信号转导通路、细胞周期相关蛋白及Bcl-2蛋白,上调促凋亡相关蛋白、转录因子、细胞因子,下调抗凋亡分子和粘附分子来抑制肿瘤细胞对抗化疗药物而启动的抗凋亡作用。
第一个临床应用的蛋白酶体抑制剂是硼替佐米(Bortezomib),也是体外研究最为广泛的蛋白酶体抑制剂。硼替佐米能直接抑制蛋白酶体糜蛋白酶样酶的活性,稳定各种重要的细胞凋亡蛋白,并促进细胞凋亡通路[28]。硼替佐米可以降低前列腺癌细胞中的E3泛素连接酶 WWP1、Smurf1、Smurf2的表达[29]。硼替佐米处理前列腺癌细胞系和原发性前列腺上皮细胞后,caspase 8 P18的半衰期由底线22 min延长至2 h,活性caspase 8的稳定增加了细胞对死亡受体介导的凋亡诱导的敏感性[30]。硼替佐米处理前列腺癌肿瘤细胞LNCaP时,通过稳定死亡受体DR5的mRNA,而使其表达上调[31]。裸鼠前列腺癌细胞PC3-M异种移植模型中发现,与未接受处理的肿瘤相比,接受硼替佐米处理的肿瘤细胞生长速率降低,凋亡增加[32]。目前,体外和临床前体内的研究结果均证实了蛋白酶体抑制对前列腺癌细胞的生长抑制作用;以Bortezomib为代表的蛋白酶体抑制剂,在临床肿瘤治疗中显示出良好的疗效,但也可诱导热休克蛋白(heat shock protein, HSP)的表达。活化的HSP能在细胞受强烈刺激时提供保护,因此会导致肿瘤细胞发生耐药性。因此,为了减弱肿瘤细胞对蛋白酶体抑制剂的耐药性,可以适当联合使用HSP抑制剂[33]。此外,蛋白酶体抑制剂结合目前的激素疗法(如雌激素)或许是研究方向之一。蛋白酶体在雌激素诱导的AR下调过程中发挥作用,可能促进AR非依赖性的产生,而它的逆转也或许能使前列腺癌重新成为雄激素依赖的状态。UPS在前列腺癌治疗中的另一种应用方式,是促进肿瘤相关蛋白通过UPS途径介导的降解[34]。TANG[35]等利用双氢睾酮-蛋白靶向降解嵌合分子(DHT-PROTAC)通过UPS降解前列腺癌LNCaP细胞表达的雄激素受体,并抑制了肿瘤细胞的生长和增殖。
在去势抵抗性前列腺癌中,泛素连接酶Siah2高表达,并在NCRO1-雄激素受体复合物标上降解的标记,从而除去对雄激素的制约,允许没有活性的雄激素受体进入活性状态;由此前列腺癌产生更多的有活性的雄激素受体,并使它们对激素疗法产生抵抗性[36]。基于这种新的信息,将Siah2作为一种生物标志物,以便用于追踪前列腺癌患者对治疗的反应;抑制Siah2与雄激素受体复合物之间的相互作用也将可能提供一种新的方法来再次使去势抵抗性前列腺癌恢复对激素疗法的敏感性。
此外,越来越多的自然产物也被发现通过调节UPS,对前列腺癌具有治疗作用。在前列腺癌细胞中,姜黄素(Curcumin)可以降低MDM2(P53的主要的泛素E3连接酶)蛋白,增加抑癌基因P21的表达,促进原癌基因cyclin E的降解,促进凋亡,抑制增殖[37-38]。白桦脂酸(Betulinic Acid)能抑制多种去泛素化酶(DUBs)从而导致多聚泛素化,促进癌蛋白的降解,细胞凋亡增加,而对正常细胞无影响;同时还抑制原发肿瘤及血管形成[39]。一些金属衍生物也被发现可抑制前列腺癌中UPS活性。二氢吲哚二酮(2, 3-indolinedione)的几个金属衍生物可以抑制UPS活性,尤其是26S蛋白酶体的糜蛋白酶样酶活性,导致Bax的累积,抑制肿瘤细胞生长[40]。
综上所述,UPS在前列腺癌的发生发展中具有重要的作用,而且有可能作为一种新的治疗靶点。在研究应用蛋白酶体抑制剂的同时,泛素活化酶、结合酶、连接酶和去泛素化酶也将成为将来潜在的治疗靶点,为前列腺癌及其他肿瘤的治疗提供新的策略!
[1] RAASI S, WOLF D H. Ubiquitin receptors and ERAD: a network of pathways to the proteasome [J]. Semin Cell & Dev Biolo, 2007, 18(6): 780-791.
[2] KANG S H, PARK J J, CHUNG S S, et al. Strategies for assaying deubiquitinating enzymes [J]. Methods enzymol, 2005, 398:500-508).
[3] AMERIK A Y, HOCHSTRASSER M. Mechanism and function of deubiquitinating enzymes [J]. Biochem biophys acta, 2004, 1695(1-3): 189-207.
[4] LI M, CHEN D, SHILOH A, et al. Deubiquitination of p53 by HAUSP is an important pathway for p53 stabilization [J]. Nature, 2002, 416(6881): 648-653.
[5] LU L, SCHULZ H, WOLF D A. The F-box protein SKP2 mediates androgen control of p27 stability in LNCaP human prostate cancer cells [J]. BMC Cell Biol, 2002, 3:22.
[6] ELDRIDGE A G, O'BRIEN T. Therapeutic strategies within the ubiquitin proteasome system [J]. Cell Death Differ, 2010, 17(1): 4-13.
[7] SARAON P,JARVI K. Molecular alterations during progression of prostate cancer to androgen independence [J]. Clin Chem, 2011, 57(10): 1366-1375.
[8] LIN P C, CHIU Y L, BANERJEE S, et al. Epigenetic repression of miR-31 disrupts androgen receptor homeostasis and contributes to prostate cancer progression [J]. Cancer Res, 2013, 73(3): 1232-1244.
[9] STEINKAMP M P, O′MAHONY O A, BROGLEY M, et al. Treatment-dependent androgen receptor mutations in prostate cancer exploit multiple mechanisms to evade therapy [J]. Cancer Res, 2009, 69(10): 4434-4442.
[10] GREGORY C W, JOHNSON R T, JR., MOHLER J L, et al. Androgen receptor stabilization in recurrent prostate cancer is associated with hypersensitivity to low androgen [J]. Cancer res, 2001, 61(7): 2892-2898.
[11] NANUS D M. Of peptides and peptidases: the role of cell surface peptidases in cancer [J]. Clin Cancer Res,2003, 9(17): 6307-6309.
[12] SUMITOMO M, SHEN R, NANUS D M. Involvement of neutral endopeptidase in neoplastic progression [J]. Biochimi biophy acta, 2005, 1751(1): 52-59.
[13] OSMAN I, DAI J, MIKHAIL M, et al. Loss of neutral endopeptidase and activation of protein kinase B (Akt) is associated with prostate cancer progression [J]. Cancer, 2006, 107(11): 2628-2636.
[14] SHEN R, SUMITOMO M, DAI J, et al. Androgen-induced growth inhibition of androgen receptor expressing androgen-independent prostate cancer cells is mediated by increased levels of neutral endopeptidase [J]. Endocrinology, 2000, 141(5): 1699-1704.
[15] SUMITOMO M, IWASE A, ZHENG R, et al. Synergy in tumor suppression by direct interaction of neutral endopeptidase with PTEN [J]. Cancer cell, 2004, 5(1): 67-78.
[16] SINGH G, CHAN AM. Post-translational modifications of PTEN and their potential therapeutic implications [J]. Curr Cancer Drug Targets, 2011, 11(5): 536-547.
[17] FELDMAN B J, FELDMAN D. The development of androgen-independent prostate cancer [J]. Nature Revi Cancer, 2001, 1(1): 34-45.
[18] AHMED S F, DEB S, PAUL I, et al. The chaperone-assisted E3 ligase C terminus of Hsc70-interacting protein (CHIP) targets PTEN for proteasomal degradation [J]. J Biol Chem, 2012, 287(19): 15996-6006.
[19] SRIVASTAVA J, PROCYK K J, ITURRIOZ X, et al. Phosphorylation is required for PMA- and cell-cycle-induced degradation of protein kinase C delta [J].Biochem J, 2002, 368(Pt 1): 349-355.
[20] SUMITOMO M, ASANO T, ASAKUMA J, et al. Chemosensitization of androgen-independent prostate cancer with neutral endopeptidase [J]. Clin Cancer Res, 2004, 10(1 Pt 1): 260-266.
[21] ILYAS M. Wnt signalling and the mechanistic basis of tumour development [J]. J pathol, 2005, 205(2): 130-144.
[22] ROCCHI P, SO A, KOJIMA S, et al. Heat shock protein 27 increases after androgen ablation and plays a cytoprotective role in hormone-refractory prostate cancer [J]. Cancer Res, 2004, 64(18): 6595-6602.
[23] ZOUBEIDI A, CHI K, GLEAVE M. Targeting the cytoprotective chaperone, clusterin, for treatment of advanced cancer [J]. Clin Cancer Res, 2010, 16(4): 1088-1093.
[24] PARCELLIER A, SCHMITT E, GURBUXANI S, et al. HSP27 is a ubiquitin-binding protein involved in I-kappaBalpha proteasomal degradation [J]. Mol cell biol, 2003, 23(16): 5790-802.
[25] ZHONG B, SALLMAN D A, GILVARY D L, et al. Induction of clusterin by AKT-role in cytoprotection against docetaxel in prostate tumor cells [J]. Mol Cancer Ther, 2010, 9(6): 1831-41.
[26] PAPANDREOU C N, LOGOTHETIS C J. Bortezomib as a potential treatment for prostate cancer [J]. Cancer res, 2004, 64(15): 5036-5043.
[27] MASDEHORS P, MERLE-BERAL H, MALOUM K, et al. Deregulation of the ubiquitin system and p53 proteolysis modify the apoptotic response in B-CLL lymphocytes [J]. Blood, 2000, 96(1): 269-274.
[28] IKEZOE T, YANG Y, SAITO T, et al. Proteasome inhibitor PS-341 down-regulates prostate-specific antigen (PSA) and induces growth arrest and apoptosis of androgen-dependent human prostate cancer LNCaP cells [J]. Cancer science, 2004, 95(3): 271-275.
[29] WANG Z, WANG J, LI X, et al. Bortezomib prevents oncogenesis and bone metastasis of prostate cancer by inhibiting WWP1, Smurf1 and Smurf2 [J]. Int J Oncol, 2014, 45(4): 1469-1478.
[30] THORPE JA, CHRISTIAN PA, SCHWARZE SR. Proteasome inhibition blocks caspase-8 degradation and sensitizes prostate cancer cells to death receptor-mediated apoptosis [J].Prostate, 2008, 68(2): 200-209.
[31] KANDASAMY K, KRAFT AS. Proteasome inhibitor PS-341 (VELCADE) induces stabilization of the TRAIL receptor DR5 mRNA through the 3′-untranslated region [J]. Mol Cancer Ther, 2008, 7(5): 1091-1100.
[32] WILLIAMS S, PETTAWAY C, SONG R, et al. Differential effects of the proteasome inhibitor bortezomib on apoptosis and angiogenesis in human prostate tumor xenografts [J]. Mol Cancer Ther, 2003, 2(9): 835-843.
[33] FRANKLAND-SEARBY S, BHAUMIK SR. The 26S proteasome complex: an attractive target for cancer therapy [J]. Biochem Biophys Acta, 2012, 1825(1): 64-76.
[34] VOUTSADAKIS I A C N. Papandreou. The ubiquitin-proteasome system in prostate cancer and its transition to castration resistance [J]. Urol Oncol, 2012, 30(6):752-761.
[35] TANG YQ, HAN BM. Chimeric molecules facilitate the degradation of androgen receptors and repress the growth of LNCaP cells [J]. Asian J Androl, 2009, 11(1): 119-126.
[36] QI J, TRIPATHI M. The E3 ubiquitin ligase Siah2 contributes to castration-resistant prostate cancer by regulation of androgen receptor transcriptional activity [J]. Cancer Cell, 2013, 23(3):332-346.
[37] AGGARWAL B B, BANERJEE S, BHARADWAJ U, et al. Curcumin induces the degradation of cyclin E expression through ubiquitin-dependent pathway and up-regulates cyclin-dependent kinase inhibitors p21 and p27 in multiple human tumor cell lines [J]. Biochem pharmacol, 2007, 73(7): 1024-1032.
[38] CIMINO S, SORTINO G, FAVILLA V, et al. Polyphenols: key issues involved in chemoprevention of prostate cancer [J]. Oxidative medicine and cellular longevity, 2012:(63295):9-16.
[39] REINER T, PARRONDO R, DE LAS POZAS A, et al. Betulinic acid selectively increases protein degradation and enhances prostate cancer-specific apoptosis: possible role for inhibition of deubiquitinase activity [J]. PLoS One, 2013, 8(2): e56234.
[40] ZHANG P, BI C, SCHMITT S M, et al. Metal-based 2,3-indolinedione derivatives as proteasome inhibitors and inducers of apoptosis in human cancer cells [J]. Int J Mol Med, 2014, 34(3): 870-879.
(编辑 何宏灵)
2015-01-19
2015-03-31
国家自然科学基金资助(No.81402083)
郭应禄,主任医师,教授,博士生导师.E-mail: gyl07@sina.com.
巩艳青(1981-),女(汉族),博士,助理研究员.研究方向:泌尿系肿瘤.E-mail: yqgong@bjmu.edu.cn
R737
A
10.3969/j.issn.1009-8291.2015.06.021
