Simpuleucel-T疫苗治疗转移去势抵抗性前列腺癌新进展
2015-06-24曾宪涛王行环
李 胜,曾宪涛,王行环
(武汉大学中南医院:1.泌尿外科,2.循证与转化医学中心,湖北武汉 430071;3. 武汉大学循证与转化医学中心,湖北武汉 430071)
·综 述·
Simpuleucel-T疫苗治疗转移去势抵抗性前列腺癌新进展
李 胜1,2,3,曾宪涛2,3,王行环1,2,3
(武汉大学中南医院:1.泌尿外科,2.循证与转化医学中心,湖北武汉 430071;3. 武汉大学循证与转化医学中心,湖北武汉 430071)
Sipuleucel-T是首个被美国FDA批准用于晚期前列腺癌治疗的疫苗制剂,能使中位生存期的延长超过两年。它被美国国立综合癌症网络(NCCN)指南作为Ⅰ级推荐用于无症状或有轻微症状的转移去势抵抗性前列腺癌(mCRPC)患者的治疗。本文旨在系统综述Sipuleucel-T疫苗治疗mCRPC的机制、方法、临床使用指征、临床试验、循证证据及联合应用等方面的最新进展。
前列腺癌;CRPC;Simpuleucel-T;免疫治疗;系统综述
前列腺癌是欧美国家老年男性最常见的恶性肿瘤,发病率高,死亡率仅次于肺癌,位居第二[1]。我国前列腺癌发病率以往虽低于欧美国家,但近年来呈显著增长趋势。据统计1998~2008年中国男性前列腺癌发病率平均增长比例约为12.07%。2008年中国前列腺癌发病率高达11.0/104,超过世界人口标化发病率(6.73/104),且北京等大城市50岁以上居民筛查检出率更是与欧美国家的相仿[2-3]。目前,国内临床上前列腺癌仍以晚期肿瘤为主,多数采用内分泌治疗,开始有效果,但最终大多进展为转移性去势抵抗性前列腺癌(metastatic castration-resistant prostate cancer,mCRPC)[4]。根据2013年版欧洲泌尿外科和2014版中国泌尿外科前列腺癌诊治指南,对于mCRPC的患者,目前可以选择的治疗方案归纳总结如图1。

图1 mCRPC的治疗选择流程图
*无症状或轻微症状的患者;mCRPC:转移性去势抵抗性前列腺癌
目前,各种治疗前列腺癌的新药物在国内均处在酝酿上市阶段,它们大致可以分为两大类:新型激素治疗(阿比特龙、MDV3100)、非激素治疗(免疫治疗、卡巴他赛、镭223)。在各种新兴的治疗方法中,前列腺癌免疫治疗的副作用相对较轻,临床试验结局显示患者开始Sipuleucel-T疫苗免疫治疗后的中位生存时间约为25.8个月[5]。目前国内外前列腺癌免疫治疗的指征和流程亟待规范[6]。本文旨在以肿瘤疫苗Sipuleucel-T为例将前列腺癌免疫治疗的机制方法、临床使用指征、临床试验、循证证据及联合应用等方面的最新进展做一系统综述。
1 Sipuleucel-T疫苗简介
2010年4月,美国Dendreon公司开发的疫苗Sipuleucel-T(Provenge,普罗文奇)成为首个获得美国食品及药物管理局(Food and Drug Administration,FDA)批准应用于临床的肿瘤疫苗制剂,用于治疗无症状或轻微症状的mCRPC患者,毒副作用较轻,且可延长患者中位生存期4.1个月[7]。
2 Sipuleucel-T作用的基础原理
抗原递呈细胞(antigen presenting cell,APC)介导的免疫反应是Sipuleucel-T作用原理的基础[8]。APC是指能够加工处理抗原并递呈给T细胞的一类细胞,主要包括树突状细胞(dendritic cell,DC)、单核巨噬细胞、B细胞等。抗原被APC识别摄入,加工处理后递呈给T细胞并使其活化,活化的T细胞分泌IL-2、IL-12、IL-4等多种细胞因子,最终激活细胞毒性T细胞和B细胞,产生免疫应答。在人体对肿瘤细胞的免疫反应中,细胞毒性T细胞介导的细胞免疫发挥主要作用[9-10]。
3 Sipuleucel-T的制备及其免疫治疗的机制
①通过白细胞除去法、密度梯度离心法从患者外周血中采集富含APC的外周血单核细胞(peripheral blood mononuclear cell,PBMC);②将得到的细胞在不含外源性细胞因子或者血清的适宜环境下和PA2024重组蛋白共同培养36~44 h,制成的产物即为Sipuleucel-T;③将其于第3天回输患者体内。步骤2中提到的PA2024是前列腺酸性磷酸酶(prostatic acid phosphatase,PAP)的羧基末端和粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony stimulating factor, GM-CSF)的氨基末端连接而成的重组蛋白。其中PAP可高度表达于多数前列腺癌细胞中,它作为T细胞攻击的靶抗原,被APC所识别并处理。其中GM-CSF的作用是促进APC的增殖分化,增强抗原递呈能力[11]。制成的Sipuleucel-T含有把PAP作为靶抗原加工处理并递呈到细胞表面的APC,可诱导患者体内产生对PAP特异的CD4+和CD8+的T细胞,从而激活对前列腺癌细胞的免疫反应,杀伤癌细胞[5, 12-14]。见图2。
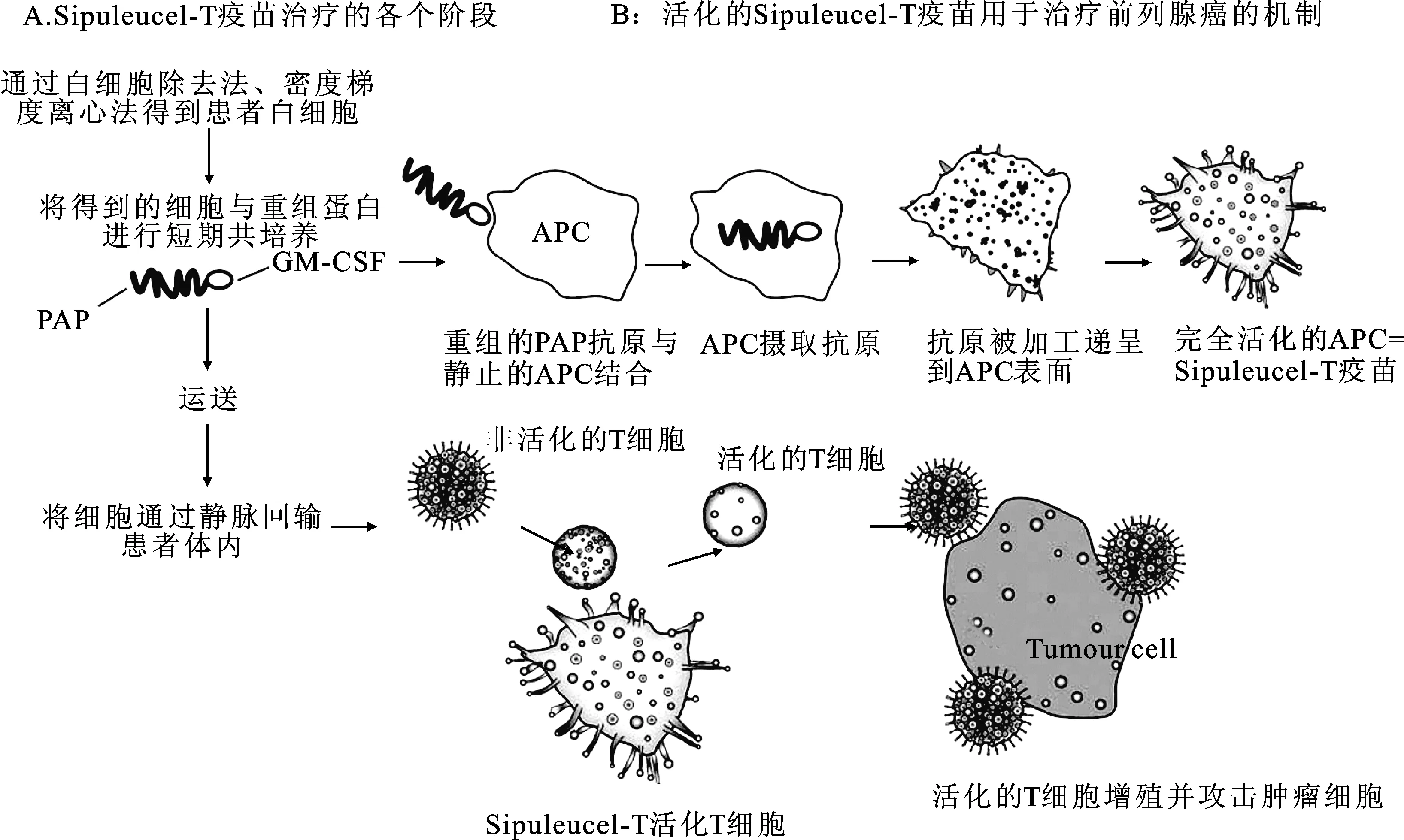
图2 Sipuleucel-T免疫治疗CRPC患者的作用机制
APC:抗原呈递细胞;GM-CSF:粒细胞-巨噬细胞集落刺激因子;PAP:前列腺酸性磷酸酶。
4 Sipuleucel-T相关的临床试验
相关的三期临床试验研究表明:Sipuleucel-T可有效延长前列腺癌患者的总体生存期(overall survival, OS),但无证据说明其可以影响疾病进展时间(time to progression, TTP)。国际上最早的多中心、随机、双盲、安慰剂对照的三期临床试验是D9901[15]和D9902A[16]。它们的研究结果分别是Sipuleucel-T组患者总体生存期延长了4.5个月(D9901)和3.3个月(D9902A)。但是这两个试验的样本量均较小,作者提出需要更大样本量的试验来进一步验证Sipuleucel-T的疗效。2010年7月发表在新英格兰杂志的IMPACT三期临床试验[17]最终促使了FDA批准Sipuleucel-T的临床应用。IMPACT也是一个随机、双盲、安慰剂对照的多中心研究。研究将512例mCRPC患者按照2∶1的比例随机分为两组(Sipuleucel-T组:341例;安慰剂对照组:171例),分别每两周静脉注射一次,共进行3次。主要研究结局指标是OS,次要结局指标是疾病进展时间(time to progression, TTP),中位随访时间为34.1个月。结果Sipuleucel-T组死亡210例(61.6%),对照组死亡121例(70.8%),Sipuleucel-T组死亡风险比对照组降低22%。36个月时Sipuleucel-T组生存率为31.7%,对照组存活率为23.0%,生存率增加38%,数据分析表明Sipuleucel-T组中位OS为25.8个月,Sipuleucel-T有效延长了mCRPC患者的生存时间达4.1个月,生存获益有统计学意义(P=0.03)。同时,在多种因素校正分析中,如年龄、体力状况ECOG评分、Gleason评分、二膦酸盐是否应用等,Sipuleucel-T治疗组的OS获益都有统计学意义。在TTP两组间比较差异无统计学意义。此外,Sipuleucel-T组有311例接受PSA评估,下降超过50%的有8例,对照组的153例中有2例。免疫反应结果分析Sipuleucel-T组患者PA2024和PAP的抗体滴度均明显高于对照组,T细胞对PA2024和PAP的反应性增殖也明显高于对照组,说明Sipuleucel-T可有效诱导患者对前列腺癌细胞的免疫反应。预后分析表明Sipuleucel-T组中对PA2024或PAP的抗体滴度持续>400的患者的存活时间比抗体滴度≤400的患者要长(P<0.001和P=0.08)。
PROCEED是一个正在进行的、多中心的、观察性的Ⅳ期临床试验,主要目的在于客观的评估Sipuleucel-T组患者的脑血管事件发生风险,次要目的在于进一步评价患者的OS。回顾性的分析了患者的基本信息、疾病特点以及产品的参数。目前数据显示Sipuleucel-T疫苗使用后,≥80岁的患者比80岁以下患者APC活化的免疫学证据要高,即相对有更好的产品效力[APC计数类似于有核细胞总数(total nucleated cell,TNC)][18]。此外,有些研究指出:在前期接受了醋酸阿比特龙和/或MDV3100治疗的患者,后期不影响Sipuleucel-T产物的产生和呈递,甚至有可能增强这一免疫疗法的效果[19]。
在治疗mCRPC患者过程的某一阶段中可能会通过放射治疗骨转移[20]。一个名为PRIME的亚组研究(NCT01727154)前瞻性的分析了放射治疗后活体内的免疫反应情况,并通过研究Sipuleucel-T和放疗的相互作用表明:先前的放射治疗并不会影响Sipuleucel-T免疫产物的产生。在前期接受了放疗的病人相比未放疗患者,TNC计数和APC活化数都更低。然而,两组之间的APC计数是相似的。但仍需要更多的研究数据来描述放疗对免疫系统环境的影响[21]。
5 Sipuleucel-T治疗mCRPC的Meta分析结果
2012年,波兰首府雅盖隆大学的研究者KAWALEC博士等[22]采用系统评价和Meta分析的方法对Sipuleucel-T治疗mCRPC做了相对客观的评价。他们的研究结果显示: Sipuleucel-T疫苗治疗组患者的总体生存期比对照组的长(95%CI: 0.61~0.88,P=0.001)。疾病进展时间上,两组间比较差异无统计学意义(95%CI: 0.75~1.05,P=0.18)。Sipuleucel-T免疫治疗组的总体不良事件、3~5级不良事件及脑血管事件的发生风险相对较低,但比较对照组均无明显统计学差异(P>0.05,表1)。结果表明:Sipuleucel-T的使用延长了mCRPC患者的总体生存期,但未影响疾病进展时间,且安全性是可以接受的。

表1 Sipuleucel-T治疗mCRPC的系统评价或Meta分析结果
HR: Hazard ratios; RB:Relative benefit;RR:Relative risk。
6 Sipuleucel-T在治疗晚期前列腺癌患者中的应用
2010年4月29日,美国Dendreon公司开发的疫苗Sipuleucel-T(Provenge,普罗文奇)获得FDA批准成为首个应用于临床的肿瘤疫苗制剂,用于治疗无症状或轻微症状的转移性前列腺癌患者或者疾病连续进展(依据影像学证据或前列腺特异性抗原升高)的患者或者去势抵抗(雄激素阻断治疗后疾病仍进展)的患者。使用这个药剂早期治疗对一个肿瘤负荷较低和有完整的免疫系统的患者是有益的。假设在使用免疫抑制或细胞毒性治疗方案之前,如化疗及其他激素治疗。早期使用这个药剂可能会有助于免疫系统激发和兴奋。Sipuleucel-T是一种能明显延长无症状或轻微症状mCRPC患者OS的免疫疗法,具有显著统计学意义[23-24]。此外,Sipuleucel-T不仅仅对无症状或轻微症状mCRPC患者有效,在前列腺癌疾病进展中也有后续治疗作用。Sipuleucel-T开展的难点有白细胞采集过程和治疗的费用等。对于既往接受过激素治疗且身体状况不佳的mCRPC患者,虽然基于FDA的批准不排除使用Sipuleucel-T疗法,但此类患者并不包括在Sipuleucel-T的临床试验中。因此,Sipuleucel-T是否一定有益于此类患者人群是未知的。基于最近的E3805试验,激素敏感的转移性前列腺癌治疗范式可能发生变化,越来越多的患者将更早接受多西他赛治疗[25]。Sipuleucel-T能在化疗后成功引起免疫反应,使患者生存获益[26]。故综合免疫疗法是转移性前列腺癌治疗的新前景。
7 Sipuleucel-T联合去势治疗
约20%~40%的局限性前列腺癌患者在初始局部治疗后会出现生化复发(biochemically recurrence prostate cancer,BRPC),ADT(雄激素去势疗法)作为标准疗法被应用于此类患者[27]。有研究证实ADT能提高抗癌反应和增强癌症免疫疗法[28]。为进一步研究Sipuleucel-T联合ADT的给药时序,一项纳入60例患者的Ⅱ期随机试验得以开展。在该项研究中,高危或有远处转移的BRPC受试患者接受了两种不同的标准疗程进行治疗(①Sipuleucel-T注射3次并于末次注射两周后接受ADT;②ADT治疗开始12周后接受Sipuleucel-T)。为深入明确免疫效应方面最为有效的治疗方案,研究的主要终点为细胞免疫反应(针对PA2024即PAP-GMCSF抗原的ELISPOT酶联免疫斑点反应),次要终点包括激素与细胞因子效应。
初步研究结果提示,于ADT治疗起始后给予Sipuleucel-T所产生的前列腺癌特异性抗原靶向T细胞效应与免疫反应相比ADT治疗起始前给予Sipuleucel-T者要有所增强,但其差异较小且需要在大型Ⅲ期随机试验中进行验证。上述结果支持或证明了T细胞效应可为ADT所强化的临床前资料,并为“ADT与 Sipuleucel-T联合疗法”可能增强免疫反应的初步证据进行了延伸补充。随访数据将着眼于免疫效应与临床指标之间的关联,就前列腺癌而言即PSA水平。这些最新结果提示:Sipuleucel-T可不依赖于ADT而在BRPC患者中介导类似的初免-强化(prime-boost)激活模式并产生抗原特异性细胞与体液免疫反应[29]。
8 Sipuleucel-T联合抗雄激素治疗
近期一项Ⅱ期研究(其摘要在2013年ASCO大会上进行了报告)正在对Sipuleucel-T联合同步或序贯乙酸阿比特龙酯及强的松治疗mCRPC进行评价,这两种药物均获准用于无症状或有轻微症状的mCRPC患者。乙酸阿比特龙酯可发挥降低循环雄激素水平的功效,而雄激素轴的抑制具有免疫调节功能,因此乙酸阿比特龙酯与Sipuleucel-T可能具有协同作用的假说得以提出。该试验将无症状或有轻微症状的mCRPC患者按1∶1的比例进行随机分组,或于Sipuleucel-T首次注射后1日开始为期可达26周的乙酸阿比特龙酯与强的松治疗(同步治疗组),或于Sipuleucel-T首次注射后10周开始乙酸阿比特龙酯与强的松治疗(序贯治疗组)。最近一次期中分析的数据支持了在乙酸阿比特龙酯与强的松同步治疗期间可成功制备Sipuleucel-T的观点。最终制备产物及初免-强化反应的效能同单用Sipuleucel-T者相近。免疫效应及不良事件(adverse event,AE)在两治疗组中相当。目前尚不明确Sipuleucel-T联合同步或序贯乙酸阿比特龙酯及强的松对于患者生存的影响[30]。
9 展 望
多项研究显示大多数CRPC患者最终将出现远处转移,发展成为mCRPC。临床医师应当警惕这一点并对PSA升高或前列腺特异性抗原倍增时间(prostate specific antigen doubling time, PSADT)较短的患者筛检有无远处转移。Sipuleucel-T是首个被美国FDA批准用于晚期前列腺癌治疗的疫苗制剂,能使中位生存期的延长超过2年。它被美国国立综合癌症网络(National Comprehensive Cancer Network, NCCN)指南作为1类推荐用于无症状或有轻微症状的mCRPC患者的治疗,临床医师在处理此类患者时应当着重考虑Sipuleucel-T。此外,目前多种Sipuleucel-T疫苗联合治疗的方法百家争鸣[31-32],若要将前列腺癌免疫治疗发展为一项更加成熟有效的治疗方法,还需要不懈的努力。
[1] JEMAL A, SIEGEL R, XU J, et al. Cancer statistics, 2010 [J]. CA Cancer J Clin, 2010, 60(5): 277-300.
[2] 韩苏军, 张思维, 陈万青, 等. 中国前列腺癌发病现状和流行趋势分析 [J]. 临床肿瘤学杂志, 2013, 18(4): 330-334.
[3] 王行环, 刘同族. 提高认识规范诊疗——《前列腺癌诊断标准》解读 [J]. 中国卫生标准管理, 2012, 2(4): 25-27.
[4] RISK M, CORMAN JM. The role of immunotherapy in prostate cancer: an overview of current approaches in development [J]. Rev Urol, 2009, 11(1): 16-27.
[5] GARCIA JA. Sipuleucel-T in patients with metastatic castration-resistant prostate cancer: an insight for oncologists [J]. Ther Adv Med Oncol, 2011, 3(2): 101-108.
[6] 郑国洋, 王伟, 陈山. 前列腺癌免疫治疗进展 [J]. 中华临床医师杂志:电子版, 2013, 7(13): 6035-6038.
[7] CHEEVER MA, HIGANO CS. PROVENGE (Sipuleucel-T) in prostate cancer: the first FDA-approved therapeutic cancer vaccine [J]. Clin Cancer Res, 2011, 17(11): 3520-3526.
[8] OLSONl BM, MCNEEL DG. Sipuleucel-T: immunotherapy for advanced prostate cancer [J]. Open Access J Urol, 2011, 3(3): 49-60.
[9] 邵惠训. 树突状细胞疫苗的现状与未来 [J]. 中国医药生物技术, 2012, 1(7): 62-65.
[10] 王冰, 王红梅, 徐方云, 等. 树突状细胞与肿瘤免疫 [J]. 中国细胞生物学学报, 2013, 35(11): 1666-1671.
[11] RINI BI, FONG L, WEINBERG V, et al. Clinical and immunological characteristics of patients with serologic progression of prostate cancer achieving long-term disease control with granulocyte-macrophage colony-stimulating factor [J]. J Urol, 2006, 175(6): 2087-2091.
[12] KIESSLING A, FUSSEL S, WEHNER R, et al. Advances in specific immunotherapy for prostate cancer [J]. Eur Urol, 2008, 53(4): 694-708.
[13] GERRITSEN WR. The evolving role of immunotherapy in prostate cancer [J]. Ann Oncol, 2012, 23 (Suppl 8): viii22-7.
[14] ANASSI E, NDEFO UA. Sipuleucel-T (provenge) injection: the first immunotherapy agent (vaccine) for hormone-refractory prostate cancer [J]. P T, 2011, 36(4): 197-202.
[15] SMALL EJ, SCHELLHAMMER PF, Higano CS, et al. Placebo-controlled phase III trial of immunologic therapy with sipuleucel-T (APC8015) in patients with metastatic, asymptomatic hormone refractory prostate cancer [J]. J Clin Oncol, 2006, 24(19): 3089-3094.
[16] HIGANO CS, SCHELLHAMMER PF, SMALL EJ, et al. Integrated data from 2 randomized, double-blind, placebo-controlled, phase 3 trials of active cellular immunotherapy with sipuleucel-T in advanced prostate cancer [J]. Cancer, 2009, 115(16): 3670-3679.
[17] KANTOFF PW, HIGANO CS, SHORE ND, et al. Sipuleucel-T immunotherapy for castration-resistant prostate cancer [J]. N Engl J Med, 2010, 363(5): 411-422.
[18] NABHAN C, SARTOR O, COOPERBERG M. Sipuleucel-T in metastatic castration-resistant prostate cancer (mCRPC) patients ≥ 80 years-old: data from PROCEED [J]. Clin Adv Hematol Oncol, 2014, 12(4 Suppl 11): 11.
[19] VOGELZANG N, VACIRCA J, KANTOFF P. Effect of prior abiraterone (ABI) or enzalutamide (ENZ) on sipuleucel-T (sip-T) manufacture in PROCEED patients (pts) [J]. J Clin Oncol, 2014, 32(4 Suppl): 185.
[20] HEIDENREICH A, BASTIAN PJ, BELLMUNT J, et al. EAU guidelines on prostate cancer. Part II: Treatment of advanced, relapsing, and castration-resistant prostate cancer [J]. Eur Urol, 2014, 65(2): 467-479.
[21] FINKELSTEIN S, NORDQUIST L, DAKHIL S. Impact of prior radiation treatment on sipuleucel-T product parameters in PROCEED patients [J]. Clin Adv Hematol Oncol, 2014, 12(4 Suppl 11): 8.
[22] KAWALEC P, PASZULEWICZ A, HOLKO P, et al. Sipuleucel-T immunotherapy for castration-resistant prostate cancer. A systematic review and meta-analysis [J]. Arch Med Sci, 2012, 8(5): 767-775.
[23] GULLEY JL, MADAN RA, ARLEN PM. Enhancing efficacy of therapeutic vaccinations by combination with other modalities [J]. Vaccine, 2007, 25: B89-B96.
[24] GULLEY JL, MADAN RA, SCHLOM J. Impact of tumour volume on the potential efficacy of therapeutic vaccines [J]. Curr Oncol, 2011, 18(3): e150.
[25] BASCH E, LOBLAW DA, OLIVER TK, et al. Systemic therapy in men with metastatic castration-resistant prostate cancer: american society of clinical oncology and cancer care ontario clinical practice guideline [J]. J Clin Oncol, 2014, 32(30): 3436-3448.
[26] SHORE ND, MANTZ CA, DOSORETZ DE, et al. Building on sipuleucel-T for immunologic treatment of castration-resistant prostate cancer [J]. Cancer Control, 2013, 20(1): 7-16.
[27] HEIDENREICH A, BELLMUNT J, BOLLA M, et al. EAU guidelines on prostate cancer. Part 1: screening, diagnosis, and treatment of clinically localised disease [J]. European urology, 2011, 59(1): 61-71.
[28] SRIDHAR SS, FREEDLAND SJ, GLEAVE ME, et al. Castration-resistant prostate cancer: from new pathophysiology to new treatment [J]. Eur Urol, 2014, 65(2): 289-299.
[29] SINGH BH, GULLEY JL. Immunotherapy and therapeutic vaccines in prostate cancer: an update on current strategies and clinical implications [J]. Asian J Androl, 2014, 16(3): 364-371.
[30] SMALL EJ, LANCE RS, REDFERN CH, et al. A randomized phase II trial of sipuleucel-T with concurrent or sequential abiraterone acetate (AA) plus prednisone (P) in metastatic castrate-resistant prostate cancer (mCRPC) [J]. J Clin Oncol, 2013, 31(15): Suppl. 1.
[31] TOMBAL B. Continuous improvement versus innovation: the case for sipuleucel-T [J]. Eur Urol, 2012, 61(4): 648-649.
[32] JONIAU S, ABRAHAMSSON PA, BELLMUNT J, et al. Current vaccination strategies for prostate cancer [J]. Eur Urol, 2012, 61(2): 290-306.
(编辑 何宏灵)
2015-01-26
2015-03-05
国家自然科学基金项目(No.81172734);湖北省医学领军人才培养工程专项经费 (No.鄂卫生计生发[2013]4号)
王行环,教授,博士生导师.E-mail:urologistwxh@gmail.com
李胜(1984-),男(汉族),博士。研究方向:泌尿外科疾病与循证医学.E-mail:2010lisheng@gmail.com
R737
A
10.3969/j.issn.1009-8291.2015.06.020
