A1AT、MYH10在膀胱尿路上皮癌中的表达及其临床意义
2015-06-24成重峰王沛涛王新生牛海涛
成重峰,徐 婷,荆 涛,王沛涛,王新生,牛海涛
(1.青岛大学医学院,山东青岛 266021;2.解放军第401医院,山东青岛 266071;3.青岛大学附属医院,山东青岛 266003)
·临床研究·
A1AT、MYH10在膀胱尿路上皮癌中的表达及其临床意义
成重峰1,徐 婷2,荆 涛3,王沛涛3,王新生3,牛海涛3
(1.青岛大学医学院,山东青岛 266021;2.解放军第401医院,山东青岛 266071;3.青岛大学附属医院,山东青岛 266003)
目的 探讨α-抗胰蛋白酶A1AT、肌球蛋白10MYH10在膀胱尿路上皮癌组织中的表达与其病理分级和临床分期的关系。方法 采用免疫组化SP法检测标本中A1AT、MYH10的表达,根据临床病理资料进行分析;A1AT、MYH10的表达情况与膀胱癌的病理分级及临床分期的关系采用χ2和Fisher’s确切概率法统计分析。结果 在癌旁正常膀胱组织中A1AT和MYH10的阳性表达率分别为10%、0%,而在60例膀胱尿路上皮癌细胞及癌旁间质细胞中,阳性表达率分别为81.7%、60%,膀胱尿路上皮癌细胞及癌旁间质细胞A1AT和MYH10阳性表达率显著高于癌旁正常膀胱组织(P<0.01)。A1AT和MYH10的阳性表达率在低分级膀胱尿路上皮癌中分别为68%、36%,在高分级膀胱尿路上皮癌中分别为91.4%、77.1%,在非肌层浸润性膀胱尿路上皮癌中分别为65%、30%,在肌层浸润性膀胱尿路上皮癌中分别为90%、75%。A1AT和MYH10在高分级、肌层浸润性膀胱癌组织中的阳性表达率明显高于低分级、非肌层浸润性膀胱癌组织,2种标记物在膀胱癌的病理分级和临床分期之间表达差异有统计学意义(P<0.05)。结论 A1AT、MYH10在膀胱尿路上皮癌的发生、发展过程中可能起到重要作用,可作为膀胱尿路上皮癌的新的肿瘤标记物,并为膀胱尿路上皮癌的预防及诊疗提供新的靶点。
膀胱癌;尿路上皮癌;间质细胞;A1AT;MYH10;免疫组织化学
膀胱癌是我国泌尿系统中最常见的肿瘤,且发病率有逐年增高的趋势。近年随着对膀胱癌发生发展机理的逐步研究,许多相关肿瘤标记物被发现可用于协助膀胱癌的诊疗。癌旁间质蛋白质的改变而引起膀胱肿瘤的机制也成为近年研究热点,其中在治疗方式的选择和肿瘤预后评估方面取得了一定的进展[1]。我们应用免疫组化方法检测A1AT、MYH10在膀胱尿路上皮癌癌细胞及癌旁间质细胞表达以探讨其与膀胱癌发生、发展的关系及临床意义。
1 资料与方法
1.1 一般资料 标本来源于2009年1月至2013年12月青岛大学附属医院泌尿外科住院行手术切除病理存档的60例标本,癌旁正常组织标本10例。其中膀胱全切术33例,膀胱部分切除术19例, 经尿道膀胱肿瘤电切术 (transurethral resection of bladder tumor,TURBt) 8例。男40例,女20例;年龄32~75岁,平均(58.3±10.5)岁;均为首次发病且未行任何放化疗。世界卫生组织(World Health Organization,WHO) 2004分级:低分级25例,高分级35例;国际抗癌联盟(Union for International Cancer Control,UICC) 2009 TNM分期:非肌层浸润性膀胱癌(Tis-1)20例,肌层浸润性膀胱癌(T2-4)40例。
1.2 试剂 A1AT一抗兔抗人多克隆抗体,MYH10一抗兔抗人多克隆抗体 购自武汉博士德生物公司,SP免疫组化试剂盒购自福州迈新生物技术公司。
1.3 免疫组化染色方法 根据试剂盒步骤,标本经10%(体积分数)甲醛固定,石蜡包埋,常规方法连续切片,厚4 μm,切片经二甲苯脱蜡,无水乙醇脱水,自来水冲洗、试剂A封闭阻断内源性过氧化物酶,PBS水洗后进行抗原修复,滴加一抗4℃过夜,水洗后DAB显色,苏木素复染、乙醇脱水,中性树胶封片。以PBS代替一抗作为阴性对照,染色步骤严格按照试剂盒说明书进行。
1.4 阳性结果判断 由2位副高以上从事免疫组化实验的医师在双盲的条件下对染色结果进行评判:ACTN4、A1AT、MYH10阳性为细胞质棕黄色显色。所有染色结果均采用统一评分标准,评分过程均重复3次以上,以尽可能减少误差。在高倍镜下选取10个不同视野,每视野计数100个细胞,采用半定量法,观察阳性细胞染色强度并对阳性细胞百分比进行评分。阳性细胞染色强度评分:无色为0分,浅黄色记为1分,棕黄色记为2分,棕褐色记为3分;按阳性细胞所占百分比评分:0分为无阳性细胞,1分为<25%,2分为25%~50%,3分为>50%;以染色强度和阳性细胞百分比的总积分判断,总积分<3分判为阴性,3~6分判为阳性[2]。
1.5 统计学方法 利用SPSS19.0统计学软件进行数据处理,根据A1AT和MYH10的表达情况与膀胱癌的临床病理分级及分期的关系采用χ2和Fisher’s确切概率法进行检验,P<0.05为差异有统计学意义,P<0.01为差异有显著统计学意义。
2 结 果
2.1 膀胱癌和癌旁正常组织中A1AT和MYH10的表达情况 A1AT和MYH10在正常组与膀胱癌组的阳性表达率在统计学上均有显著性意义(P<0.01,表1)。表明A1AT和MYH10与膀胱癌的发生发展均有密切关系。

表1 正常膀胱组织与膀胱癌组织中A1AT和MYH10阳性表达率比较 [例(%)]
2.2 膀胱癌组织中A1AT和MYH10蛋白表达与膀胱癌不同病理分级及临床分期之间的关系
2.2.1 A1AT阳性表达与膀胱癌病理分级和临床分期的关系 A1AT在低分级和高分级尿路上皮癌组的阳性表达率在统计学上有意义(P<0.05);在非肌层浸润性和肌层浸润性膀胱癌组的阳性表达率在统计学上有意义(P<0.05)。由此得出A1AT与膀胱尿路上皮癌的恶性程度和浸润程度具有相关性(表2)。A1AT在正常组膀胱上皮细胞及间质不表达,在高级别尿路上尿癌及间质细胞表达较在低级别者中要强(图1)。
2.2.2 MYH10阳性表达与膀胱癌病理分级和临床分期的关系 MYH10在低分级和高分级尿路上皮癌组的阳性表达率在统计学上有意义(P<0.05);在非肌层浸润性和肌层浸润性膀胱癌组的阳性表达率在统计学上有意义(P<0.05)。由此得出MYH10与膀胱尿路上皮癌的恶性程度和浸润程度具有相关性(表2)。MYH10在高级别尿路上皮癌细胞及间质细胞中表达较在低级别者中要强(图2)。

表2 A1AT和MYH10蛋白表达与膀胱癌临床病理参数的关系 [例(%)]
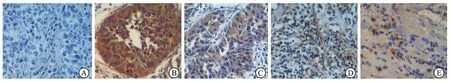
图1 A1AT在膀胱正常组及尿路上皮癌组中的表达(SP,×100)
A:在正常上皮及间质细胞不表达;B:在高分级膀胱尿路上皮癌细胞呈阳性染色;C:在低分级尿路上皮癌细胞呈阳性染色;D:在高分级尿路上皮癌的癌旁间质细胞阳性染色;E:在低分级尿路上皮癌癌旁间质细胞阳性染色。

图2 MYH10在膀胱尿路上皮癌组中的表达(SP,×100)
A:在高分级膀胱尿路上皮癌细胞呈阳性染色;B:低分级尿路上皮癌细胞呈阳性染色;C:在高分级尿路上皮癌的癌旁间质细胞阳性染色;D:在低分级尿路上皮癌癌旁间质细胞阳性染色。
3 讨 论
膀胱癌发病率高且术后易复发、转移,严重威胁患者生命。目前对其发病机制研究仍不明确,近年蛋白质组学研究为生物标记的发现提供了大量的侯选蛋白,为协助研究膀胱癌的生物学特性提供切入点。查阅相关文献A1AT、MYH10与多种肿瘤的发生,转移等有关。据报道膀胱癌间质细胞在调节癌异质性中起到关键性作用。而生物标记的发现应同时在肿瘤细胞及其相应的间质中进行[3-4]。A1AT、MYH10在膀胱癌癌细胞及癌旁间质细胞中表达说明其可能与膀胱癌的发生发展等有关。有关癌细胞/癌间质细胞来源的生物标记已有报道,如在胰腺癌细胞中,RNA干扰技术敲除CAP1后导致薄片状伪足结构减少,运动以及侵袭性降低[5],人类脂肪酸合酶(fatty acid synthase,FASN)为癌基因,抑制FASN可有选择性有效的杀伤癌细胞[6]。
A1AT由SERPINA1基因编码,位于第14号染色体,70位等位基因调控其合成。是一种由肝脏分泌的糖蛋白,是血清中最主要的蛋白酶抑制剂。A1AT在细胞中发挥不同的调控作用,如内稳态、细胞生存、血液凝结等方面起着很重要的作用。研究认为癌细胞可以通过释放弹性蛋白酶、纤溶酶和组织蛋白酶等破坏周围组织,进而局部扩散,而 A1AT 可以抑制这些酶的活性。而其在膀胱肿瘤中表达起到上述作用,进而可以通过抑制其在体内表达而达到治疗作用。
本研究中A1AT较少在膀胱正常组织中表达,阳性率为10%(1/10),膀胱癌细胞及癌旁间质细胞中A1AT的阳性表达率为81.7%(49/60),正常组与膀胱癌组的A1AT阳性表达率之间的差异具有显著统计学意义(P<0.01),提示A1AT与膀胱癌关系密切。低分级和高分级膀胱癌的A1AT阳性表达率分别为68%和91.4%进一步分析发现膀胱癌细胞及间质细胞A1AT的阳性表达率随着膀胱癌的病理分级升高而增高。而MIYAKE[7]的研究认为A1AT在膀胱癌患者尿液蛋白质中的监测可以为膀胱癌的诊断提供便利条件,其通过免疫组化、免疫蛋白印迹等试验证明A1AT与膀胱癌患者的病理分级有统计学意义但与临床分期不具有统计学意义,分析原因这可能与本次实验中选择的样本量较小有关,下一步可通过加大试验入组的样本量。COAKLEY[8]认为A1AT在肺癌中的表达可能是机体对肿瘤引起组织破坏和肿瘤组织浸润、扩散的防御反应。A1AT的表达水平结合其在血液中的抑制活力可对肺癌的诊疗提供一定线索,因此可以进一步预测A1AT在膀胱癌中的表达可以起到类似的作用。
MYH10蛋白是肌球蛋白超家族的的一员,由MYH10基因编码,位于17p13.3染色体。MYH10存在于肌细胞中具有收缩功能,然而在非肌细胞中各种各样的细胞功能也与肌球蛋白有关。 哺乳类动物的肌球蛋白10最初被发现坐落于丝状伪足的尖端[9-10],在丝状伪足的形成和延伸[10-11]、细胞吞噬作用[12]、细胞移动[13]等方面有重要作用。
研究中MYH10在膀胱正常组织中不表达,膀胱癌细胞及癌旁间质细胞中MYH10的阳性表达率为60%(36/60),正常组与膀胱癌组的MYH10阳性表达率之间的差异具有显著统计学意义(P<0.01),提示MYH10与膀胱癌关系密切。低分级和高分级膀胱癌的MYH10阳性表达率分别为64%和77.1%,进一步分析发现膀胱癌细胞及间质细胞MYH10的阳性表达率随着膀胱癌的病理分级升高而增高,查阅相关文献,尚未见到膀胱癌表达MYH10的报道,XIONG等[14]首次报道MYH9在膀胱癌的过表达是早期膀胱癌整体生存率的独立预测因子。然而MYH9与MYH10具有同源序列,在某些功能上具有重叠[15],因此联系MYH10在非肌细胞中的作用可以推测MYH10在膀胱癌细胞的发生发展中可能起到作用。
本次研究中A1AT、MYH10在膀胱尿路上皮癌癌细胞及癌旁间质细胞中表达并与膀胱癌的病理分级和临床分期有关,可以推测其可能参与了膀胱癌发生及发展。肿瘤间质为实质提供营养支持作用,对肿瘤的发展起促进作用,而A1AT、MYH10在肿瘤间质细胞的表达可进一步证实其在肿瘤中的作用。免疫组化实验中A1AT、MYH10在膀胱癌的高表达可作为膀胱癌是否具有高浸润性的指标并且是膀胱癌生物标记的良好侯选蛋白,可为膀胱尿路上皮癌的预防及诊疗提供新的靶点。
[1] HAMACHER M,METER HE.HUPO Brain Proteome Projcot:aims and needs in proteomics[J].Expert Rev Proteomics,2005,2(1):1-3.
[2] 高放,张凤梅,李胜水,等.膀胱良、恶性上皮肿瘤中MMP-9的表达及临床意义[J].现代医学杂志,2014,22(1):134-136.
[3] PENG FEI LIU, YAN WEI CAO, HAI PING JIANG, et al.Heterogeneity research in muscle-invasive bladder cancer based on differential protein expression analysis[J].Med Oncol,2014,31(9):21.
[4] PENG-FEI LIU, YONG-HUA WANG, YAN-WEI CAO et al.Far from resolved: Stromal cell-based iTRAQ research of muscle-invasive bladder cancer regarding heterogeneity[J].Oncol Rep,2014,32(4):1489-1496.
[5] YAMAZAKI K, TAKAMURA M, MASUGI Y, et al. Adenylate cyclase-associated protein 1 over expressed in pancreatic cancers is involved in cancer cell motility[J]. Lab Invest, 2009,89(4): 425-432.
[6] SHAO C, LIU Y, RUAN H, et al. Shotgun proteomics analysis of hibernating arctic ground squirrels[J]. Mol Cell Proteomics, 2010, 9(2): 313-326.
[7] MIYAKE M, ROSS S, LAWTON A,et al.Investigation of CCL18 and A1AT as potential urinary biomarkers for bladder cancer detection [J]. BMC Urol,2013,5:13-42.
[8] COAKLEY RJ,TAGGART C,O’NEILL S,et al. Alpha l-antitrypsin deficiency:biological answers to clinical questions[J]. Am J Med Sci,2001,321(1),33-41.
[9] BERG JS, DERFLER BH, PENNISI CM, et al. Myosin-X. a novel myosin with pleckstrin homology domains, associates with regions of dynamic actin[J]. J Cell Sci,2000,113:3439-3451.
[10] BERG JS, CHENEY RE.Myosin-X is an unconventional myosin that undregoes intrafilopodial motility[J]. Nat Cell Biol,2002,4(3):246-250.
[11] BOHIL AB, ROBERTSON BW, CHENEY RE,et al.Myosin-X is a molecular motor that functions in filopodia formation[J]. Proc Natl Acad SciUSA,2006,103(33):12411-12416.
[12] COX D, BERG JS, CAMMER M et al.Myosin X is a downstream effector of PI(3)K during phagocytosis[J].Nat Cell Biol,2002, 4(7):469-477.
[13] NIE S,KEE Y,BRONNER-FRASER M.Myosin-X is critical for migratory ability of Xenopus cranial neural crest cells[J].Dev Biol, 2009,335(1):132-142.
[14] XIONG D, YE YL, CHEN MK.Non-muscle myosin II is an independent predictor of overall survival for cystectomy candidates with early-stage bladder cancer[J].Oncol Rep,2012,28(5):1625-1632.
[15] BETAPUDI V.Myosin II motor proteins with different functions determine the fate of lamellipodia extension during cell spreading[J].PLoS One,2010,5(1):e8560.
(编辑 何宏灵)
Expressions and clinical significance of A1AT and MYH10 proteins in human bladder urothelial carcinoma
CHENG Chong-feng1, XU Ting2, JING Tao3, WANG Pei-tao3, WANG Xin-sheng3, NIU Hai-tao3
(1.Medical College of Qingdao University, Qingdao 266021; 2.the 401st Hospital of PLA, Qingdao 266071; 3. Affiliated Hospital of Qingdao University, Qingdao 266003, China)
Objective To explore the expressions of A1AT and MYH10 proteins in bladder urothelial carcinoma and their correlation with pathological grade or clinical stage of bladder urothelial carcinoma. Methods The expressions of A1AT and MYH10 in carcinoma specimens were detected with immunohistochemical staining (SP) method. The relationship among the A1AT and MYH10 expressions, pathological grade and clinical stage was further analyzed with reference to the clinicopathological data. Chi-square and Fisher’s tests were used for statistical analysis. Results In healthy para-carcinoma tissues, the positive expression rates of A1AT and MYH10 were 10% and 0% respectively, while in carcinoma specimens, their positive expression rate was 81.7% and 60%, respectively, with statistical difference (P< 0.01). The positive expression rates of A1AT in low-grade, high grade, superficial and invasive carcinoma were 68%, 91.4%, 65%, 90%, and the positive expression rates of MYH10 were 36%, 77.1%, 30%, and 75%. The results showed that the positive expression rates of A1AT and MYH10 in the high-grade and invasive bladder urothelial carcinoma were significantly higher than in the low-grade and superficial bladder urothelial carcinoma, with statistical significance (P< 0.05). Conclusions A1AT and MYH10 may play an important role in the occurrence and development of bladder urothelial carcinoma, which can serve as new markers and provide new targets for the prevention and diagnosis of bladder urothelial carcinoma.
bladder cancer; bladder urothelial carcinoma; stromal cells; alpha-1-antitrypsin(A1AT);myosin-10 (MYH10); immunohistochemistry
2015-01-26
2015-03-19
王新生,教授.E-mail:wangxs@qyfy.cn
成重峰(1987-),男(汉族),硕士在读.研究方向:泌尿系肿瘤.E-mail:ccf20121008@126.com
R737.14
A
10.3969/j.issn.1009-8291.2015.06.010
