竞争性ELISA、HPLC测定清燥救肺汤中甘草酸的含量
2015-06-24吴振起王思源南春红
吴振起,王思源,平 静,于 艳,南春红
(1.辽宁中医药大学附属医院儿科,沈阳110032;2.辽宁中医药大学附属医院中药实验室,沈阳110032)
竞争性ELISA、HPLC测定清燥救肺汤中甘草酸的含量
吴振起1,王思源1,平 静1,于 艳2,南春红1
(1.辽宁中医药大学附属医院儿科,沈阳110032;2.辽宁中医药大学附属医院中药实验室,沈阳110032)
目的 建立清燥救肺汤中甘草酸(GA)快速灵敏的免疫分析检测方法。方法 以制备出的甘草酸特异性单克隆抗体为基础,选择单抗最佳工作浓度,建立GA间接竞争酶联免疫分析方法(ELISA),并应用此方法检测清燥救肺汤中的GA含量。同时结合高效液相色谱法(HPLC)进行比较确证。结果 ELISA测定清燥救肺汤中成分GA在0.312 5~10 μg/mL(r=0.996 9)范围内线性关系良好,平均回收率不低于92.5%;3批样品中GA含量均值为10.125 mg/g,与HPLC测定结果相近,RSD<1%。结论 ELISA对中药成分测定准确可靠,重复性好,是HPLC测定有益的技术补充。
清燥救肺汤;甘草酸;ELISA;HPLC;含量测定
清燥救肺汤是治疗燥热伤肺的经典名方,首见于《医门法律》,为清代医家喻嘉言创制,由桑叶、石膏、甘草等中药组成。清燥救肺汤在临床上广泛应用,然而目前尚缺乏质量控制的方法。现代研究[1-2]表明,甘草酸(GA)具有抗肿瘤、抗炎、抗病毒、增强免疫功能等作用,是清燥救肺汤中主要的活性成分之一,可作为其质量控制、作用机制等研究的对象。目前,对于甘草酸的含量测定主要采用HPLC[3-4]、毛细管电泳法[5]、液相色谱-串联质谱法[6]等,尤以HPLC最为常用。中药复方活性成分复杂,应用高效液相色谱法测定活性成分存在前处理繁琐、耗时等困难。随着酶联免疫分析法(Enzyme-Linked Immunosorbent Assay,ELISA)的发展,应用ELISA可快速处理样品、灵敏度高、对大量样品可同时检测[7],在科学研究、生物制品生产中开始被应用[8]。因此本实验拟建立快速检测甘草酸的ELISA方法,并进行HPLC、ELISA同时测定清燥救肺汤中甘草酸含量的比较研究,进一步对免疫分析技术在活性成分测定的可行和可信性进行确证。
1 材料
清燥救肺汤中各饮片,购自辽宁中医药大学附属医院;甘草酸对照品(批号110731-200614),由中国药品生物制品检定所提供;抗GA单克隆抗体(GAMAb)、GA-人工抗原(GA-HSA),由日本长崎国际大学药学院正山征洋教授惠赠;标记用羊抗鼠酶标抗体(Pierce,美国);ABTS显色剂(日本和光纯药工业株式会社)。磷酸盐、甲醇等均为国产分析纯,96孔酶标板(Corning,美国)。电热恒温培养箱(上海精宏实验设备有限公司),酶标仪(bio-rad,美国)。
2 方法
2.1 供试品的制备 清燥救肺汤(桑叶、枇杷叶、杏仁、麦冬、人参、甘草、胡麻仁等7味中药饮片)经70%乙醇提取,回收溶剂,减压浓缩,阿胶烊化,石膏水提另煎,并与乙醇浓缩液合并,进一步干燥得清燥救肺汤干粉。取本品粉末0.5 g,精密称定,置具塞锥形瓶中,精密加入甲醇10 mL,超声处理,每次15 min。以4 000 r/min离心10 min,取上清液;甲醇重复提取5次,合并所得溶液,氮气吹干。以1 mL甲醇溶解残余物,测定前经0.45 μm滤膜过滤。
2.2 GA-MAb最佳工作浓度的确定 GA-MAb以TPBS分别稀释为1∶1 000,1∶3 000,1∶6 000之后,于已预先包被并封闭好的酶标板中,每孔加入100 μL。采用常规间接ELISA法测定。
2.3 竞争性ELISA法的建立 采用碳酸缓冲液(50 mol/L)稀释GA-HSA(1∶1 000),加入96孔酶标板中,每孔100 μL,37℃恒温1 h,PBS清洗5次。封闭∶每孔加入300 μL封闭液,37℃孵育1 h,PBS清洗5次。加样∶以10%甲醇分别将待测样品与GA-MAb混合(1∶1),加入酶标板的测定孔中;阳性对照孔加入GA-MAb与10%甲醇的混合液(1∶1);空白孔为100 μL 10%甲醇。混合振荡1 min,37℃培养箱中孵育l h。加酶标二抗∶加入TPBS稀释的二抗羊抗小鼠IgG(1∶1 000),每孔100 μL,温育30 min,PBS清洗5次;显色∶ABTS显色20 min,450 nm处测定吸光度A值。
2.4 方法学验证
2.4.1 线性试验 取不同质量浓度(0.312 5、0.625、1.25、2.5、5、10 μg/mL)的GA溶液,按照“2.3”项下测定。以GA质量浓度的对数(X)为横坐标,其对应的吸光度(A/A0)为纵坐标,绘制标准曲线(见图1)。
2.4.2 精密度试验 取3个不同质量浓度的GA对照品溶液(1、4、8 μg/mL),按照“2.3”项下测定,每个浓度3个复孔。本实验连续测定3 d,并重复3次实验,测定日内精密度和日间精密度。
2.4.3 回收率试验 精密吸取甘草酸溶液(4 μg/mL)3分,分别加入等体积甘草酸对照品溶液(1、4、8 μg/mL),按照“2.3”项下测定,每个浓度平行测定3次。
2.5 含量测定 ELISA分析方法∶将清燥救肺汤供试品稀释成100、200、400、800、1 600倍。参照2.2方法,选定清燥救肺汤的最佳稀释浓度为1∶800。将3批稀释度为1∶800的供试品,参照“2.3”方法测定,计算GA平均值。
HPLC分析方法,色谱柱:PhenomsilC18(250 mm×4.6 mm,5 μm);流动相:乙腈-0.1%磷酸水溶液(32∶68),检测波长254 nm,柱温∶30℃;进样量∶20 μL。
2.6 GA-Mab特异性的测定 将类似物(脱氧胆酸、甘草次酸3-O-β-D-葡萄糖醛酸、熊果酸、齐墩果酸),等比稀释液替代甘草酸稀释液,其他条件相同,测定其与GA-MAb之间的交叉反应。以50%抑制的甘草酸浓度与50%抑制的类似物浓度的百分比为其交叉反应率[8],反应抗单克隆抗体的特异性。交叉反应率(%)=(GA标准品的IC50/类似物IC50)×100%
3 结果
3.1 GA-MAb最佳工作浓度的确定 结果测得由3个Anti-GC MAb的A450值分别为1.358、0.887、0.443。有报道[9],酶标仪测定A值的敏感范围在1.00左右,为保证测定结果灵敏可靠,抗体稀释比可选择1∶3 000。
3.2 方法学验证
3.2.1 线性关系 实验显示,采用对照品拟合出的GA ELISA标准曲线(见图1),回归方程为Y=1.436 5-0.566 ln(X),r=0.996 9。表明GA在0.312 5~10 μg/mL范围内线性关系良好。

表1 间接竞争ELISA法测定不同浓度梯度的GA标准溶液的精密度(n =3)
3.2.2 精密度、回收率 对3次平行测定显示,日内精密度RSD为0.56%~1.25%,日间精密度RSD为0.78%~3.47%,见表1。GA的回收率结果表明低、中、高单个剂量的GA的加样回收率不低于92.5%。以上验证结果说明实验方法和数据科学有效。
3.3 含量测定 清燥救肺汤进行800倍稀释后,竞争ELISA测定,在450 nm波长处测得吸收值为0.493,计算甘草酸含量为6.315 μg/mL,则未稀释原样品中甘草酸含量为5.052 mg/mL,折合成生药中含量为10.125 mg/g。HPLC条件,甘草酸与杂质峰可完全分离,空白样品无干扰(见图2~图3)。GA出峰时间约在24 min,标准曲线为Y=700.589C+0.756,r=0.999 7。测定的平均含量为10.897 mg/g。2种方法比较,相对误差为0.55%,结果差异小,可以互为比照、参考。含量见表2。
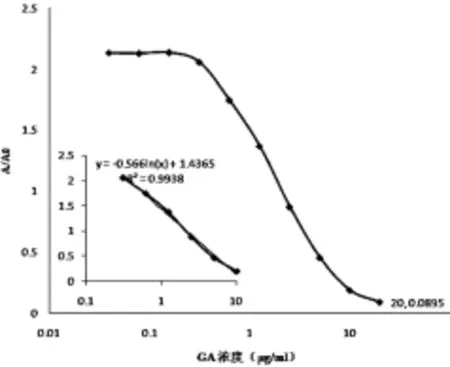
图1 GA测定用的ELISA 标准曲线
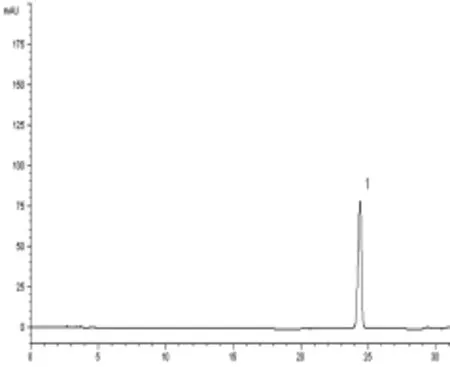
图2 清燥救肺汤中GA标准品HPLC色谱图(1∶GA)
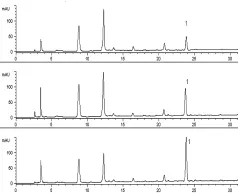
图3 清燥救肺汤样品HPLC色谱图(1∶GA)

表2 GA提取物的ELISA和HPLC检测结果(n=3)mg/g
3.4 GA-Mab特异性的测定 结果见表3。GA-MAb与甘草次酸有一定的交叉反应,而与其他几种化合物的交叉反应极小,推测GA是由甘草次酸和两分子的葡萄糖醛酸构成的,属于苷与苷元的关系,结构比较相近。

表3 GA-MAb与GA 结构类似化合物的交差反应性
4 小结
目前对中药的检测大部分是通过色谱来分析,而免疫分析方法在中药活性成分分析比较少见。免疫分析方法具有特异性强、灵敏度高、检测快速等特点,已应用到中药活性成分的快速分析上[10]。
一般来说,抗原与抗体间反应具有高度特异,但某些竞争物于抗原结构相同或类似时,可能存在一定的交叉反应,因此测定化合物抗体特异性具有一定意义。本研究显示,GA单克隆抗体除了与GC存在一定的特异性反应外,与其化学结构类似物交叉反应较小。这表明抗GA的单克隆抗体具有很强的特异性,避免了ELISA中假阳性的存在。
除了抗体的因素外,免疫分析方法的建立还受抗体工作浓度等因素影响。本研究确定了GA-MAb稀释比为1∶3 000,并对间接竞争ELISA方法进行考察。结果表明,该方法的日内精密度差异0.56%~1.25%、日间精密度差异0.78%~3.47%、平均回收率不低于92.5%,均符合分析方法的要求。
本实验对3批次清燥救肺汤中GA含量的ELISA和HPLC测定结果表明,样品的检测结果接近,说明用ELISA测定GA的方法可行。与HPLC法相比,ELISA样品前处理简单,不需大型仪器设备,检测时间快。
综上,清燥救肺汤中甘草酸的免疫分析方法的建立,为中药中GA的质量控制提供检测依据,同时也可对其他中药活性成分的分析提供思路。
[1]韩瑶聃,王彬,王政雨,等.甘草酸药理作用的研究进展[J].中国新药杂志,2012,21(21):2499-2505.
[2]王兵,王亚新,赵红燕,等.甘草的主要成分及其药理作用的研究进展[J].吉林医药学院学报,2013,34(3):215-218.
[3]邓阳,丁雯雯,颜苗,等.HPLC法测定甘草制剂中甘草酸的含量[J].湖南中医杂志,2013,29(8):126-129.
[4]张振巍,张娜娜,李国庆,等.甘草流浸膏中甘草酸含量测定方法的建立[J].中国药师,2014,17(8):1419-1421.
[5]许重远,李国锋,陈志良,等.高效毛细管电泳法测定甘草酸栓中甘草酸和甘草次酸的含量[J].中成药,2000,22(11):792-793.
[6]赵白云,朱臻宇,王彬,等.HPLC-DAD-TOF/MS法测定小柴胡汤中柴胡皂苷a、黄芩苷和甘草酸的含量[J].第二军医大学学报,2007,28(5):527-530.
[7]刘萍,陈苗苗,刘学荣,等.单克隆抗体研究进展[J].中国畜牧兽医,2012,39(1):67-70.
[8]朱学泰,马瑞军,谢溱.单克隆抗体在中草药中的研究前景[J].中草药,2005,36(6):945-947.
[9]金仁耀,吴建祥.庆大霉素单克隆抗体的研制及ELISA分析方法的建立[J].核农学报,2013,27(1):88-92.
[10]XU YU,LIU JINHUA,WANG JING,et al.A monoclonal antibody-based competitive ELISA forthe determination of ruscogenin in Chinese traditional medicines and biological samples[J].Chinese Journal of Natural Medicines,2014,12(10):794-799.
Competitive ELISA and HPLC in determination of glycyrrhizic acid in Qingzaojiufei decoction
WU Zhenqi1,WANG Siyuan1,PING Jing1,YU Yan2,Nan Chunhong1
(1.Department of Pediatrics,Affiliated Hospital of Liaoning University of Traditional Chinese Medicine,Shenyang 110032,China;2.Laboratory of Chinese Medicine,Affiliated Hospital of Liaoning University of Traditional Chinese Medicine,Shenyang 110032,China)
Objective To establish an immunoassay method for the determination of glycyrrhizic acid(GA)in Qingzaojiufei Tang.Methods Indirect competitive ELISA was developed by using anti-GA monoclonal antibody(anti-GA MAb),and then it was applied to GA measurement in the traditional Chinese medicine Qingzaojiufei Tang.Simultaneously,using analysis method of HPLC confirm.Results GA had good linearity in the ranges of 0.312 5~10 μg/mL(r=0.996 9),the average recoveries not less than 92.5%,respectively.The average content of GA in three sample was 10.125 mg/g by using ELISA.The RSD of GA determinations between ELISA and HPLC less than 1%,showed a high similarity.Conclusion The developed ELISA method is accurate with high repeatability,which is helpful to provides useful technical supplement for the determination of HPLC.
Qingzaojiufei decoction;glycyrrhizic acid;ELISA;HPLC;content determination
R284.2
A
2095-6258(2015)03-0478-04
��辑:张海洋
2014-11-17)
10.13463/j.cnki.cczyy.2015.03.014
国家自然科学基金面上项目(81373687);辽宁省教育厅优秀人才基金(LJQ2011102);沈阳市科技基金(F11-264-1-62)。
吴振起(1974-),男,医学博士,副主任医师,主要从事中医药防治感染性疾病研究。
