肱骨近端肿瘤关节内切除假体置换术中应用人工韧带重建肩周软组织可提高肩关节功能
2015-06-24汤小东郭卫杨荣利唐顺姬涛徐小龙
汤小东 郭卫 杨荣利 唐顺 姬涛 徐小龙
·国际肩肘之窗·
肱骨近端肿瘤关节内切除假体置换术中应用人工韧带重建肩周软组织可提高肩关节功能
汤小东 郭卫 杨荣利 唐顺 姬涛 徐小龙
目的 研究了应用合成网片进行肩关节重建的患者与不应用合成网片进行重建的患者相比,是否具有:(1)更好的肩关节功能;(2)更高的关节活动度;(3)更好的关节稳定性。方法 选取5年间进行的41例关节内切除假体置换术的肱骨近端恶性肿瘤患者。入组患者符合明确的入组标准。12例患者(29%)在24个月内失访,29例患者纳入最终研究,平均随访45个月(24~70个月)。在该回顾性研究中,14例患者应用合成网片进行软组织重建,15例患者未应用合成网片进行软组织重建。在术前医生与患者谈话时,详细告知患者应用合成网片与不应用网片各自的利弊,由患者决定是否应用合成网片。在应用合成网片的患者组中,我们选取肿瘤型条带(LARS韧带),并将其缠绕在肱骨近端假体周围以便进行软组织重建。研究终点包括MSTS评分(musculoskeletal tumor society)、ASES评分(American shoulder and elbow surgeons)、肩关节活动度(ROM)、肱骨假体近端移位程度。结果 未应用合成网片进行重建的患者平均MSTS评分为(20±3)分,而应用网片的患者平均MSTS评分为(24±2)分(P=0.001)。与不应用网片的患者相比,应用网片组的患者其平均ASES评分更高[前者为(72±1.7)分,后者为(85±1.1)分,P=0.025],日常活动的功能更好。这组患者也具有更高的肩关节主动前屈(P=0.020)、外展(P<0.001)及外旋(P<0.001)活动度。在未应用合成网片的15例患者中,有5例患者出现了假体近端移位。而在应用合成网片的患者中,未见到有假体移位的患者(P=0.042)。结论 与不应用合成网片的患者相比较,应用合成网片进行韧带重建的肱骨近端关节内切除假体置换的患者具有更好的术后肩关节功能、肩关节活动度,并且术后肩关节稳定性也更优。
肱骨近端;关节内切除;骨肿瘤;LARS韧带;肩袖
肱骨近端是恶性骨肿瘤的好发部位。目前,保肢手术的应用可以局部控制肿瘤并保存肢体的功能,尤其对于上肢更为重要。目前上肢保肢手术关节重建的方式有很多,如关节融合、异体骨关节移植、假体置换、异体骨——假体复合重建以及一些其他的重建方式[1-6]。在这些重建方式中,目前应用最为广泛的是假体置换,其优点包括:假体容易获得、并发症发生率相对较低、内置物存活率高以及与其他重建方式相当的术后功能水平[7-8]。然而,由于难以将肩袖及肌腱牢固固定于假体上,肱骨近端假体置换术后常常出现肩关节活动度明显受限,并可出现肩关节不稳及脱位[2,5,7,9]。
在一些关于肩关节软组织重建的报道中,为解决上述问题,研究者使用合成网片缠绕在假体周围以便于重建肌腱[8,10-13]。然而,关于该方法是否具有优越性,这些报道却不尽相同。尽管有些研究显示应用该方法后肩关节功能性运动弧度恢复且未出现假体脱位的情况[10-12],另外一些研究[8,13]却显示该方法没有明显的优点。造成这些差异的原因可能是其研究的对象具有异质性。总的说来,这些研究未能控制某些变量,如截骨长度,腋神经、三角肌、肩袖肌群功能是否存在等,它们对肩关节的功能具有很大的影响[2,11,14]。因此,我们选取了腋神经功能以及至少部分三角肌功能得到保留的患者入组,评估肱骨近端肿瘤关节内整块切除、假体置换术中,应用合成网片进行软组织(肩袖)重建的效果。具体的说,我们试图评估这些患者与假体置换后不应用补片重建软组织的患者相比,是否具有:(1)更好的肩关节功能;(2)更高的关节活动度;(3)更好的关节稳定性。
资 料 与 方 法
在取得我院审查委员会批准后,我们选取2008年1月至2012年12月在我中心进行保肢手术的98例肩胛带恶性肿瘤患者进行了回顾性研究,收集其病历资料(病史、详细的手术记录)、病理切片、影像学资料、随访信息。患者分为两组:35例患者接受了合成网片进行软组织重建,63例患者未接受合成网片重建软组织。入组的患者符合如下标准(表1):(1)14~70岁;(2)患有侵犯肱骨近端的恶性肿瘤;(3)接受肿瘤的关节内整块切除,肩胛盂完好,三角肌功能健全;(4)主要神经束未受损伤;(5)以肿瘤型假体进行骨重建;(6)无局部复发。为便于比较,我们剔除了明显会影响功能的一些因素,比如局部复发。同样,我们还剔除了如下类型患者:(1)接受关节外切除或者全肱骨切除;(2)由于腋神经和/或超过50%的三角肌被切除而导致肩外展功能受损[4];(3)接受翻修手术。经过筛选,41例患者符合条件入组,其中12例患者(29%)在24个月内失访。故最终回顾29例患者,平均随访期45个月(24~70个月)。根据软组织重建方式,该29例患者被分为两组:14例患者接受合成网片进行重建;15例患者未接受合成网片进行重建。
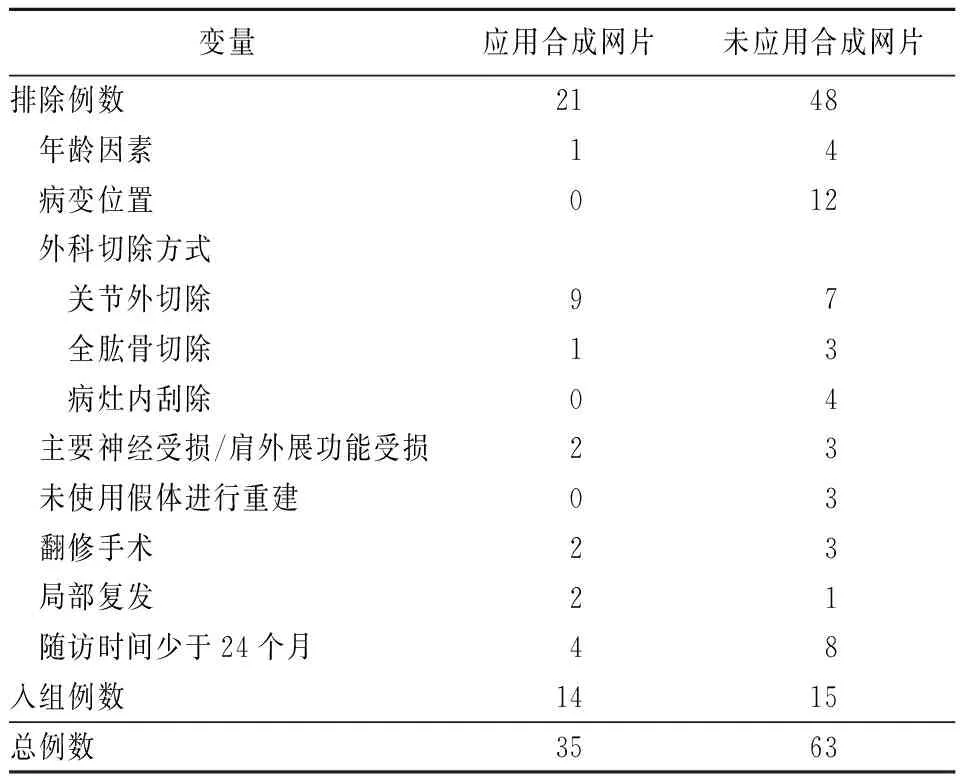
表1 入组及排除标准(例)
在接受合成网片进行重建的14例患者中,男性9例,女性5例,平均年龄33岁(15~66岁)。这些患者原发疾病分别为:8例骨肉瘤、2例软骨肉瘤、2例孤立性浆细胞瘤、1例多形性未分化肉瘤、1例为肾细胞癌单发转移(图1)。未接受人工补片进行重建的15例患者中,男性11例,女性4例,平均年龄28岁(14~58岁),其原发病分别为:9例骨肉瘤、3例软骨肉瘤、1例巨细胞瘤、1例孤立性浆细胞瘤、1例为肾细胞癌单发转移。所有诊断为骨肉瘤的患者均接受化疗(2周期术前化疗及4周期术后化疗,方案为阿霉素、顺铂、甲氨蝶呤、异环磷酰胺四药序贯化疗)。两组患者均未接受放疗。
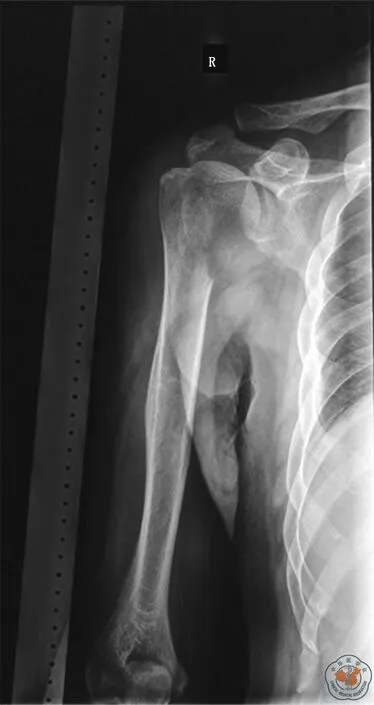
图1 肾癌骨转移患者术前肩关节平片可见肱骨近端骨质破坏
在术前,术者建议所有患者在肿瘤切除假体置换后接受合成网片进行软组织重建。同时也告知患者,无法确定应用合成网片进行重建后肩关节功能及稳定性是否能得到提升,且额外的重建过程如合成网片的应用可能会延长手术时间、增加出血量、导致不可预知的并发症。为了尽可能减少医师对结果的影响,所有的主治医师均不知道将会进行该研究。最终是否应用合成网片进行重建由患者及其主治医师共同商讨决定。
为了最大程度保证手术的安全外科边界,手术的肿瘤显露切除部分与随后的软组织重建部分由不同的医师完成。两位高年资外科医师负责肿瘤切除,并决定哪些组织结构可被保留。在本项研究中,所有的患者均接受了肱骨近端肿瘤的关节外整块切除。手术的外科边界满意,同时保留了肩关节盂及腋神经的完整性,并尽可能多的保留三角肌。应用传统的保肢技术,肱骨近端肿瘤切除后使用水泥型组配式假体(中国北京春丽公司)进行置换。在肿瘤切除后,重建部分由另外一名医师实施。在未接受合成网片进行重建的患者,残存的肩袖肌腱由不可吸收缝线缝合固定于假体的头部。在应用合成网片进行软组织重建的患者,我们应用一种韧带增强重建系统(laboratoire d′application et de recherche scientifique,arc-sur-tille,france,LARS)肿瘤型条带,该条带为6 cm×40 cm的工业级别强度的涤纶纤维条带。术中,我们将该条带以不可吸收缝线紧密缝合于假体上,同时,将条带螺旋式的包绕在假体上。当假体以水泥牢固固定于肱骨残端髓腔以后,我们用非可吸收缝线将人工韧带近肱骨头的残端沿着肩胛盂严密缝合一圈,将其固定于残存的肩关节囊上或者肩胛盂上,以期重建关节囊。假体的肱骨头被固定于人工关节囊内。并且按照解剖关系将肩袖及残存的三角肌、背阔肌、胸大肌、肱二头肌长头腱重建于包绕人工韧带的假体的相应位置上(图2)。
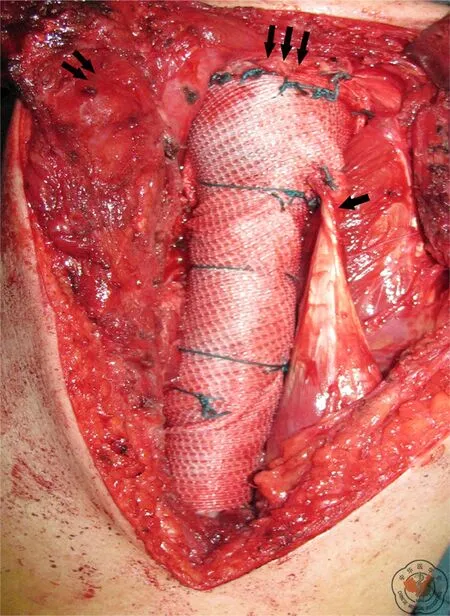
注:单箭头示肱二头肌长头腱;双箭头示三角肌;三箭头示肩袖肌腱图2 术中将LARS韧带缠绕在假体周围,并将肌肉残端缝合于LARS韧带上
切除的标本的外科边界由一名经验丰富的病理科医师来评估。所有患者均接受标准的术后康复训练流程:术后,患者戴肩制动支具3周,同时进行钟摆运动;3周后,改用上肢吊带,并开始进行仰卧位主动助力活动度训练;6周后逐渐开始主动运动。
所有患者每隔3个月由1名医师进行临床及影像学随访,该医师不知道患者采取何种重建方式。对于这两组的所有患者,肱骨截骨长度、手术时间、失血量、并发症、局部复发、远处转移及患者生存情况均有记录。在最后一次随访时测量患者的肩关节活动度,并用MSTS93上肢评分系统[15]评估患者的功能结局。该评分系统指标包括疼痛、术后功能整体评价、接受程度、手部位置、手的精细活动及上肢提物能力。为评估涉及到肩关节的日常生活活动能力(ADL),我们应用美国肩肘关外科协会评分系统(ASES)[16]。ASES评分系统满分100分,其中50分评估ADL,50分评估疼痛。我们回顾患者的肩关节及肱骨影像学检查以期发现是否有无菌性松动、内固定失败、假体近端移位的证据。肱骨近端移位,被定义为在前、后正位平片上测得肩峰肱骨间隙<5 mm,常常是肩关节不稳的表现[2]。
本研究应用卡方检验、非独立t检验、非参数Mann-Whitney检验来比较两组之间的变量。P≤0.05被认为差异具有统计学意义。所有分析均采用社会科学统计软件包进行,版本16(SPSS,公司,芝加哥,IL,USA)。该两组患者在年龄(P=0.439),性别(P=0.700),随访时间(P=0.490),肱骨截骨长度(P=0.700)以及失血量(P=0.840)方面无显著差异(表2)。由于关节稳定性被单独研究,局部复发的患者也被剔除,因而在评估并发症时,并未包括这两项因素。两组患者均未发生其他的并发症,比如:深部感染、无菌性松动或者内固定失败。只有1例未接受人工补片重建的患者出现了切口愈合不良,最终行清创术后痊愈。
结 果
与不应用网片进行重建的患者相比,应用网片进行重建的患者具有更好的功能评分:前者平均MSTS上肢评分为(20±3)分(68%),后者平均MSTS上肢评分为(24±2)分(79%)(P=0.001,表2)。根据现有数据,两组患者在“疼痛”、“手的精细活动”指标方面无明显差异。与未应用网片的患者相比,应用网片的患者组在以下评价指标方面具有更高的平均得分:术后功能整体评价(P<0.001)、接受程度(P=0.001)、上肢提物能力(P=0.042)。在手部位置方面,两组患者无明显差异(P=0.057)。在ASES评分方面,应用合成网片重建组与未应用合成网片重建组相比,其总得分更高(P=0.025)。应用合成网片重建组的患者具有更好的日常生活活动能力(ADL)(图3),包括:“穿衣服”(P=0.006),“洗后背/后背系胸罩”(P=0.000),“上厕所”(P=0.014),“梳头”(P=0.006),“伸手够高处”(P=0.002),“进行日常工作”(P=0.008),“进行日常体育运动”(P=0.029)。应用合成网片重建组中,有7例患者(50%)进行日常工作时无任何困难。然而,两组患者在ADL的如下方面无明显差异:“睡眠时压着患侧或疼痛侧”(P=0.070)、“抬举10磅重物过肩”(P=0.477)、“抛球”(P=0.093)。
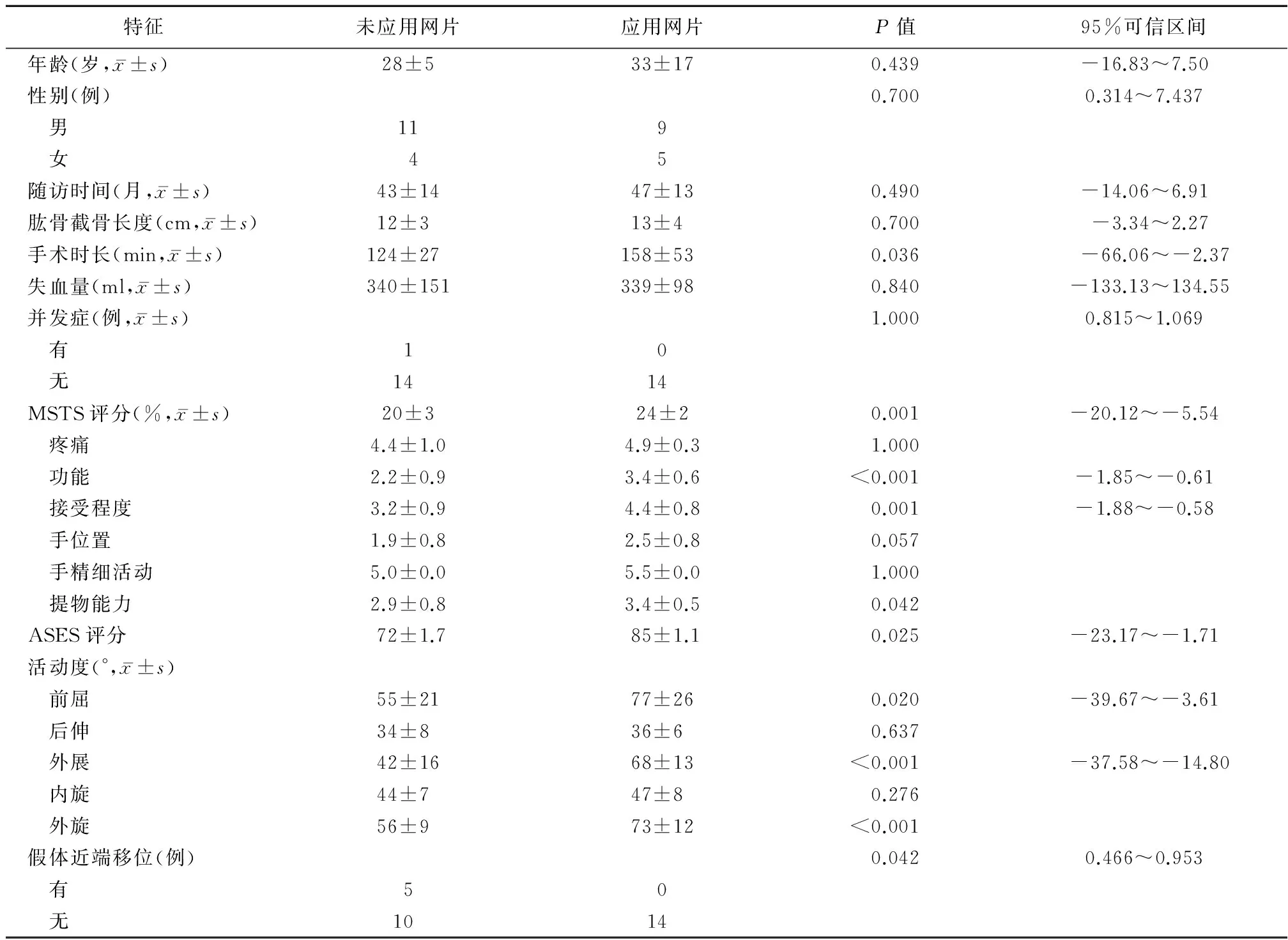
表2 应用合成网片重建的患者与未应用网片的患者组之间的对比
应用合成网片重建的患者,肩关节在大多数方向上的活动度较未应用合成网片的患者有所提高(表2,图4)。前者在前屈(P=0.020)、外展(P<0.001)以及外旋(P<0.001)方面较后者有更高的活动度。在未应用合成网片进行重建的患者中,有1/3(5例)的患者出现肱骨假体近端移位,其中两例患者并发假体前脱位。而在应用合成网片进行重建组中,所有患者术后肩关节稳定(图5),无近端移位发生(P=0.042)。

注:A为穿衣服;B为睡眠时压到患侧;C为洗后背;D为上厕所;E为梳头;F为伸手够高处;G为抬举10磅重物过肩;H为抛球;I为进行日常工作;J为进行日常体育活动图3 应用合成网片组与未应用合成网片组患者ADL不同项目评分的绝对值及相关P值

图4 应用合成网片进行重建的患者肩关节主动活动度良好。术后3个月,肩关节外展功能有明显的部分恢复(A),在术后12个月,肩关节活动度在外展(B)、前屈(C)、上举(D)方向上几乎完全恢复正常
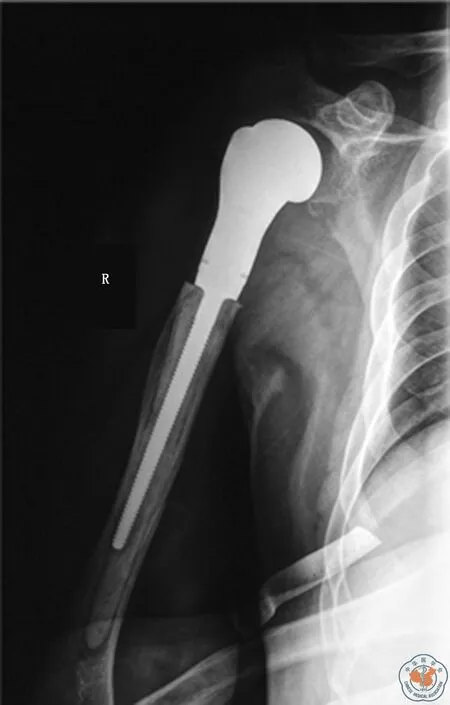
图5 术后12个月X线片提示应用合成网片进行重建后肩关节稳定
讨 论
假体置换是常用的肱骨近端肿瘤保肢方案,有些报道指出,假体置换具有并发症低、假体存活率高等优点[7-8]。尽管假体通常可为手及肘关节的活动提供良好的支撑,然而假体置换术后,肩关节功能常常受限,导致主动活动度差,并引起肩关节不稳定。有关肱骨近端肿瘤切除假体置换术中,应用合成网片进行软组织重建是否能够得到更好的肩关节功能,多篇文献报道结论不一[8,10-13]。因此,我们试图评估肱骨近端肿瘤切除、假体置换后应用合成网片重建软组织的患者与不应用合成网片的患者相比,是否具有更好的肩关节功能,更高的关节活动度以及更好的关节稳定性。我们严格限制了患者的入组标准,使两组患者具体情况相似,从而具有可比性。
由于该项研究为回顾性研究,故有一定的局限性。只有为数不多的患者符合我们严格的入组标准,并根据是否应用合成网片被分为两组。若能有更多的患者入组,我们就可能会更确信的监测出来两组间的某些细微差别。再者,我们进行了一项非随机对照研究,医师与患者为非盲,故可能会存在选择偏倚。尽管外科医师建议所有的肱骨近端假体置换的患者应该进行加强的人工韧带重建,并除了是否应用人工韧带以外,对所有的假体置换患者其余治疗方案完全相同。但是医师不可避免的劝导局部骨与软组织条件较好的患者进行更多的重建,并对这些患者给予更多的关注和医治。合成网片组中,患者自己决定使用人工韧带重建软组织可能意味着这些人主动性也更高。例如,当患者知道自己术中应用了合成网片重建软组织,可能会更加积极主动地进行术后康复及功能锻炼。随访时间较短,无法评估长期的并发症及功能结局。两组患者失访方面的差异可能会影响最终的结果。通常来说,结局不好的患者更容易失访。因此,未进行合成网片重建的患者中,失访的比例更高,也可能加强了人工韧带更有优势的结论。
在肱骨近端切除假体置换的患者中,与未进行合成网片重建者相比,应用合成网片进行重建的患者具有更好的肩关节功能。文献报道的未应用人工韧带重建的患者MSTS评分从61%~87%,平均为70%[2,7,9,17-18]。为了提高肩关节的功能,外科医师们尝试过将多种类型的人工韧带包绕在假体干周围以重建软组织,比如:MersileneTM (Johnson & Johnson′s Ethicon division,Ethicon Endo-Surgery,Inc,Cincinnati,OH,USA)[10-11],Trevira®tube (Implantcast GmbH,Buxlehude,Germany)[8,13],以及主动脉移植片[11]等。然而,这些研究中,肩关节功能的提升并不明显[8,10-11,13],其报道的MSTS评分为63.3%~79.2%。在我们的对照研究中,与未应用合成网片患者相比,应用合成网片进行重建的患者具有更高的MSTS评分(79%),尤其是在功能、接受程度、上肢提物能力方面较明显。我们研究中应用的LARS肿瘤型韧带,其功能结局要优于一些文献中报道的应用Mesh网进行软组织重建[8,13]。其可能原因是将肌肉韧带缝合固定于合成网片上的能力。我们通常将LARS肿瘤型韧带螺旋形缠绕在假体干上,同时进行紧密的固定。当术后软组织长入后,便会袖状缠绕包裹在假体周围,阻止肩袖肌肉将人工韧带向肱骨近端牵拉。然而,人工韧带能改善术后肩关节功能的前提是:肩胛盂、腋神经必须完好无损,三角肌必须功能健全。因此,如果入组标准如同本研究那样严格的话,其他有关人工韧带的研究可能会得出更好的肩关节功能的结果。
经过肩关节活动度评估,我们发现应用合成网片的患者同样具有更好的屈曲、外展、外旋主动活动度。在肱骨近端截除假体置换术后,肩关节主动活动功能通常受限。Ross等[9]研究了24例该类患者,对这些患者术中均未将软组织重建于肱骨近端假体上。术后这些患者肩关节主动屈、伸、及外展活动度均<30°。在另外一些包含有肱骨近端关节内切除及关节外切除的研究中[5,19],对假体上应用了Dacron Tape(Deknatel,Fall River,MA,USA)的患者进行肩持续静力悬吊后,可达到的最大肩外展角度为45°。此外还有一项研究中,对患者采用肱骨近端关节外切除,并保留三角肌、腋神经的完整性,术中用编织尼龙将关节囊及肩袖肌腱重建于假体之上,术后患者的主动肩关节前屈及外展活动度受限,为 40°~50°[2]。即便是应用合成网片进行重建,大量的研究指出[8,10-13],术后肩关节主动活动度明显受限,前屈角度为30°~50°,外展角度为33°~60°。在我们的研究中,将其他可能影响肩关节活动度的因素在应用及未应用人工韧带的两组患者中取得一致后,我们发现,应用合成网片进行重建的患者在几个方向上具有更好的肩关节主动活动度。
本项研究发现,应用合成网片进行软组织重建的患者未见有肩关节不稳及脱位,而不稳及脱位在肱骨近端截除假体置换术后的患者很常见。文献报道的肱骨近端截除假体置换术后不应用合成网片进行重建的患者,其肩关节不稳(包括近端移位、半脱位及脱位)的发生率为12%~54.5%[2,5,7,18,20]。在本研究中,所有的患者腋神经均完好,未观察到肩关节不稳及脱位的发生。然而,在未接受合成网片重建的患者中,有1/3的患者(5/15)出现了假体近端移位,这与文献中报道的发生率相当[2,7]。有关于在肱骨近端假体周围应用合成网片对术后肩关节稳定性的影响,不同的研究其结果截然不同。在同一中心的两项研究中[10-11],均采用MersileneTM韧带来固定假体头部,避免半脱位,研究者指出,绝大多数的患者均出现了不同程度的半脱位情况。在另外两项采用Trevira®韧带缠绕在假体近端周围的研究中[8,13],半脱位的发生率分别43.6%及42%。但是这些研究中,很少有患者出现需要翻修手术的脱位。目前国际上报道过的术后肩关节功能最好的肱骨近端假体置换术出自于Marulanda等的研究[12],在该项研究中,16例患者肱骨近端切除置换假体后,应用aortograft韧带进行重建,只有1例患者出现临床及影像学上的假体向前半脱位而需要进行翻修手术。本项研究中,平均随访时间40个月以上,在应用合成网片进行重建的患者组内未观察到有假体近端移位的发生。我们相信,在该类患者中应用合成网片重建后,可以给患者提供更加稳定的肩关节,这对于术后早期功能锻炼及保存参与肌肉的功能来说至关重要。
我们的研究结果表明,对于肱骨近端肿瘤行肱骨近端关节内切除,假体置换的患者,若其腋神经、肩袖肌群、三角肌功能健全,且选择应用合成网片进行软组织重建,则其术后的肩关节功能、肩关节主动活动度、肩关节稳定性要优于未应用合成韧带进行重建的患者。这种功能结局的不同可能是由于合成网片内的软组织长入、患者的主动依从性、手术技巧或者这些因素综合所致。根据我们的研究结果,现在我们对于肩胛盂、腋神经、三角肌、肩袖肌群功能健全的肱骨近端肿瘤患者,已常规应用合成网片进行软组织重建。
[1] Abdeen A,Hoang BH,Athanasian EA,et al.Allograft-prosthesis composite Reconstruction of the proximal part of the humerus:functional outcome and survivorship[J].J Bone Joint Surg Am,2009,91(10):2406-2415.
[2] Cannon CP,Paraliticci GU,Lin PP,et al.Functional outcome following endoprosthetic Reconstruction of the proximal humerus[J].J Shoulder Elbow Surg,2009,18(5):705-710.
[3] DeGroot H,Donati D,Di Liddo M,et al.The use of cement in osteoarticular allografts for proximal humeral bone tumors[J].Clin Orthop Relat Res,2004,427(1):190-197.
[4] Fuchs B,O′Connor MI,Padgett DJ,et al.Arthrodesis of the shoulder after tumor resection[J].Clin Orthop Relat Res,2005,436(1):202-207.
[5] Mayilvahanan N,Paraskumar M,Sivaseelam A,et al.Custom mega-prosthetic replacement for proximal humeral tumours[J].Int Orthop,2006,30(3):158-162.
[6] Wada T,Usui M,Isu K,et al.Reconstruction and limb salvage after resection for malignant bone tumour of the proximal humerus:a sling procedure using a free vascularised fibular graft[J].J Bone Joint Surg Br,1999,81(5):808-813.
[7] Potter BK,Adams SC,Pitcher JD,et al.Proximal humerus reconstructions for tumors[J].Clin Orthop Relat Res,2009,467(4):1035-1041.
[8] van de Sande MA,Dijkstra PD,Taminiau AH.Proximal humerus reconstruction after tumour resection:biological versus endoprosthetic reconstruction[J].Int Orthop,2011,35(9):1375-1380.
[9] Ross AC,Wilson JN,Scales JT.Endoprosthetic replacement of the proximal humerus[J].J Bone Joint Surg Br,1987,69(4):656-661.
[10] Ayoub KS,Fiorenza F,Grimer RJ,et al.Extensible endoprostheses of the humerus after resection of bone tumours[J].J Bone Joint Surg Br,1999,81(3):495-500.
[11] Kumar D,Grimer RJ,Abudu A,et al.Endoprosthetic replacement of the proximal humerus.Long-term results[J].J Bone Joint Surg Br,2003,85(5):717-722.
[12] German A,Marulanda MD,Eric Henderson MD,et al.Proximal and total humerus reconstruction with the use of an aortograft mesh.Clin Orthop Relat Res,2010;468(11):2896-2903.
[13] Raiss P,Kinkel S,Sauter U,et al.Replacement of the proximal humerus with MUTARS tumor endoprostheses[J].Eur J Surg Oncol,2010,36(4):371-377.
[14] Damron TA,Rock MG,O′Connor MI,et al.Functional laboratory assessment after oncologic shoulder joint resections[J].Clin Orthop Relat Res,1998,348(1):124-134.
[15] Enneking WF,Dunham W,Gebhardt MC,et al.A system for the functional evaluation of reconstructive procedures after surgical treatment of tumors of the musculoskeletal system[J].Clin Orthop Relat Res,1993,286(1):241-246.
[16] Richards RR,AN KN,Bigliani LU,et al.A standardized method for the assessment of shoulder function[J].J Shoulder Elbow Surg,1994,3(6):347-352.
[17] Malawer MM,Chou LB.Prosthetic survival and clinical results with use of large-segment replacements in the treatment of high-grade bone sarcomas[J].J Bone Joint Surg Am,1995,77(8):1154-1165.
[18] O′Connor MI,Sim FH,Chao EY.Limb salvage for neoplasms of the shoulder girdle[J].J Bone Joint Surg Am,1996,78(12):1872-1888.
[19] Wittig JC,Bickels J,Kellar-Graney KL,et al.Osteosarcoma of the proximal humerus:long-term results with limb-sparing surgery[J].Clin Orthop Relat Res,2002,397(1):156-176.
[20] Griffiths D,Gikas PD,Jowett C,et al.Proximal humeral replacement using a fixed-fulcrum endoprosthesis[J].J Bone Joint Surg Br,2011,93(3):399-403.
说明:《肱骨近端肿瘤关节内切除假体置换术中应用人工韧带重建肩周软组织可提高肩关节功能》于2015年1月发表于Clinical Orthopaedics and Related Research,为提高国内同行对肱骨近端肿瘤诊治的认识,经作者本人同意,我刊编辑部组织人员将原文翻译成中文刊出,以方便国内同仁阅读。
(本文编辑:刘扬)
汤小东,郭卫,杨荣利,等.肱骨近端肿瘤关节内切除假体置换术中应用人工韧带重建肩周软组织可提高肩关节功能[J/CD].中华肩肘外科电子杂志,2015,3(2):106-112.
10.3877/cma.j.issn.2095-5790.2015.02.008
100044北京大学人民医院骨与软组织肿瘤治疗中心
郭卫,Email:bonetumor@163.com
2015-04-06)
