黑尾胡蜂毒液抗菌肽的分离纯化及功能研究
2015-06-24张广求潘世甜李素娟
王 滢,张广求,屈 睿,潘世甜,李素娟
(云南民族大学 民族药资源化学国家民委-教育部重点实验室,云南 昆明 650500)
黑尾胡蜂毒液抗菌肽的分离纯化及功能研究
王 滢,张广求,屈 睿,潘世甜,李素娟
(云南民族大学 民族药资源化学国家民委-教育部重点实验室,云南 昆明 650500)
由于病原微生物对众多传统抗生素药物的耐药性问题日益突显,因此寻找新型的抗菌药物显得尤为紧迫,多肽类制剂因其具有广谱的抗菌活性,已成为克服病原微生物耐药性的潜在候选药物.从黑尾胡蜂毒液中分离并鉴定了一种具有抗菌活性的多肽,命名为VT-1.VT-1对临床致病菌均表现出广谱的抗菌活性.此外,VT-1对人红细胞显示出微弱的溶血活性.
黑尾胡蜂;毒腺;抗菌肽
生物体随时随地都面临着微生物的挑战,它们需要发展出一套有效的防御机制以抵御微生物病原体的侵袭.抗菌肽作为抵御微生物入侵的第一道防线,有极其重要的功能,尤其是没有后天免疫系统的无脊椎动物和后天免疫系统脆弱的低等脊椎动物,必须依靠主要由抗菌肽组成的先天免疫系统来抵御病原微生物的感染.特别是昆虫,它们体内没有抗体、胸腺及免疫细胞,基本依赖抗菌肽担负免疫功能.尽管抗菌多肽作为古老的天然抗微生物的物质,担负了极其重要的免疫功能,可是受到关注也还不到半个世纪.最近,由于面临着不断涌现的大量的对传统抗生素药物具有耐药性的微生物的严峻挑战,抗菌多肽才引起了世人的极大关注.抗菌多肽具有抗菌活性高、抗菌谱广等优点,同时还不易引起微生物的耐药性[1].
胡蜂是一味传统的重要动物药材,其药用已有 2 000 多年的历史[2].世界上已知的胡蜂种类有 5 000 多种,中国记载的有200余种,其中黑尾胡蜂(Vespatropica)在云南省普洱、双柏等地区多有分布,并在民族药中占有极其重要的地位,且被收录到《药用动物与动物药》、《动物本草》等众多药典中.黑尾胡蜂属昆虫纲膜翅目胡蜂科,又名双金环虎头蜂,其成虫、幼虫和蜂巢皆可入药,有杀虫、消肿、解毒的功能[3-4];外用治痈疽恶疮、溃后不敛.本文以黑尾胡蜂为研究对象,通过Sephadex G-50、RP-HPLC等技术分离纯化到一条抗菌肽,命名为VT-1,从而为黑尾胡蜂抗菌肽的深入研究奠定了一定的基础.
1 实验材料与方法
1.1 实验材料
黑尾胡蜂(Vespatropica)采自云南省普洱市,Sephadex G-50为Amersham Biosciences产品,实验用大肠杆菌(Escherichiacoli)、枯草杆菌(Bacilussubttilis)、金黄色葡萄球菌(Staphyloccusaureus)、白色念珠菌(Candidaalbicans)等菌株由本实验室保存.
1.2 实验仪器设备
上海亚荣生化仪器厂2.6 cm×100 cm层析柱、HL-2B数显恒流泵、Bs-100A自动部分收集器,Eppendorf公司5810R高速冷冻离心机,宁波莱福科技有限公司PSX智能型恒温恒湿培养箱,Ultrospec 2100 pro紫外/可见分光光度计(Amersham Bioscience公司),Waters 600-2489高效液相色谱仪,大连伊利特Hypersil C18反相柱.
1.3 方法
1.3.1 黑尾胡蜂毒液的提取
采用电刺激取毒的方法,步骤如下:用6V的直流电刺激胡蜂数秒,此时胡蜂释放毒液至1.5 mL离心管中.12 000 r·min-1离心10 min后,取上清液,-20 ℃保存备用.
1.3.2 黑尾胡蜂毒液中抗菌肽的分离纯化
以收集的上述黑尾胡蜂毒液为原料,按照下述步骤进行纯化,分离纯化的每一个步骤都进行抗菌活性跟踪检测,具体操作方法见下述:
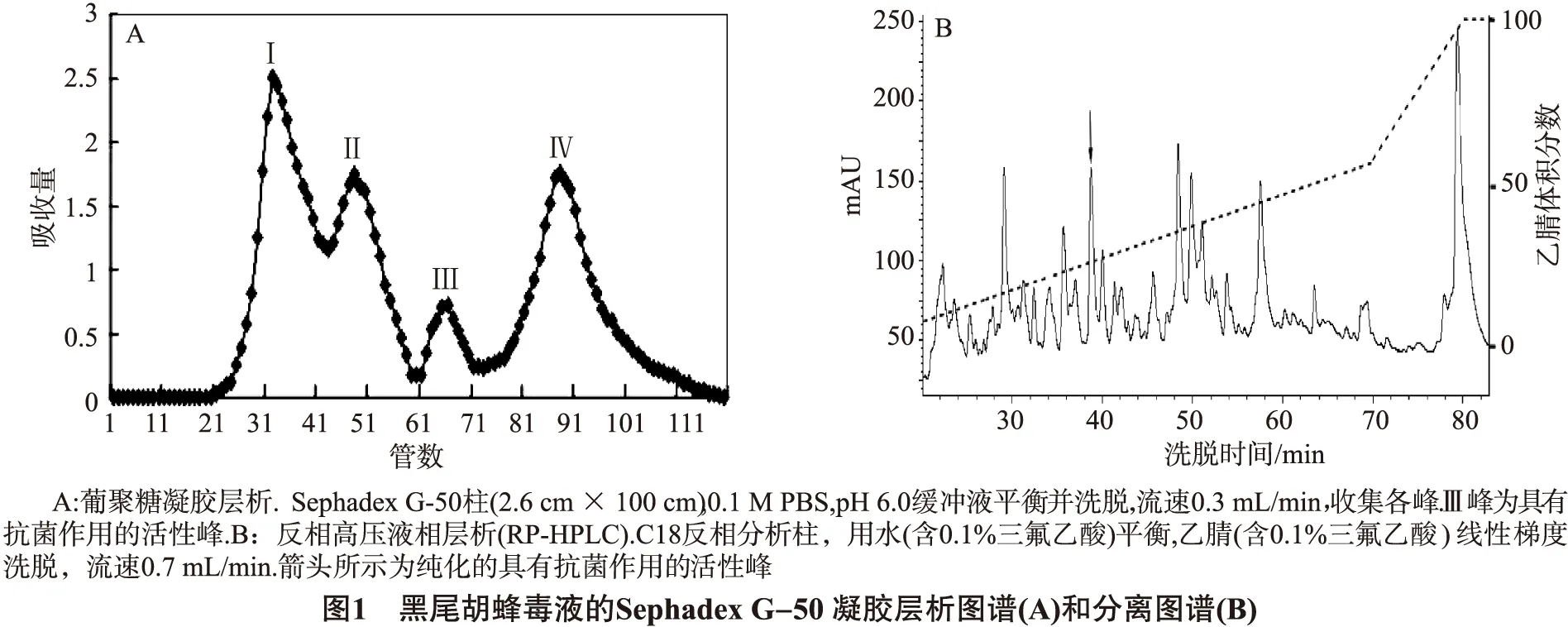
第1步,葡聚糖凝胶过滤层析Sephadex G-50: 将体腔液上清上样于已用0.1 M磷酸盐(Na2HPO4-NaH2PO4)pH 6.0缓冲液平衡好的Sephadex G-50凝胶过滤柱(superfine,100×2.6 cm,GE Healthcare),然后用同样的缓冲液进行洗脱,自动部分收集器收集,流速为0.3 mL/min,每10 min收集1管,使用Ultrospec 2100 pro紫外/可见分光光度计检测每管样品的OD280紫外吸收值,绘制峰形图,合并样品,洗脱结束后收集各峰做抗菌活性检测,冻干备用.
第2步,反相高压液相层析RP-HPLC:将Sephadex G-50凝胶过滤所得到的活性成分峰重新溶于pH 6.0,0.1 M的Na2HPO4-NaH2PO4缓冲液中,4℃,12 000 r·min-1离心15 min,取上清液后于Waters 600-2489液相色谱仪上分析.采用反相C18分析柱(Hypersil BDS C18,30×0.46 cm),以超纯水(含 0.1% 三氟乙酸)和乙腈(含0.1%三氟乙酸)构成的洗脱系统进行梯度洗脱,检测OD215紫外吸收值,流速0.7 mL/min.收集得到的各峰冷冻干燥浓缩,用灭菌的去离子水重新溶解并检测各峰的抗菌活性,活性部分冻干备用.
1.3.3 抗菌活性检测
采用抑菌圈法检测多肽的抗菌活性.在LB平板培养基中分别涂布大肠杆菌、枯草杆菌、金黄色葡萄球菌和白色念珠菌等临床致病菌,在直径为1 cm的滤纸片上分别滴加20 μL经上述分离纯化得到的多肽(分离峰),以无菌水为对照,37℃恒温培养,观察滤纸片周围是否有抑菌圈,并度量抑菌圈的大小.抗菌活性用抑菌圈直径表示(数值等于抑菌圈外径减滤纸直径).
1.3.4 溶血活性检测
根据文献已经报道的方法采用人红细胞检测纯化到的抗菌肽的溶血活性[5].简要步骤如下:用PBS缓冲液洗涤人红细胞2次,之后用PBS重悬并稀释到5%浓度的悬浮液.上述稀释好的悬浮液与不同浓度的样品在37 ℃保温30 min,再于200 r·min-1离心5 min,上清液于595 nm测吸收值.阳性对照使用Triton X-100.溶血活性与595 nm吸收值成正比.
2 结果与讨论
2.1 分离纯化
黑尾胡蜂毒液Sephadex G-50凝胶层析图谱如图1A(280 nm处吸收量)所示,分别收集到Ⅰ峰、Ⅱ峰、Ⅲ峰、Ⅳ峰共4个峰.其中Ⅲ峰用RP-HPLC(C18)进一步分离纯化,分离图谱见图1B(215 nm处吸收量),其中箭头所示的峰显示很强的抗菌活性.
2.2 一级结构分析
黑尾胡蜂经凝胶层析和RP-HPLC分离纯化后得到的抗菌活性肽用Edman降解法进行N端测序,得到其氨基酸序列为:FIPIIGKLLSGLL.经MALDI-TOF检测,得到其分子质量为 1 384.0 u,与理论计算得到的分子质量 1 383.7 u相吻合,将该抗菌活性肽命名为VT-1.
2.3 抗菌活性
VT-1对4种标准临床致病菌均表现出广谱的抗菌活性,实验结果如图2所示.
2.4 溶血活性
实验结果表明VT-1在100 μg/mL质量浓度下也不会引起人红细胞发生溶血,对人红细胞无毒性作用.

3 结语
近几十年间,越来越多的研究关注胡蜂的毒液成分.普遍认为胡蜂毒液中的活性物质主要由以下3种物质组成:1)大分子蛋白质,如各种酶类、过敏原等;2)生物活性胺,包括组胺,5-羟色胺等;3)小肽分子,包括肥大细胞脱粒肽、趋化肽等[3,6-7].研究人员已从多种胡蜂种类的毒液中纯化并鉴定得到这些小肽分子[5-6,8-13],然而,胡蜂抗菌活性方面的研究却为数不多[4,14-17].在本工作中,我们从黑尾胡蜂毒液中鉴定得到一条新的抗菌肽,并测得其成熟肽的氨基酸序列.
在全世界范围内,细菌对现今普遍使用的抗生素的耐药性已极大地威胁到人类的健康.因此,开发新型的抗菌及抗感染药物迫在眉睫.抗菌肽在自然界中广泛分布,并且已从许多不同的动物种属中纯化鉴定得到多种抗菌肽,包括脊椎动物、鱼类、两栖动物、鸟类及哺乳动物[1].综上所述,本研究可能对设计及合成新型的具有药用潜力的抗菌肽提供有效的分子模板,同时丰富我们对黑尾胡蜂毒液组分的认识.
[1] JENSSEN H,HAMILL P,HANCOCK R E W.Peptide antimicrobial agents[J].Clinical microbiology reviews,2006,19(3):491-511.
[2] AN S,CHEN L,WEI J F,et al.Purification and characterization of two new allergens from the venom of Vespa magnifica[J].PloS one,2012,7(2):e31920.
[4] CHEN W,YANG X,YANG X,et al.Antimicrobial peptides from the venoms ofVespabicolorFabricius[J].Peptides,2008,29(11):1887-1892.
[5] BIGNAMI G S.A rapid and sensitive hemolysis neutralization assay for palytoxin[J].Toxicon,1993,31(6):817-820.
[6] ARGIOLAS A,PISANO J J.Isolation and characterization of two new peptides,mastoparan C and crabrolin,from the venom of the European hornet,Vespacrabro[J].Journal of Biological Chemistry,1984,259(16):10106-10111.
[7] HABERMANN E.Bee and wasp venoms[J].Science,1972,177(4046):314-322.
[8] 平井裕子,安原義,吉田久信,等.A new mast cell degranulating peptide“mastoparan”in the venom of Vespula lewisii[J].Chemical and pharmaceutical bulletin,1979,27(8):1942-1944.
[9] HO C L,CHEN W C,LIN Y L.Structures and biological activities of new wasp venom peptides isolated from the black-bellied hornet(Vespabasalis)venom[J].Toxicon,1998,36(4):609-617.
[10] LEHRER R I,ROSENMAN M,HARWIG S S S L,et al.Ultrasensitive assays for endogenous antimicrobial polypeptides[J].Journal of immunological methods,1991,137(2):167-173.
[12] VAARA M.New approaches in peptide antibiotics[J].Current opinion in pharmacology,2009,9(5):571-576.
[13] ZASLOFF M.Magainins,a class of antimicrobial peptides from Xenopus skin: isolation,characterization of two active forms,and partial cDNA sequence of a precursor[J].Proceedings of the National Academy of Sciences,1987,84(15):5449-5453.
[14] KRISHNAKUMARI V,NAGARAJ R.Antimicrobial and hemolytic activities of crabrolin,a 13-residue peptide from the venom of the European hornet,Vespa crabro,and its analogs[J].The Journal of peptide research,1997,50(2):88-93.
[15] LIN C H,TZEN J T C,SHYU C L,et al.Structural and biological characterization of mastoparans in the venom ofVespaspecies in Taiwan[J].Peptides,2011,32(10):2027-2036.
[16] PARK N G,YAMATO Y,LEE S,et al.Interaction of mastoparan-B from venom of a hornet in taiwan with phospholipid bilayers and its antimicrobial activity[J].Biopolymers,1995,36(6):793-801.
[17] XU X,LI J,LU Q,et al.Two families of antimicrobial peptides from wasp(Vespamagnifica)venom[J].Toxicon,2006,47(2):249-253.
(责任编辑 梁志茂)
获奖简讯
2014年12月26日,教技发中心函〔2014〕139号文件公布了2013年度“中国科技论文在线优秀期刊”暨“中国科技论文在线科技期刊优秀组织单位”评选结果。云南民族大学学报自然科学版获评教育部科技发展中心“中国科技论文在线优秀期刊”二等奖。教育部科技发展中心对截至2013年12月31日已收录在“中国科技论文在线”的教育部主管的期刊,经过严格的评审评选出“中国科技论文在线优秀期刊”一等奖共79项(其中自然科学25项,工程技术22项,医药卫生9项,农业科学5项,人文社科18项);二等奖142项(其中自然科学38项,工程技术37项,医药卫生13项,农业科学18项,人文社科36项);评选出“中国科技论文在线科技期刊优秀组织单位”61个。
Purification and functions of the antimicrobial peptide from the venom gland of the social waspVespatropica
WANG Ying,ZHANG Guang-qiu,QU Rui,PAN Shi-tian,LI Su-juan
(Key Laboratory of Chemistry in Ethnic Medicinal Resources,State Ethnic Affairs Commission and Ministry of Education of China,Yunnan Minzu University,Kunming 650031,China)
Peptide agents are regarded as potential candidates for overcoming the life-threatening resistance of pathogenic microorganisms to classic antibiotics. This research has identified an antimicrobial peptide,namely VT-1 from the venom gland of the waspVespatropica, by using the combined methods of peptidomics and genomics. VT-1 has exerted a broad-spectrum antimicrobial activity against standard and clinically isolated strains of bacteria. In addition,VT-1 shows a weak hemolytic activity toward human erythrocytes.
Vespatropica; venom gland; antimicrobial peptide
2015-01-05.
国家自然科学基金(31460571);民族药资源化学国家民委-教育部重点实验室开放基金(MZY1403);云南民族大学青年基金科研项目(2013QN24);云南民族大学引进人才科研项目(2014RC005).
王滢(1984-),女,博士,讲师.主要研究方向:药用活性分子的药理药效学.
S482.2
A
1672-8513(2015)02-0119-04
