盐酸金霉素分子印迹电化学传感器的研制
2015-06-21高杨王伟刘英姿陶强万雪张娟琨
高杨 王伟 刘英姿 陶强 万雪 张娟琨
(天津市工业微生物重点实验室,教育部工业微生物重点实验室,天津科技大学生物工程学院,天津300457)
1 引言
金霉素(Chlortetracyline,CTC)属四环素类光谱抗生素的一种,可由链霉菌培养液中提取出或以半合成方法生产,能够有效抑制革兰阳性菌、阴性菌、立克次氏体等,抗菌范围较广。广泛应用于鱼类、禽畜疾病的预防与治疗,添加于饲料中能够增加禽畜日增重及饲料转化率。但由于药物滥用,残留于动物性食品中的金霉素对人体健康构成了潜在的危害[1,2]。大部分国家对动物性食品中金霉素的残留做出了严格的限定。我国国标GB/T 22990-2008 和GB/T 5009.116-2003 规定了牛奶及畜、禽肉中金霉素残留量,其中牛奶中最高限量为0.1 μg/mL。
目前,检测金霉素的常用方法包括高效液相色谱法(HPLC)[3,4]、免疫分析法[5,6]、毛细血管电泳法[7]、微生物培养法[8],其中,HPLC法虽然应用最广,检测结果精准可靠,但对样品纯度要求较高,无法满足大批量样本快速筛查的需要;免疫分析法对样品纯度要求不高,但检测结果重现性差;毛细血管电泳法分析速度快,但灵敏度低;微生物培养法适合大量样品筛选,但受抗菌活性杂质的影响不适于定量分析。
分子印迹聚合物(MIPs)具有较强的特异性的分子识别能力,且耐高温、高压及酸碱腐蚀[9],在制备不同功能的传感器方面,已得到广泛应用[10,11]。由于兼具操作简便、造价低廉、易于自动化等优势,基于电化学聚合法所制备的印迹膜传感器近年来得到迅速发展[11~13],所用的单体包括苯胺和吡咯等[14,15]。而以邻氨基酚为单体,可在不同电极表面电聚合,膜厚度可控制在10 ~100 nm,且羟基作为潜在的配位位点,可进一步提高传感器的性能[16]。本研究采用循环伏安(CV)法,以盐酸金霉素为模板分子,邻氨基酚为聚合单体,构建了测定盐酸金霉素的分子印迹敏感膜电化学传感器,与Guerreiro 等[17]制备的金霉素印迹聚合物膜离子选择性电极相比,本传感器具有更低的检测下限,操作更简便。整个过程无需衍生化处理,响应快,成本低,选择性良好,可以满足盐酸金霉素痕量分析的要求,有望在食品检测中得到更好的应用。
2 实验部分
2.1 仪器与试剂
LK2005A 型电化学工作站(天津市兰力科化学电子高技术有限公司);电化学测试采用三电极系统,玻碳电极为工作电极(GCE,Φ=4 mm),铂片电极为对电极,Ag/AgCl 电极为参比电极(天津艾达恒晟科技发展有限公司);超声波清洗机(宁波新芝生物科技股份有限公司)。
盐酸金霉素(Chlortetracycline,CTC,纯度>97%,上海生工生物工程有限公司),配制成浓度为1 × 10-3mol/L 储备液,于4 ℃避光保存,使用时逐级稀释;其它试剂均为分析纯;牛奶和鸡肉购于本地超市;实验用水均为二次蒸馏水。
2.2 玻碳电极的预处理
将玻碳电极依次用1.0,0.30 和0.05 μm 粒度的α-Al2O3抛光粉研磨抛光,而后依次用HNO3(1 +1)无水乙醇和二次蒸馏水分别超声清洗2 ~3 min,再将电极置于0.5 mol/L H2SO4溶液中用循环伏安法活化,扫描范围为-0.1 ~1.0 V,反复扫描直至得到阴、阳极峰对称且稳定的循环伏安(CV)图为止,峰峰电位差在64mV 以下,取出电极待用。
2.3 分子印迹及非分子印迹修饰电极的制备
将0.1 g 邻氨基酚(OAP)溶于0.1 mol/L HClO4中,并加入0.4 mol/L NaOH 调节至弱酸性(pH 5.5),定容至250 mL(36.7 mmol/L)。从中移取9 mL,向其中加入1 mL 0.001 mol/L 盐酸金霉素(CTC),混合均匀。通N2除O2约15min,再将三电极系统浸入到含有CTC 和OAP 的NaClO4底液中,采用CV 法扫描30 圈,扫描电位为-0.2 ~1.2 V,扫描速度为50 mV/s,在玻碳电极表面得到电聚合膜,即制得含CTC 的聚合膜电极(CTC-MIP-POAP/GCE)。将玻碳电极浸入含有10mL 甲醇-0.5 mol/L H2SO4混合溶液(1∶4,V/V)洗脱24 h,二次蒸馏水淋洗1 min,得到留有CTC 分子构型孔穴的分子印迹敏感膜(MIPPOAP/GCE)。在同样条件下,制备不加入CTC 印迹分子的非印迹膜修饰电极(POAP/GCE)。
2.4 实际样品分析
5 mL 牛奶置于50 mL 离心管,加入20 mL MCllvaine-EDTA 缓冲液及2 mL 三氯乙酸,漩涡混合2 min,在4 ℃下以4000 r/min 离心20 min,取上清液待用。称取5.00 g 切碎的肉样置于50 mL 锥形瓶中,加入5% HClO4溶液25 mL,于振荡器上振荡提取10 min,移入离心管中,以2000 r/min 离心3 min,取上清液经0.45 μm 滤膜过滤,收集滤液待用。分别取两份上清液及滤液2 mL,用PBS 分别稀释至10 mL 作为样品溶液。
3 结果与讨论
3.1 电化学制备分子印迹聚合膜
图1A 为模版分子CTC 存在下玻碳电极上OAP 电聚合过程中的CV 曲线。由CV 曲线可见,OAP的电化学聚合是一个不可逆的过程。从扫描的第二圈开始,电流便出现明显的骤降,并随着CV 扫描圈数的增多,电流缓慢下降至背景值,这表明了电极表面上逐渐覆盖并形成了致密的非导电聚合膜,阻止了OAP 的进一步氧化,使得伏安电流响应受到抑制。而图1B 为不加入CTC 的OAP 电聚合的CV 曲线,与图1A 相比并无显著差异,这表明CTC 的存在不干扰OAP 的电聚合。
3.2 分子印迹效应
采用CV 及DPV 法表征了不同电极在0.005 mol/L K3[Fe(CN)6]的磷酸盐缓冲液(PBS,pH 6.4)中的特性(图2)。由DPV 表征曲线(图2A)可知,裸电极(GCE)(曲线a)具有了较大的还原峰电流,说明探针离子[Fe(CN)6]3-在GCE 表面发生了电化学反应,从而产生了峰电流。而非印迹膜电极(POAP/GCE)(曲线d)相较于GCE,几乎没有还原峰出现,这是由于覆盖于电极上的不含CTC 的POAP/GCE 电极是非导电的,阻碍了探针[Fe(CN)6]3-的扩散传递。印迹膜电极(MIP-POAP/GCE)(曲线b)相对于POAP/GCE 而言,还原峰电流有了明显的大幅度提高,这是由于CTC-MIP-POAP/GCE 膜经洗脱后所留有的印迹孔穴为[Fe(CN)6]3-提供了传质通道,在电极表面发生了电化学反应。而洗脱再吸附CTC 的印迹膜电极(曲线c)相较于MIP-POAP/GCE 则出现峰电流值的下降,说明2 × 10-7mol/L CTC 经印迹膜所留有的孔穴,被吸附至MIP-POAP/GCE 电极上,一部分印迹孔穴被吸附上的CTC 阻塞,使得[Fe(CN)6]3-传质通道减少。CV 法与DPV 法的表征结果相符。

图1 OAP 电化学聚合的循环伏安曲线:(A)加入CTC 的OAP 的NaClO4 底液;(B)OAP 的NaClO4底液(扫速:50 mV/s,扫描次数:30)Fig.1 Cyclic voltammograms for the electrochemical polymerization of o-aminophenol (OAP)in the presence (A)and absence (B)of chlortetracyline (CTC)in sodium perchlorate aqueous solution (Scan rate:50 mV/s,cycling number:30)
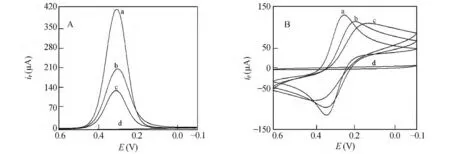
图2 不同电极在含0.005mol/L[Fe(CN)6]3-、0.1 mol/L KCl 的磷酸盐缓冲液(pH 6.4)中的差分脉冲伏安图(A)和循环伏安图(B)Fig.2 Differential pulse voltammograms (A)and cyclic voltammograms (B)of the electrodes in phosphate buffer solution of pH 6.4 containing 0.1 mol/L KCl and 0.005 mol/L K3[Fe (CN)6]
3.3 吸附时间对CTC分子印迹膜电化学响应的影响
响应时间是表征传感器性能的一个重要参数,将MIP-POAP/GCE 膜电极浸入一定浓度金霉素溶液中进行静置吸附,每隔2 min 取出,并用二次蒸馏水淋洗干净,在0.005 mol/L K3[Fe(CN)6]PBS 中用DPV 法检测。结果表明,随着吸附时间延长,峰电流逐渐下降,表明印迹位点逐渐被金霉素分子所占据,当吸附时间超过20 min 后,峰电流基本达到平衡。因此选择20 min 为最佳吸附时间。
3.4 CTC印迹膜的选择性
选择四环素、土霉素、氯霉素及青霉素作为干扰物并采用DPV 法考察MIP-POAP/GCE 膜电极对CTC 的选择性。分别测定了修饰膜印迹电极对含5 ×10-6,7.5 ×10-6,1 ×10-5,1.5 ×10-5,2 ×10-5,4×10-5和8 ×10-5mol/L 的盐酸金霉素及干扰物溶液的响应,计算相对峰电流变化率(Δi/i0),其中,Δi为MIP-POAP/GCE 膜电极对各种物质响应前后的峰电流差值,i0为印迹膜经洗脱后的峰电流值。如图3所示,氯霉素和青霉素对盐酸金霉素几乎无干扰,土霉素和四环素产生了极微弱的电流响应。这是由于氯霉素及青霉素与CTC 的结构差别较大,电化学响应信号变化极其微弱,而土霉素和四环素与CTC 的结构相似,这使得有少量土霉素及四环素能够被吸附到印迹分子修饰电极的孔穴上,从而引起微弱的电化学响应,但对CTC 并没有形成显著干扰。这说明印迹膜修饰电极与模板分子之间的作用不单是由与其互补的官能团所决定,立体结构互补所形成的印迹孔穴也有较大影响。
3.5 印迹膜电极的电化学响应及标准曲线
印迹膜传感器在含0.005 mol/L K3[Fe(CN)6]的10 mL PBS(含0.1 mol/L KCl,pH 6.4)中逐次加入等分试样20 μL 的1 ×10-5mol/L 的CTC,DPV 法进行测定(图4A)。将MIP-POAP/GCE 膜电极在空白溶液中所测得的峰电流与吸附不同浓度CTC 的CTCad-MIP-POAP/GCE 膜电极所测得的峰电流的差(ΔI),与CTC 浓度的作图,得到测定CTC 浓度的标准曲线(图4B)。CTC 在2.0 ×10-8~6.1 ×10-7mol/L 范围内与DPV 峰电流减少量呈线性关系,线性方程为y=11.19 +279.43x,R2=0.9989,CTC 的检出限为1.5 ×10-8mol/L(3σ)。
不同方法检测CTC 的结果见表1。与其它方法相比,本传感器具有更低浓度的线性范围,检出限也更低,适用于快速检测低浓度水平的盐酸金霉素。

图3 不同物质在分子印迹膜电极上的相对峰电流变化率Fig.3 Δi/i0 ratio changes of MIP sensor vs.concentration of different substances

图4 (A)不同盐酸金霉素浓度下的差分脉冲伏安图;(B)盐酸金霉素浓度与峰电流差的关系Fig.4 (A)DPV curves of MIP-POAP/GCE after adsorption in different concentrations of CTC and(B)current peak difference vs CTC concentration on MIP-POAP/GCE

表1 本方法与其它方法检测金霉素的结果比较Table 1 Comparison of detection results of CTC by this method and literature methods
3.6 印迹膜电极的重现性与稳定性
使用过的印迹膜电极在洗脱溶液甲醇-0.5 mol/L H4SO4混合溶液(1∶4,V/V)中超声清洗5 min,并用二次蒸馏水淋洗后即可使电极基本能恢复到使用前的响应值。因此使用同一支印迹膜电极对2 ×10-7mol/L CTC 平行测定5 次,RSD 为1.9%,显现出较好的重现性。将此印迹膜电极储存于4 ℃冰箱中,2 周后在相同条件下下对2 ×10-7mol/L CTC 的测定值降至初始响应的90.3%。经4 周后,响应值降至初始响应的82.7%,具有良好的长期稳定性。
3.7 样品分析
取市售的牛奶和鸡肉样品,经本方法检测均未检出CTC。向牛奶及鸡肌肉组织空白样品溶液中加入0.1,0.2 和0.5 μmol/L 的CTC,每个浓度平行测定3 次,经MIP-POAP/GCE 膜电极吸附后,置入含0.005 mol/L K3[Fe(CN)6]、0.1mol/L KCl 的PBS 中检测,测定结果如表2 所示。回收率为86.4% ~96.9%,RSD 为1.7% ~6.8%,可满足实际样品分析的需要。

表2 牛奶及鸡肉组织样品中CTC 的加标回收率Table 2 Recovery of CTC in milk and chicken muscle tissue samples
1 Fang H,Han Y L,Yin Y M,Pan X,Yu Y L.J.Chemosphere.,2014,96:51 -56
2 Alaboudi A,Basha E A,Musallam I.J.Food Control.,2013,33(1):281 -286
3 Patyra E,Kowalczyk E,Kwiatek K.J.B.Vet.I.Pulawy.,2012,56(3):329 -333
4 WANG Lei,XU Zhi-Xiu,ZHANG Xiao-Song,SHAO Xue-Guang.Chinese J.Anal.Chem.,2003,31(1):52 -54
王蕾,徐智秀,张孝松,邵学广.分析化学,2003,31(1):52 -54
5 Le T,Yi S H,Zhao Z W,Wei W.Food.Addit.Contam.,2011,28(11):1516 -1523
6 WU Yu-Xiang,LIU Zhi-Guo,HAN Zeng-Fei,ZHANG Lu,SUN Tian.J.Food Sci.,2008,29(7):348 -351
武玉香,刘志国,韩增飞,张露,孙田.食品科学,2008,29(7):348 -351
7 ZHANG Lan,LIN Zi-An,XIE Zeng-Hong.Chinese J.Analysis and Testing Technology and Instruments,2004,10(1):18-23
张兰,林子俺,谢增鸿.分析测试技术与仪器,2004,10(1):18 -23
8 LIU Xing-Quan,FENG Zhen,YAO Lei,LI Bo-Bin.Chinese J.Modern Food Science and Technology,2011,27(4):465 -467
刘兴泉,冯震,姚蕾,李博斌.现代食品科技,2011,27(4):465 -467
9 Puoci F,Iemma F,Cirillo G,Curcio M,Parisi O I,Spizzirri U G,Picci N.J.Eur.Polym.,2009,45(6):1634 -1640
10 Amut E,Fu Q,Fang Q,Liu R,Xiao A,Zeng A,Chang C.J.Polym.Res.,2010,17(3):401 -409
11 ZHANG Lian-Ming,LI Jian-Ping,PAN Hong-Cheng.Chinese J.Anal.Chem.,2012,40(7):1025 -1030
张连明,李建平,潘宏程.分析化学,2012,40(7):1025 -1030
12 Rosy,Chasta H,Goyal R N.Talanta,2014,125:167 -173
13 WANG Lin,TAN Xue-Cai,ZHAO Dan-Dan,LIU Li,LEI FU-Hou,HUANG Zai-Yin,GONG Qi.Chem.J.Chinese Universities,2012,33(8):1708 -1713
王琳,谭学才,赵丹丹,刘力,雷福厚,黄在银,龚琦.高等学校化学学报,2012,33(8):1708 -1713
14 ZHANG Jin,XU Lan,WANG Ya-Qiong,LV Rui-Hong.Chinese J.Anal.Chem.,2009,37(7):1041 -1044
张进,徐岚,王亚琼,吕瑞红.分析化学,2009,37(7):1041 -1044
15 QI Yu-Bing,LIU Ying,SONG Qi-Jun.Chinese J.Anal.Chem.,2011,39(7):1053 -1057
齐玉冰,刘瑛,宋启军.分析化学,2011,39(7):1053 -1057
16 Tucceri R,Arnal P M,Scian A N.Canadian J.Chem.,2012,91(2):91 -112
17 Guerreiro J R L,Freitas V,Sales M G F.Microchem.J.,2011,97(2):173 -181
