液相色谱-串联质谱法测定饲料原料中26种霉菌毒素
2015-06-21王瑞国苏晓鸥程芳芳王培龙樊霞张维
王瑞国 苏晓鸥 程芳芳 王培龙 樊霞 张维
(中国农业科学院农业质量标准与检测技术研究所,农业部农产品质量安全研究重点实验室,北京100081)
1 引言
霉菌毒素(Mycotoxins)是由某些霉菌在生长过程中产生的有毒次级代谢产物[1],饲料原料特别易于被各种霉菌毒素污染[2],从而对动物生产带来各种危害。目前,已经确认化学结构的霉菌毒素达400多种[3]。其中,对动物生产影响较大的主要有黄曲霉毒素、呕吐毒素、T-2 毒素和玉米赤霉烯酮等数十种,导致动物生产性能下降、繁殖力降低、疾病易感性增强和呕吐、腹泻、器官坏死等急性和慢性中毒症状[4]。世界卫生组织将霉菌毒素纳入食品安全体系重点监测内容[5],我国对食品和饲料中黄曲霉毒素B1等重要毒素规定了最高限量标准[6~10]。传统的霉菌毒素检测方法主要有薄层色谱法(TLC)、酶联免疫法(ELISA)和高效液相色谱法(HPLC)等。这些方法一般只能针对一种或一类结构类似的毒素进行快速筛选、定性或定量检测[3]。事实上,饲料原料中霉菌毒素污染通常是多种霉菌毒素的联合污染[11]。因此,开发多种霉菌毒素同步检测方法具有十分重要的现实意义。由于液相色谱-串联质谱(LC-MS/MS)法集高效分离和多组分定性与定量检测于一体,成为近年来霉菌毒素多残留检测技术的主流方向[12]。如赵孔祥等[13]建立了在线免疫亲和净化LC-MS/MS 检测中草药中10 种霉菌毒素的方法,应永飞等[14]建立了多功能净化柱LC-MS/MS 检测饲料中14 种霉菌毒素的方法。郑翠梅等[15]采用LC-TOFMS 同时测定粮食中13 种真菌毒素。但是,上述方法需要专用的前处理设备和成本较高的免疫亲和柱,或者需要样品脱脂,正离子和负离子分别检测等较为繁琐的步骤,而且同时检测霉菌毒素的数量仍然比较有限。本研究采用一种商品化的霉菌毒素多功能净化柱对样品进行一次净化和浓缩,不需要脱脂程序,并且通过优化色谱和质谱条件,实现了正、负离子同时测定,做到一次前处理和一次进样同时检测饲料原料中26 种霉菌毒素,具有操作简单、快速、成本低、定量准确的特点。
2 实验部分
2.1 仪器与试剂
超高效液相色谱-电喷雾电离源-串联质谱仪(美国Waters 公司);RVC 2-18 台式离心浓缩仪(德国CHRIST 公司);3K15 高速冷冻离心机(美国Sigma 公司);D37520 高速离心机(美国Kendro 公司);Mycospin 400 多功能净化柱(ROMER 公司);霉菌毒素空白玉米和豆粕样品由国家饲料质量监督检验中心(北京)惠赠。
标准品及由标准品配制的混合标准溶液储备液(溶剂为乙腈)浓度信息见表1。乙腈、甲醇、乙酸铵和甲酸(色谱纯,美国Fisher 公司);实验用水为Milli-Q 超纯水。混合标准溶液储备液于-20 ℃保存,使用时分别吸取适量标准储备液,经离心浓缩仪旋干后,用水-甲醇-甲酸(95∶4.9∶0.1,V/V)溶液溶解,配制成不同浓度的标准系列工作液。
2.2 样品前处理
称取5.00 g ± 0.01 g 试样于50 mL 塑料离心管中,加入20 mL 乙腈-水-甲酸(84∶15.9∶0.1,V/V)进行提取,涡旋混匀1 min,超声提取1 h,期间每20 min 振荡1 次。提取完成后,以10000 r/min 离心10 min,取1 mL 上清液于Mycospin 400 多功能净化柱中,涡旋2 min 使溶液与净化材料充分混合,打开净化柱底部出液口,置于配套收集管中,5000 r/min 离心1 min,收集滤液。将滤液置于离心浓缩仪中,60 ℃,1500 r/min 真空旋干。用0.25 mL 水-甲醇-甲酸(95∶4.9∶0.1,V/V)溶解残渣,涡旋1 min,超声5 min,13000 r/min 离心10 min,移取上清液于进样瓶中待测。
2.3 色谱和质谱条件
Acquity UPLC BEH C18色谱柱(100 mm ×2.1 mm,1.7 μm,美国Waters 公司);柱温40 ℃,流速0.42 mL/min,进样量10 μL。流动相A 为0.1%甲酸-水,流动相B 为0.1%甲酸-甲醇。梯度洗脱:0 ~2.0 min,95% A;2.0 ~4.0 min,95% ~90% A;4.0 ~12.0 min,90% ~25% A;12.0 ~12.1 min,25% ~1% A;12.1 ~14.0 min,1% A;14.0 ~14.1 min,1% ~95% A;14.1 ~16 min,95% A。

表1 霉菌毒素标准品列表Table 1 Standard compounds of 26 mycotoxins
电喷雾离子源(ESI),离子源温度为150 ℃,脱溶剂温度为450 ℃,脱溶剂气和锥孔气均为N2,脱溶剂气流速为900 L/h,锥孔气流速为20 L/h。序号1 ~20 霉菌毒素采用正离子(ESI+)监测,序号21 ~26霉菌毒素采用负离子(ESI-)监测方式,毛细管电压为0.75 kV。采用多反应监测(MRM)方式检测,监测离子、碰撞能量、锥孔电压等参数见表2。
3 结果与讨论
3.1 仪器条件优化
3.1.1 质谱条件的优化 以甲醇-水(50∶50,V/V)为流动相,采用结合(Combine)进样方式,对26 种霉菌毒素的质谱条件进行优化,在正、负离子模式下进行全扫描,选择合适的准分子离子峰和电离方式。根据化合物的响应,设置不同的扫描模式。其中,正电离模式下获得[M +H]+、[M +NH4]+或[M +Na]+,负电离模式下获得[M-H]-。结合基质空白和基质标准液的离子扫描图,进一步优化参数,确定了各种毒素在多反应监测模式(MRM)下信号采集的特征离子对及质谱条件(表2)。

表2 MRM 监测模式下26 种霉菌毒素的质谱优化条件Table 2 Optimized MS/MS parameters of 26 mycotoxins
3.1.2 色谱条件优化 考察了0.1%甲酸-水/0.1%甲酸-甲醇(A)、0.1%甲酸-水/0.1%甲酸-乙腈(B)、0.2 mmol/L 乙酸铵溶液/甲醇(C)、0.2 mmol/L 乙酸铵溶液/乙腈(D)等4 种流动相体系对26 种霉菌毒素的分离效果和峰信号强度。结果表明,26 种毒素在A 和B 流动相体系能够全部出峰,并且超过半数的霉菌毒素峰信号在A 体系中明显高于B 体系,如3-AcDON、15-AcDON、HT-2、T-2、VER 等毒素在A 体系中峰信号响应值超过B 体系下5 ~10 倍;NIV,BrERG 等在C 和D 流动相体系中不出峰或有较长拖尾。因此,本研究选择A 流动相体系。进一步研究发现,洗脱梯度的设定对目标物峰信号强度有很大影响,如OTA 和OTB 保留时间越往后,其峰面积响应值成倍增加,可能与杂质分离度或电离时的溶剂比例有关。在本实验梯度洗脱条件下,分段采集目标物峰信号,16 min 完成26 种霉菌毒素分离与检测。图1 为空白玉米加标的定量离子色谱图。
3.2 方法性能
3.2.1 基质效应评价 用水-甲醇-甲酸(95∶4.9∶0.1,V/V)配制系列梯度浓度(目标物序号3,4,5,6,7,10,11,12,13,17,19,20 为2,5,10,25和100 ng/mL;目标物序号1,2,8,9,14,15,16,18,21,22,23,24,25,26 为10,25,50,125 和500 ng/mL)混合标样,同时称取玉米和豆粕样品,按照前处理步骤进行提取、净化和分析,并对空白样品进行分析,确定不含痕量目标物后,再用空白样品进样液稀释与溶剂标样浓度相同的系列基质匹配标样,分别以标样浓度为横坐标,峰面积为纵坐标进行线性回归分析。溶剂标样和基质匹配标样的斜率和相关系数(R2)列于表3。溶剂和基质匹配标样曲线线性良好,R2均大于0.99。基质匹配与溶剂标准曲线斜率的比值可反映出基质效应的强弱。在本实验中,玉米和豆粕基质对此26 种霉菌毒素均产生了不同程度的基质抑制效应。
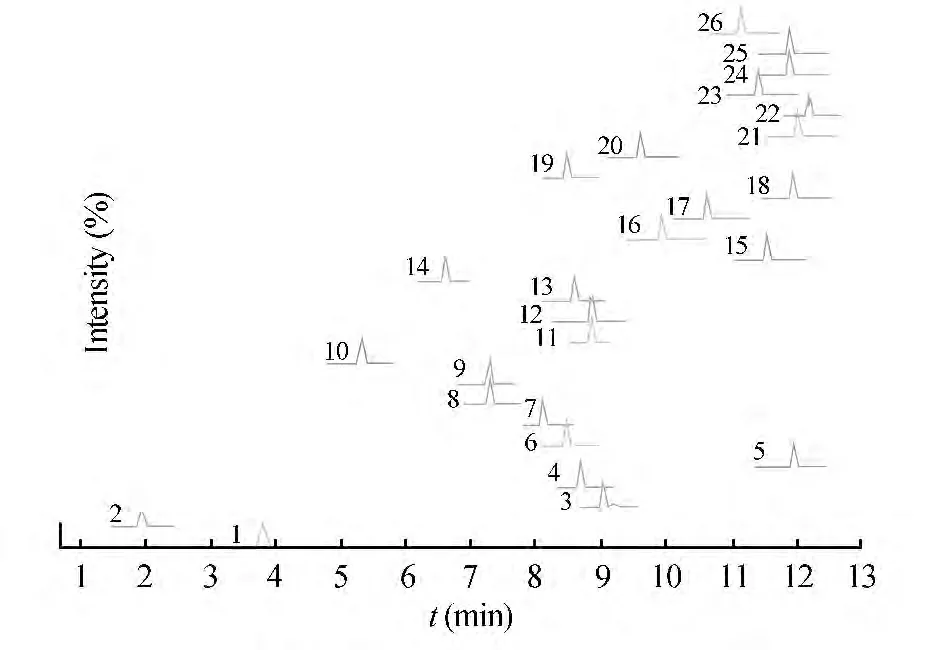
图1 空白玉米基质匹配标准溶液的定量离子色谱图(3,4,5,6,7,10,11,12,13,17,19,20 浓度为20 μg/kg,其它为100 μg/kg)Fig.1 Chromatograms of quantification transitions of blank maize matrix-matched standard (20 μg/kg for 3,4,5,6,7,10,11,12,13,17,19,20;100 μg/kg for others)

表3 溶剂和基质匹配 标准曲线的斜率和R2Table 3 Slope and R2of solvent and matrix-matched calibration curves
3.2.2 方法的线性范围与定量限 分别向玉米和豆粕空白样品提取液中添加适量混合标准溶液,按照2.2 节所述,取1 mL 经Mycospin400 净化,真空旋干,用0.25 mL 水-甲醇-甲酸(95∶4.9∶0.1,V/V)溶解,配制浓度为1 ~100 μg/kg(目标物序号为:3,4,5,6,7,10,11,12,13,17,19,20,21)和5 ~500 μg/kg(目标物序号为:1,2,8,9,14,15,16,18,22,23,24,25,26)的基质混合标准溶液。根据10 倍信噪比(S/N)确定化合物的方法定量限(LOQ),以浓度为横坐标,定量离子对峰面积为纵坐标,进行线性回归计算,所得R2均大于0.99,结果见表4。
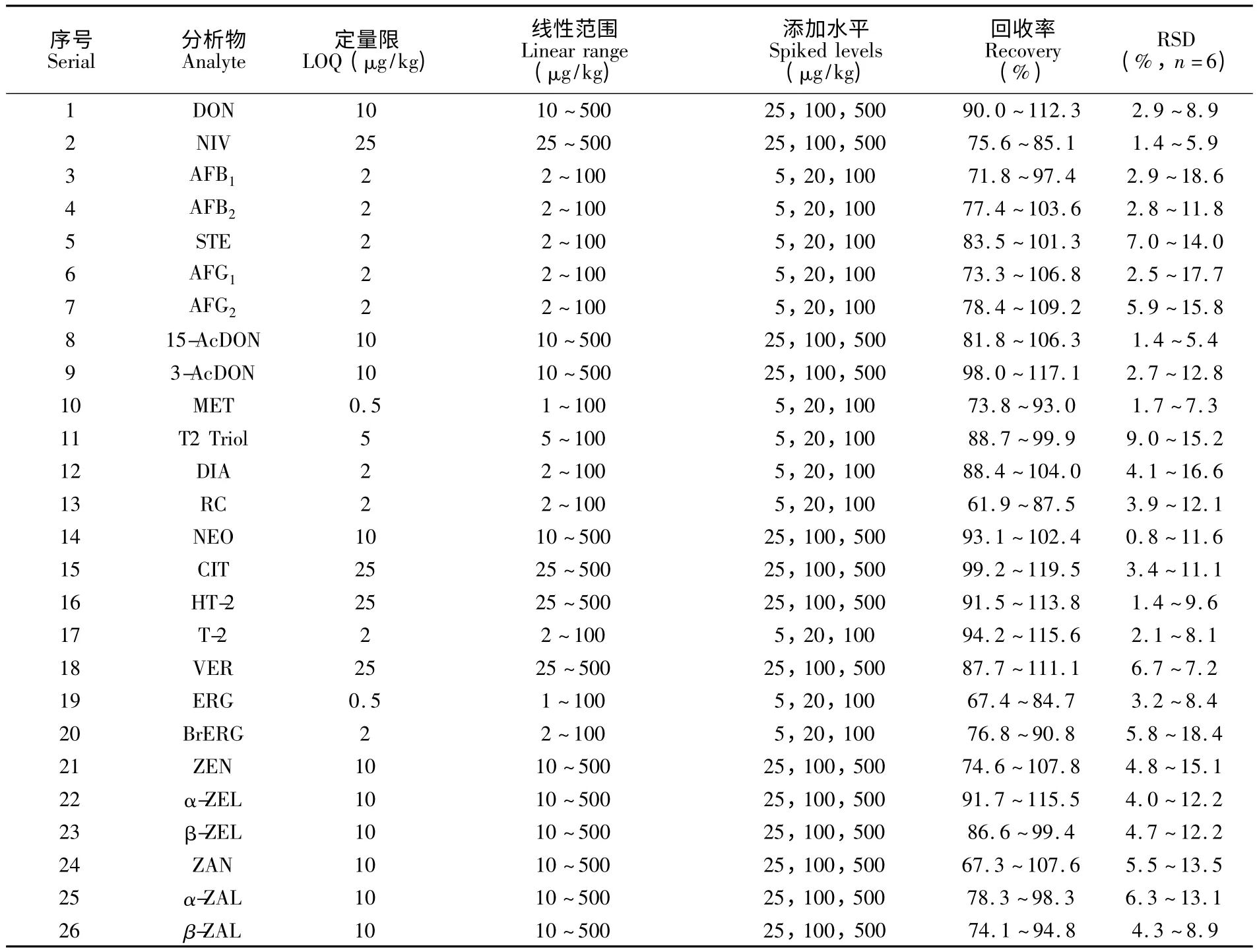
表4 玉米和豆粕基质中26 种霉菌毒素的定量限,线性范围,平均回收率及相对标准偏差等方法性能参数Table 4 Performance parameters of method such as LOQ,linear range,average recoveries and RSD of 26 target mycotoxins in maize and soybean meal
3.2.3 回收率和精密度实验 采用玉米和豆粕空白样品,进行添加回收和精密度实验。样品中添加低、中、高3 个浓度梯度的混合标准溶液,每个添加浓度设6 个平行,按本实验方法进行样品处理和上机测定,平均回收率为61.9% ~119.5%,相对标准偏差(RSD)为0.8% ~18.6%,结果见表4。
3.3 实际样品测定
应用本方法对2013 年采自东北和华北地区的76 个玉米和84 个豆粕样品中26 种霉菌毒素进行检测。对于饲料卫生标准[7~10]规定了最高限量的4 种霉菌毒素,AFB1,T-2,DON 和ZEN 在玉米样品中检出率分别为7.9%,0%,76.3%和39.5%,在豆粕样品中的检出率分别为4.8%,0%,66.7%和38.1%。其中,AFB1和ZEN 在玉米、豆粕样品中的超标率均为0。由于饲料卫生标准没有对玉米和豆粕中DON 作出限量规定,参考配合饲料中DON 最高限量1000 μg/kg,则13.1%的玉米样品和2.4%的豆粕样品中DON 含量超过1000 μg/kg。其它尚没有限量标准的霉菌毒素除ERG 未检出外,其它毒素均有不同程度的检出。
1 Cao X Q,Wu S G,Ye Y,Wang S,Wang Y T,Li T,Tian H,Xie J M,Ding H.J.Chromatogr.B,2013,942-943:113 -125
2 Binder E M,Tan L M,Chin L J,Handl J,Richard J.Anim.Feed Sci.Technol.,2007,137(3):265 -282
3 ZHENG Cui-Mei,ZHANG Yan,WANG Xue-Song,XIE Gang,ZHANG Guang-Min,LI Rui.Grain Science and Technology and Economy,2012,37(1):45 -49
郑翠梅,张艳,王雪松,谢刚,张广民,黎睿.粮食科技与经济,2012,37(1):45 -49
4 Marin S,Ramos A J,Cano-Sancho Sanchis G V.Food Chem.Toxicol.,2013,60:218 -237
5 World Health Organization.WHO global strategy for food safety:safer food for better health.20 Avenue Appia,1211 Geneva 27,Switzerland:WHO,2003
6 GB 2761-2011,Maximum Levels of Mycotoxins in Foods,2011 GB 2761-2011,
食品中真菌毒素限量.2011
7 GB 13078-2001,Hygienical Standard for Feeds.2001 GB 13078-2001,饲料卫生标准.2001
8 GB 13078.2-2006,Hygienical Standard for Feeds-Toleration of Ochratoxin A and Zearalenone in Feeds.2006 GB 13078.2-2006,
饲料卫生标准—饲料中赭曲霉毒素A 和玉米赤霉烯酮的允许量.2006
9 GB 13078.3-2007,Tolerance Limits for Deoxynivalenol in Formula Feeds,2007 GB 13078.3-2007,
配合饲料中脱氧雪腐镰刀菌烯醇的允许量.2007
10 GB 21693-2008,Tolerance Limits for T-2 Toxin in Formula Feeds,2008 GB 21693-2008,
配合饲料中T-2 毒素的允许量.2008
11 Monbaliu S,van Poucke C,Detavernier C,Dumoulin F,van de Velde M,Schoeters E,van Duck S,Averkieva O,van Peteghem C,de Saeger S.J.Agr.Food Chem.,2009,58(1):66 -71
12 Shephard G S,Berthiller F,Burdaspal P A,Crews C,Jonker M A,Krska R,Lattanzio V M T,Macdonald S,Malone R J,Maragos C,Sabino M,Solfrizzo M,Egmond H P,Whitaker T B.World Mycotoxin J.,2012,5(1):3 -30
13 ZHAO Kong-Xiang,GE Bao-Kun,CHEN Xu-Yan,XU Hong.Chinese J.Anal.Chem.,2011,39(9):1341 -1346
赵孔祥,葛宝坤,陈旭艳,许泓.分析化学,2011,39(9):1341 -1346
14 YING Yong-Fei,ZHU Cong-Ying,WEI Min-Jue,CHEN Hui-Hua,QU Jian,LU Chun-Bo,LIN Xian-Jun,LUO Cheng-Jiang.Chinese J.Anal.Chem.,2010,38(12):1759 -1764
应永飞,朱聪英,韦敏珏,陈慧华,屈键,陆春波,林仙军,罗成江.分析化学,2010,38(12):1759 -1764
15 ZHENG Cui-Mei,ZHANG Yan,WANG Song-Xue,XIE Gang,ZHANG Guang-Min.Journal of Instrumental Analysis,2012,31(4):383 -389
郑翠梅,张艳,王松雪,谢刚,张广民.分析测试学报,2012,31(4):383 -389
