快原子轰击离子化质谱研究酚类化合物抗氧化作用
2015-06-21杨芬贺玖明张瑞萍再帕尔阿不力孜
杨芬 贺玖明 张瑞萍 再帕尔·阿不力孜
1(中国医学科学院/北京协和医学院药物研究所,天然药物活性物质与功能国家重点实验室,北京100050)
2(北京肿瘤医院,北京100142)
1 引言
氧自由基与心脑血管、肿瘤及老年性疾病的发生具有密切关系[1~4],抗氧化药物在临床、保健、食品等领域被广泛应用,寻找高效、低毒的抗氧化剂备受重视。目前,检测或评价化合物抗氧化活性的常用方法有电子自旋共振法[5~7]、电化学方法[8]、色谱法[9,10]和液相色谱质谱联用法(LC-MS)[11,12]等。这些检测方法的共同点是样品处理时间长、检测及其数据处理繁琐,包括羟自由基(·OH)的产生体系以及化合物捕捉·OH 的反应,对大量样品的快速检测具有一定的局限性。因此,建立一种简便、快速检测化合物抗氧化作用强弱的新型分析方法,对加快抗氧化药物的筛选及研发具有重要意义。
快原子轰击离子化质谱(FAB-MS)方法是一种成熟的质谱技术。大多数化合物的FAB-MS 谱中主要产生[M+H]+离子,也有一些化合物产生比较强的分子离子M+·。本实验室前期探索了FAB-MS 谱中M+·的相对强度与化合物抗氧化作用强弱的相关性[13],在此基础上,本实验系统考察了实验条件对M+·相对强度的影响,建立了筛选或预测酚类化合物抗氧化作用强弱的简便、灵敏、快速的FAB-MS 检测方法,并且与常用药理活性筛选方法进行对比分析,验证了该方法的可靠性。由于FAB-MS 方法具有样品量少、无需复杂样品处理、检测时间短等特点(可直接将样品溶液与基质混合后涂于靶上测定),因此本方法的建立将有助于加快抗氧化药物的研发。
2 实验部分
2.1 仪器与试剂
AutoSpec Ultima-Tof 串联质谱仪(英国Micromass 公司);FAB 源,Cs+离子枪,加速电压8000 V,分辨率调节为1000。
甲醇(分析纯,北京化工厂);FAB-MS 谱测定使用的基质:甘油(G,分析纯,北京化工厂);间硝基苄醇(m-NBA,色谱纯,美国Sigma-Aldrich 公司);硫代甘油(TG)、二硫代苏糖醇/硫代甘油(DTT/TG 12)和1,2 二巯基甘油(BAL)均为色谱纯(日本Tokyo Kasei Kogyo 公司)。
黄酮类化合物、酚类化合物以及木脂素类化合物(中国药品生物制品检定所)。黄酮类化合物的结构式见表1。

表1 选用的黄酮类化合物及其结构Table 1 Structure of flavonoids
2.2 I(M+·)/I([M+H]+)比值的计算
I(M+·)/I([M+H]+)值表示M+·与[M +H]+离子的相对强度比值,扣除M+·峰13C 同位素对[M+H]+峰的贡献后,获得二者的相对峰强度比值。
基质为间硝基苄醇(m-NBA),样品用甲醇溶解。I(M+·)/I([M +H]+)值均采用10 ~20 次扫描时间的平均结果。采用硫代巴比妥酸法(TBA)检测化合物对脂质过氧化(LPO)的抑制率(IR)。
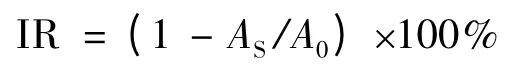
其中,AS和A0分别表示样品溶液和空白对照液的吸光度值。
3 结果与讨论
3.1 基质对I(M+·)/I([M+H]+)值的影响
选择合适的基质进行FAB-MS 谱测定是关键环节。本研究选择5 种酚类和黄酮类化合物,系统考察了基质对其I(M+·)/I([M+H]+)值的影响。由表2 可见,对于同一化合物,使用不同基质得到的I(M+·)/I([M+H]+)值不同,m-NBA 最有利于M+·离子的形成。由表3 可见,不同化合物使用相同基质得到的I(M+·)/I([M+H]+)值大小顺序保持不变。因此,该值大小虽然与基质种类有关,但主要决定于化合物自身生成M+·和[M +H]+离子的竞争能力;同时说明采用相同基质比较不同化合物的I(M+·)/I([M+H]+)值具有可行性。

表2 5 种不同基质条件下获得的3 个酚类化合物的I(M +·)/I([M+H]+)值Table 2 I(M +·)/I([M+H]+)values of three phenolic compounds with five different matrices
3.2 轰击时间对I(M+·)/I([M+H]+)值的影响
通常,FAB 条件下的离子化过程在空间上可分为凝聚相区、界面区、气密层区和高真空区4 个区域。M+·离子和[M+H]+离子都要通过气密层区进入高真空区,进而被检测分析。因此,气密层的稳定性对于M+·和[M+H]+离子的产生及其强度比较重要,本实验通过考察化合物的离子化与轰击时间的关系,寻找形成稳定气密层区的阶段。

表3 3 种不同基质条件下获得的酚类化合物的I(M +·)/I([M+H]+)值Table 3 I(M +·)/I([M+H]+)values of some phenolic compounds with three different matrices
图1 是以m-NBA 为基质测定阿魏酸的FAB-MS谱,m-NBA 的主要离子m/z 154,阿魏酸的M+·离子(m/z 194)和[M+H]+离子(m/z 195)的绝对强度随轰击时间的变化结果。可以看出,基质相关离子的强度随着扫描次数的增加迅速增强,在大约5 次扫描后达到一个比较稳定的阶段,而扫描25 次以后基质的相关离子峰强度逐渐变小。这一变化趋势反映了气密层区的形成与消逝过程,表明5 ~25 次的扫描时间内已形成稳定的气密层区。在气密层区被测样品的I(M+·)/I([M + H]+)值变化不明显。因此,选择10 ~20 次扫描结果作为判断I(M+·)/I([M+H]+)值大小的依据具有较好的可靠性。

图1 阿魏酸与m-NBA(基质)的分子离子峰M +·和准分子离子峰[M+H]+绝度强度与轰击时间的相关关系Fig.1 Relationship between absolute intensity of M +·,[M+H]+ion of ferulic acid,[M+H]+ion of matrix and scan time with m-NBA used as the matrix
3.3 样品浓度对I(M+·)/I([M+H]+)值的影响
在FAB-MS 分析的实验过程中,发现样品浓度在1 ~200 mmol/L 范围内,能得到较理想强度的分子离子和准分子离子峰。如果浓度太低,FAB-MS 谱给出的均为基质离子峰;而浓度太高,样品的相关离子峰强度可能出现过饱和。因此,本实验以木脂素类化合物为研究对象,考察了样品浓度对I(M+·)/I([M+H]+)值的影响。表4 给出了7 个木脂素类化合物在浓度分别为10 和50 mmol/L 获得的I(M+·)/I([M+H]+)值。如表4 所示,此值随其浓度大小发生变化,而不同化合物在浓度相同时,其相对顺序不变,由此可见,随着样品浓度的变化,I(M+·)/I([M+H]+)值将按一定的规律发生变化,但不影响其相对大小顺序。因此,对于同种结构类型的化合物而言,在相同浓度条件下进行FAB-MS 谱分析,获得的I(M+·)/I([M+H]+)值可以反映化合物的结构及其性质差异。

表4 不同浓度木脂素类化合物以m-NBA 为基质时获得的I(M +·)/I([M+H]+)值Table 4 I(M +·)/I([M+H]+)values of different concentration of lignanoids compounds with m-NBA used as the matrix
3.4 黄酮类化合物I(M+·)/I([M+H]+)值与其抗氧化活性的相关性
在FAB 条件下,M+·离子的产生过程与酚类抗氧化物的抗氧化作用机制存在一定相关性,二者都包含电子转移的过程,而且失去电子的难易程度与M+·离子的相对强度有关,并在一定程度上决定了抗氧化作用的强弱。大部分酚类化合物是断链型抗氧化剂,它们通过清除自由基发挥其抗氧化作用[14]。抗氧化剂与自由基发生反应生成苯氧自由基,苯氧自由基稳定性越好,表明化合物的抗氧化活性越强[14]。有利于增强苯氧自由基稳定性的结构因素主要有:酚羟基邻对位有O、N、S 等杂原子或斥电子基团的取代以及分子内氢键的形成等。这些因素同样有利于FAB 条件下M+·离子的产生,这是由于O、N 等杂原子与苯环形成p-π 共轭,共轭效应使单电子离域程度增大,则有利于形成M+·离子。因此,有利于提高苯氧自由基稳定性的结构因素,既能增强酚类化合物的抗氧化活性,也同样有利于M+·离子的产生,从而使I(M+·)/I([M +H]+)值增大。因此对于同种结构类型的酚类化合物,其FABMS 谱中若出现比较强的M+·离子,则该化合物可能具有较强的抗氧化活性,且抗氧化作用强弱与I(M+·)/I([M+H]+)值大小具有一定的相关性。
3.5 黄酮类化合物的结构类型与I(M+·)/I([M+H]+)值
黄酮类化合物的抗氧化活性是众所周知的,根据其结构特征又可分为黄酮醇、黄酮、异黄酮等不同类型结构。本研究选择了3 种黄酮类化合物进行了系统考察与比较分析。其中,Ⅰ-1 ~Ⅰ-5 属于黄酮醇类化合物,结构区别主要在于B 环羟基数目和位置。I(M+·)/I([M +H]+)值分别为0.81,0.79,0.76 和0.7,差异不大,可能原因分析如下:①从结构因素考虑,B 环与A、C 环平面几乎处于垂直的位置,且B 环与C 环之间C1’-C2 键的键级为0.992,说明B 环与C 环的共轭程度很低[15],故B 环羟基数目和位置的变化对共轭体系电子云密度的影响较小;②羟基的给电子能力能够降低化合物的电离能,同时又易与基质形成氢键,又增加其质子亲和力,综合因素的影响结果造成其I(M+·)/I([M +H]+)值的变化不大。另外,与其它化合物相比,Ⅰ-1 在B 环的3’-位上增加了甲氧基,更有利于M+·离子的产生,因此Ⅰ-1 的I(M+·)/I([M+H]+)值大于其它同类化合物。
Ⅰ-6 ~Ⅰ-10 属于黄酮类化合物,其中,Ⅰ-6 和Ⅰ-7 的I(M+·)/I([M +H]+)值分别为0.82 和0.63,二者结构区别主要在于A 环取代基。由于A 和C 环共轭程度较高,取代基对共轭体系电子云密度的影响较大,从而影响M+·离子的强度。前者A 环有3 个邻酚羟基取代,容易形成分子内氢键,有利于M+·离子的稳定,其I(M+·)/I([M+H]+)值比较大。Ⅰ-8,Ⅰ-9 和Ⅰ-10 的结构区别为B 环羟基的数目不同,但其I(M+·)/I([M+H]+)值的差异不大,分别为0.49,0.45 和0.45。分析其原因:一方面,B 环与C 环的共轭程度低,B 环取代的变化对共轭体系电子云密度影响不大;另一方面,羟基的给电子能力能够降低化合物的电离能,又能增加化合物的质子亲和力[16],使其I(M+·)/I([M+H]+)值变化不大。
Ⅰ-11,Ⅰ-12,Ⅰ-13 属于异黄酮类化合物,其中,Ⅰ-11,Ⅰ-12 的主要区别是B 环羟基数目不同,其I(M+·)/I([M+H]+)值差别不大,分别为0.60、0.55,可能原因与上述相同。与Ⅰ-12 相比,Ⅰ-13 的A 环5-位缺少羟基,而羟基的给电子能力有利于M+·离子的产生;同时,5-位羟基易与邻位羰基形成分子内氢键,并不会提高其接受质子的能力,因此,Ⅰ-12 的相对较大,而Ⅰ-13 的I(M+·)/I([M +H]+)值相对较小(0.35)。
以上结果及分析解释了相关化合物在FAB-MS 谱中获得的I(M+·)/I([M +H]+)值的差异,并且从结构因素角度阐述了供电子基的存在将有利于FAB 条件下M+·离子的产生,同时也能提高酚类抗氧化物产生苯氧自由基的稳定性。
3.6 I(M+·)/I([M+H]+)值与抗氧化活性的相关性
本实验将I(M+·)/I([M+H]+)值与文献报道的黄酮化合物抗氧化活性的结果进行了比较,结果见表5。其中,TEAC(Trolox equivalent antioxidant activity)值表示化合物对ABTS+·阳离子自由基的清除能力[17],Effect 值(%)表示化合物对羟自由基(·OH)的清除能力[18]。
从表5 可知,文献报道的两种方法获得结果也不完全一致,但可反映出不同类型黄酮化合物的构效关系。例如,黄酮醇类化合物(Ⅰ-3,Ⅰ-4,Ⅰ-5)的抗氧化能力强于黄酮类(Ⅰ-9)和二氢黄酮类化合物(Ⅰ-14),而且后两类化合物的抗氧化活性大小比较接近。FAB-MS 法的结果表明,化合物I(M+·)/I([M+H]+)值的大小也反映出了同样的变化趋势,即化合物的I(M+·)/I([M+H]+)值越大,其抗氧化活性就越强。因此,FAB-MS 方法测定的I(M+·)/I([M+H]+)值可以反映酚类化合物的抗氧化作用及其强弱。
3.7 方法验证
为了验证FAB-MS 方法的可靠性,对12 种酚类化合物进行了抗氧化能力的预测与评价。其中,Ⅱ-1 ~Ⅱ-3 是黄酮类化合物;Ⅱ-4 ~Ⅱ-6 是二苯乙烯类化合物;Ⅱ-7 ~Ⅱ-12 为复杂多酚化合物。通过FAB-MS 分析,得到I(M+·)/I([M+H]+)值,并与其脂质过氧化的抑制能力进行了比较(TBA 法),见表6。结果表明,这些化合物均表现出较强的抗氧化活性,这与FAB-MS 法预测的结果基本一致。本研究结果进一步表明,对于结构相似的化合物而言,I(M+·)/I([M+H]+)值越大,其抗氧化作用越强。因此,证明FABMS 方法可以用于筛选或预测酚类化合物的抗氧化活性。

表5 由FAB-MS 谱获得的I(M +·)/I([M+H]+)值与其它方法获得黄酮类化合物的抗氧化活性强弱的比较Table 5 Comparison of I(M +·)/I([M +H]+)values obtained from the fast atom bombardment-MS (FAB-MS)spectra of flavonoids and antioxidant activity assayed by other method.

表6 由FAB-MS 谱得到的I(M +·)/I([M +H]+)值与TBA 法获得的12 种化合物的抗氧化活性的比较Table 6 Comparison of I(M +·)/I([M + H]+)values obtained from FAB-MS spectra of 12 phenolic compounds and antioxidant activity assayed by TBA method.
4 结论
通过研究黄酮类化合物结构与FAB 谱中得到的I(M+·)/I([M +H]+)值之间的关系,发现在FAB-MS 谱中有利于产生M+·离子的结构因素同样有利于酚类抗氧化物清除自由基后产生的苯氧自由基的稳定性。采用FAB-MS 方法对12 个酚类化合物进行了抗氧化能力的预测与评价,其结果与TBA 法获得的基本一致。本研究结果表明,对于同种结构类型的酚类化合物,由F AB-MS 法获得的I(M+·)/I([M+H]+)值能较好地反映其抗氧化作用的强弱。另外,FAB-MS 方法具有简便、快速、灵敏度高及用样量少等特点,可以作为酚类化合物抗氧化活性的体外筛选或预测方法,有助于加速抗氧化药物的发现,因此具有良好的应用前景。
1 Halliwell B.Drugs Aging,2001,18(9):685 -716
2 LI Feng,LI Xiao-Gang.J.Military Surgeon in Southwest China,2013,15(2):182 -184
李凤,李小刚.西南军医,2013,15(2):182 -184
3 FAN Hong-Bo.Mordern Med.J.China,2012,14(4):130 -132
范红波.中国现代医药杂志,2012,14(4):130 -132
4 ZHAO Guan-Cong,WANG Tao.Med.Inform.,2013,26(3):337 -339
赵冠聪,王涛.医学信息,2013,26(3):337 -339
5 Li L X,Abe Y,Kanagawa K,Usuia N,Imaia K,Mashinoa T,Mochizukia M,Miyatab N.Anal.Chim.Acta,2004,512(1):121 -124
6 Zhou K Q,Yin J J,Yu L L.Food Chem.,2006,95(3):446 -457
7 Vandjelovic N,Zhu H,Misra H P,Zimmerman R P,Jia Z,Li Y.Mol.Cell Biochem.,2012,364(1-2):71 -77
8 Wang Q,Ding F,Zhu N,Li H,He P,Fang Y.J.Chromatogr.A,2003,1016(1):123 -128
9 Tai C,Peng J F,Liu J F,Jiang G,Zou H.Anal.Chim.Acta,2004,527(1):73 -80
10 Sun T,Jia Z,Xu Z.Bioorg.Med.Chem.Lett.,2004,14(7):1779 -1781
11 Yue Q S,Kadiiska M B,Guo Q,Mason R P.Free Radic.Biol.Med.,2005,38(1):125 -135
12 Yang F,Zhang R P,He J M,Abliz Z.Rapid Commu.Mass Spectrom.,2007,21(1):107 -111
13 HE Jiu-Ming,Zeper Abliz,Yoshio Hano,Ryo Ogawa,LIU Zhan-Zhu,CHEN Shi-Zhi.J.Chin.Mass Spectro.Soc.,2003,24(2):346 -350
贺玖明,再帕尔·阿不力孜,羽野芳生,小川亮,刘站柱,陈世智.质谱学报,2003,24(2):346 -350
14 Szekely G,Allison J.J.Am.Soc.Mass Spectrom.,1997,8:337 -351
15 Acker S A,Koymans L M,Bast A.Free Radic.Biol.Med.,1993,15:311 -328
16 ZHANG Hong-Yu.Chemistry Online,2000 (13)http://lib.ecit.edu.cn/web/chemistry/2000/chemistrymag.org/col/2000/c00008.htm
张红雨.化学通报(网络版),2000 (13)http://lib.ecit.edu.cn/web/chemistry/2000/chemistrymag.org/col/2000/c00008.htm
17 Zhang H Y.Science in China (series B),1999,42:106 -112
18 Aue D H,Webb H M,Bowers M T.J.Am.Chem.Soc.,1972,94(13):4726 -4728
19 Rice-Evans C A,Miller N J,Paganga G.Free Radical.Biol.Med.,1996,20(7):933 -956
20 Husain S R,Cillard J,Cillard P.Phytochemistry,1987,26(9):2489 -2491
