堆肥中亲水性有机物还原容量表征及影响因素研究
2015-06-21崔东宇何小松席北斗檀文炳袁英高如泰
崔东宇 何小松 席北斗 檀文炳 袁英 高如泰
1(中国环境科学研究院环境基准与风险评估国家重点实验室,北京100012)
2(中国环境科学研究院地下水与环境系统创新基地,北京100012)
1 引言
生活垃圾堆肥化处理是我国目前采取的主要处理方式之一。堆肥过程是一种在微生物作用下发生在水溶相中有机物的转化过程,因此,分析研究溶解性有机物(Dissolved organic matter,DOM)的组成结构及演变对表征有机质的转化和堆肥的稳定性具有重要意义[1]。堆肥DOM 通常是操作上的定义,它是指物料经水浸提后,能通过0.45 μm 滤膜、具有不同结构和分子量大小的有机物的连续体或混合体。长期以来,有关DOM 的研究集中于吸附与络合属性,重点是它对重金属和有机污染物迁移扩散的影响[2~4]。自2007 年Bauer 等[5]首次提出了DOM 作为氧化还原缓冲剂的概念,DOM 的氧化还原属性[6]逐渐成为研究热点。
腐殖质可以分为胡敏酸(Humic acids,HA)、富里酸(Fulvic acids,FA)和亲水性有机物(Hydrophilic organic matter,HyI)3 种组分[7,8]。近年来,关于腐殖质氧化还原能力方面的研究主要集中于腐殖酸[9,10],包括HA 和FA 等。相关研究表明,腐殖质的氧化还原功能除了来源其所含的醌基和半醌基外[11,12],还有酚羟基[13]和氨基[14]。同时,腐殖质的芳香性结构[15]和不同电子受体都会对其还原能力产生显著影响。还原容量(Reduction capacity,RC)是衡量DOM 还原能力的重要指标[5],通过对RC 的测定与表征,有助于了解DOM 在环境污染化学中的作用。
HyI 是典型的非均质性化合物,在不同堆肥时期其结构和性质有所不同[17],对电子受体的还原能力可能产生不同影响;然而能否利用测定的还原容量值客观评价亲水性有机物对污染物的还原转化尚缺乏科学基础。本研究分别选取了不同电子受体,同步测定了堆肥两个不同时期HyI 的还原容量,同时结合了光谱学(包括紫外-可见吸收光谱和三维荧光光谱)和统计学(包括方差分析)研究方法,分析了HyI 结构对其RC 的影响。为科学表征亲水性组分的氧化还原特性、揭示其在堆肥体系中的作用提供理论基础,为进一步有效利用堆肥产物对土壤重金属及有机污染物修复提供科学依据。
2 实验部分
2.1 仪器与试剂
使用Analytik Jena Multi N/C 2100 型TOC 分析仪(德国耶拿公司)测量其DOM 浓度,以水溶性有机碳(Dissolved organic carbon,DOC)表示。UNICO-2600A 紫外分光光度计(美国尤尼柯公司)。Hitachi F-7000型荧光光谱仪(日本日立公司)。柠檬酸铁(FeCit)、Fe2(SO4)3和Fe(NO3)3(分析纯,国药集团)。
2.2 样品制备
供试样品采于北京某生活垃圾堆肥厂。所收集的生活垃圾经机械分选挑出木头、砖块、玻璃等不可堆肥物后,采用条垛式堆肥,供氧方式为机械翻堆,整个堆肥过程持续51 天,其中一次发酵21 天,二次发酵30 天。分别采集一次发酵高温期样品和二次发酵结束后筛分所得成品,依次编号S1和S2。
参照文献[7,8]的分离和净化方法将堆肥样品中提取的腐殖质分离为HA,FA 和HyI,并将HyI 冻干后保存。用超纯水将DOM的浓度稀释至DOC =50mg/L,得到HyI贮备液,避光冷藏备用。HyI贮备液基本理化性质见表1。

表1 供试亲水性组分基本性质Table 1 Basic properties of the hydrophilic organic fractions (HyI)samples tested
2.3 还原容量的测定
取所制备好的HyI 溶液20 mL,分别加入20 mL 0.5 mmol/L Fe2(SO4)3、1 mmol/L Fe(NO3)3和柠檬酸铁(FeCit),混合于100 mL 锥形瓶中,遮光振荡48 h 后,10000 r/min离心,采用注射针头取上清液测定Fe2+。以只加入Fe2(SO4)3,Fe(NO3)3和FeCit 处理为空白对照,并扣除HyI 溶液中本底Fe2+含量。Fe2+的测定采用邻啡罗啉比色法[17]。RC 根据还原产生Fe2+需要的电子量计算(生成1 mol Fe2+需要1 mol 电子),即单位为每摩尔碳的HyI 所提供的电子量,用mmol e-/mol C 表示。实验中所有处理均设3 个重复实验数据,剔除异常值后,采用SPSS 17.0 和Excel 2010 进行S-N-K 方差分析。
2.4 菌株的培养
MR-1 菌的活化、传代和培养均在有氧条件下进行。使用LB 培养基(10 g/L 蛋白胨,5 g/L 酵母膏,10 g/L NaCl)于室温下活化三代,取生长至对数期(12 h)的细菌离心(3000 r/h,30 min,4 ℃),用碳酸盐缓冲液(2.5 g/L NaHCO3和2.5 g/L NaCl,pH =7.0)清洗离心两次。配制无机培养液:1500 mg/L NH4Cl,600 mg/L NaH2PO4,100 mg/L CaCl2·2H2O,100 mg/L KCl,2 mg/L MgCl2·6H2O,5 mg/L MnCl2·4H2O 和1 mg/L NaMoO4·2H2O。将培养好的菌株移至无机培养液中,并加入碳酸盐缓冲液备用。后续实验中,加入含有MR-1 无机培养液,加入5 mmol/L 乳酸钠作为营养源,按照2.3 节测量还原容量。
2.5 紫外-可见吸收光谱
紫外-可见吸收光谱分析扫描波长范围为200 ~700 nm,扫描间距为1 nm,将待测HyI 浓度(以DOC计)调节至16.67 mg/L[18]。测定254 和280 nm 处吸光度A254和A280,计算SUVA254和SUVA280(SUVA=A×100/DOC)。测定各溶液在250 和365 nm 处的吸光度值(A250和A365),并计算A250/A365值(即A2/A3);分别测定各溶液在465 和665 nm 处的吸光度值(记为A465和A665),并计算A465/A665值(即A4/A6)。
2.6 荧光光谱
将待测HyI 浓度(以DOC 计)调为统一值后进行测定,样品荧光光谱扫描参数如下:三维荧光光谱:激发波长λex=200 ~450 nm,发射波长λem=280 ~520 nm,扫描速度设为12000 nm/min。光谱扫完后,采用荧光区域体积积分(FRI)的方法对EEM 光谱进行定量分析,提取特征荧光参数[19]。
3 结果与讨论
3.1 堆肥HyI的还原容量
采用了堆肥未腐熟阶段样品S1和腐熟后筛分成品S2作为电子供体,Fe2(SO4)3、Fe(NO3)3和FeCit作电子受体,发现相同实验条件下,堆肥腐熟前后的HyI 组分还原容量有所差异,如图1 所示,以Fe2(SO4)3作为电子受体时,S2还原容量为15.88 mmol e-/mol C,高于还原容量为13.45 mmol e-/mol C的S1,同样以Fe (NO3)3和FeCit 作电子受体时,腐熟阶段样品S2还原容量为13.41 和51.45 mmol e-/mol C,均高于未腐熟阶段样品S1还原容量11.77 和43.16 mmol e-/mol C。3 种电子受体的分析结果均表明:腐熟筛分后HyI 的还原容量大于未腐熟阶段的HyI 还原容量值。
采用3 种Fe3+化合物Fe2(SO4)3,Fe(NO3)3和FeCit,在相同条件下,电子受体不同,导致HyI 的还原容量大小也有明显差异。如图1 所示,对于供试的堆肥两种不同阶段的HyI,FeCit 条件下测得RC 远远高于以其它两种Fe3+化合物作为电子受体条件下测得的值,对于Fe2(SO4)3和Fe(NO3)3两种电子受体条件下,HyI 的还原容量相差不大;而Fe2(SO4)3条件下测得的RC 略高于以Fe(NO3)3作为电子受体的测得值。结果表明,不同电子受体对HyI 还原容量影响显著,与文献[5]的报道结果一致。
采用FeCit 所获得的RC 差异值远高于其它两种Fe3+化合物主要是由于FeCit 独特的理化性质。据文献报道,在没有HyI 存在的条件下,一旦受到光照或溶液温度升高FeCit,可以自身逐渐还原为亚铁盐。由于其独特的性质,若选用FeCit 作为电子受体测HyI 还原容量时,需尽量控制反应在常温避光条件下进行。采用Fe2(SO4)3、Fe(NO3)3和FeCit 所获得的RC 差异,还可能是由于三者氧化还原电位差异,导致接受电子的能力不同[20]。有文献认为有机物氧化还原特性主要通过螯合分子的内部电子传递体现[21,22]。当螯合作用形成的共用电子对较为稳定时,电子无法明显被金属离子一方俘获从而还原-螯合和还原作用是即竞争又促进的两个过程[23,24]:当螯合作用较强时,还原现象则减弱;而还原作用的产生却又得益于螯合作用中形成的共用电子对。在HyI 和Fe3+发生作用时,受配位体Cit3-和伴随离子SO42-,的影响,Fe3+与HyI 结合的紧密程度,以及Fe3+与HyI 中还原基团的亲和性均会影响HyI 对Fe3+的还原。
同时,HyI 与金属离子作用后空间结构的变化也可能导致HyI 还原Fe(NO3)3较Fe2(SO4)3的还原容量(RC)小。根据两相反应机理[25],电子接受体除和HyI 表面功能基团接触外,还会扩散进入HyI 内部与结合位点发生反应,使得HyI 结构内部的排斥减小,HyI-FE 表观稳定系数降低,其结果一方面使得内部金属离子螯合强度增加,同时也增加了外部金属离子进入HyI 内部与还原基团发生作用的机会[26]。又因为每3 个SO42-与2 个Fe3+结合,而每3 个仅与1个Fe3+结合[5],从而无机阴离子干扰反应较少,增加了Fe2(SO4)3所提供的Fe3+与HyI 内部还原基团发生接触的机会,导致最终测定的还原容量值偏高。
采用Fe3+还原法获得HyI 的RC 值,受Fe3+化合物种类影响,还原容量只是相对量,而非绝对量。此外,如果采用Fe3+还原法评估HyI 对其它污染物(例如重金属和有机污染物等)还原,只能反映不同HyI 的相对还原能力大小,而不能反映HyI 对污染物的实际还原容量。因此,建议直接采用污染物做电子受体来评价HyI 对于该污染物的实际还原能力。
对于不同电子受体的条件下,HyI 虽然具有不同的还原容量,但是通过堆肥各个阶段达到腐熟并筛分后得到堆肥产品的HyI 的还原容量高于未腐熟阶段的样品。说明通过堆肥过程中结构和组分复杂的变化,可以增大HyI 的还原容量,增加堆肥的可利用性,利用其修复土壤的重金属污染具有重要的意义。
3.2 结合紫外-可见光谱比较堆肥不同阶段亲水性有机物还原容量
由于HyI 是典型的非均质性化合物,其结构和组成存在较大差异,导致堆肥不同阶段样品HyI 还原容量不同。本研究采用紫外-可见光光度法,分析堆肥不同阶段HyI 氧化还原能力产生差异性的原因。图2 为不同堆肥时期HyI 的紫外-可见吸收光谱曲线。堆肥HyI 紫外吸收强度随波长的增加而呈降低趋势,并且在270 nm 附近出现一个吸收平台。已有的研究显示,270 nm 附近的吸收平台为腐殖质物质中木质素磺酸及其衍生物的光吸收引起,并且随着腐殖质芳香族和不饱和共扼双键结构的增加腐殖质物质单位摩尔紫外吸收强度增强[27,28]。其中样品S2的紫外吸收强度明显高于S1,因此腐熟阶段HyI的紫外吸收曲线表明,随着堆肥过程中腐殖质物质芳香度和不饱和度增加,进而腐殖化程度增加,导致堆肥DOM 中含有的亲水性组分的还原容量增大。
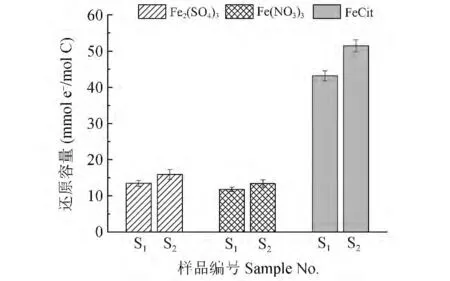
图1 不同堆肥阶段不同电子受体条件下还原容量Fig.1 Reduction capacity of the HyI obtained at different composting stage and determined by different electron acceptor
亲水性组分的还原容量不同可能与HyI 中的某些结构和功能基团有关。由表2 可知未腐熟阶段样品S1的SUVA254值为0.94,腐熟后样品S2升高至1.22,表明随着堆肥的进行芳香族和不饱和共轭双键结构增多,这两种结构能够进一步形成酚羟基、羧基和醌基,导致样品S2还原容量高于S1。SUVA280从0.67 上升为0.98,A2/A3比值从7.38 下降至6.37,二者均表明腐熟后堆肥样品中的HyI 分子量增加,有机分子的结合形成了更多的自由电子,增强了HyI 提供电子的能力;A4/A6值呈现出上升趋势,由堆肥前期的2.11 变为堆肥结束时的2.65,A4/A6越小,芳香化程度越高,说明随着堆肥进行堆肥样品中的有机质芳化度降低,而氧化还原能力相应升高。这与已有文献报道一致,进一步证实了HyI 的还原容量与芳香族和不饱和共轭双键结构含量正向相关,同时与有机质的分子量大小正相关;而与其芳香化程度负相关。

表2 紫外-可见吸收光谱特征参数Table 2 Characteristic parameters of UV-vis absorption
还有研究表明,堆肥过程中物质组成及物质之间的转化也会对亲水性有机质的氧化还原能力产生影响。3 个相对重要区域的光谱被分配到第一个吸收带(A1)、第二个吸收带(A2)及第三个吸收带(A3),分别对应波长260 ~280 nm,460 ~480 nm 和600 ~700 nm[32]。其中,A2/1反映了木质素和其它物质在腐殖化开始的比例,以及其它物质开始转化时的含量;A3/2指出了芳香性成分的压缩和聚合水平,并估计出分子大小。通过对紫外-可见吸收光谱3 个特征区间的面积积分比值可知,A2/1(A2/1=A(A2)/A(A1))由2.53 降低为2.00,说明未腐熟阶段含有木质素结构含量高于腐熟阶段,而且木质素提供电子能力低于其分解产物。A3/2(A3/2=A(A3)/A(A2))由0.06 降低至0.04,表明芳香性成分的压缩和聚合水平逐渐减小,即芳化度降低,进一步导致HyI 还原容量升高,这与之前对A4/A6讨论的结果一致。
3.3 结合三维荧光光谱比较堆肥不同阶段亲水性有机物还原容量
DOM 含有多种活性较高的荧光基团,在一定条件下能发射荧光,因此可利用荧光光谱学方法,进一步研究样品S2还原容量高于S1的影响因素。如图3 所示,根据文献[22],堆肥DOM 的三维荧光光谱可划分为5 个区,Ⅰ区和Ⅱ区与类蛋白物质有关,其激发波长/发射波长范围分别为200 ~250 nm/280 ~325 nm,200 ~250 nm/325 ~375 nm,Ⅲ区与类富里酸物质有关,其激发/发射波长范围为200 ~250/375 ~550 nm,Ⅳ区与可溶性微生物降解产物有关,其激发/发射波长范围为>250/280 ~375 nm,而Ⅴ区与类胡敏酸物质有关,其激发/发射波长范围为>250/375 ~550 nm。
为进一步分析堆肥DOM 的亲水性组分中与Fe3+发生氧化还原反应的主要组分,本研究对比了给Fe3+提供电子前后的三维荧光图,并对其体积积分值及百分比进行分析。表3 显示,与未腐熟阶段相比,腐熟阶段的HyI 三维荧光体积积分值均有所上升,Ⅰ、Ⅱ、Ⅲ、Ⅳ和Ⅴ区分别从0.20 ×106,0.47 ×106,1.61 ×106,1.13 ×106和4.69 ×106上升为0.21 ×106,0.95 ×106,4.57 ×106,2.74 ×106和14.05×106au-nm2-[mg/L C],表明随着堆肥进行产生的具有荧光特性的HyI 增多,相应的氧化还原能力增强。通过体积积分比例可知,Ⅲ和Ⅴ区的体积积分比值由未腐熟阶段的19.7%和57.8%上升为20.3%和62.4%,说明类富里酸物质和类胡敏酸物质是促使HyI 还原容量增大的主要因素。
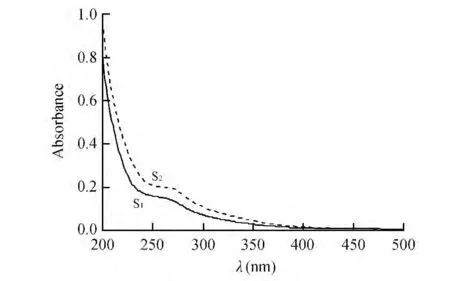
图2 腐熟前后HyI 紫外-可见吸收光谱曲线Fig.2 UV-visi spactra of HyI before and after composting
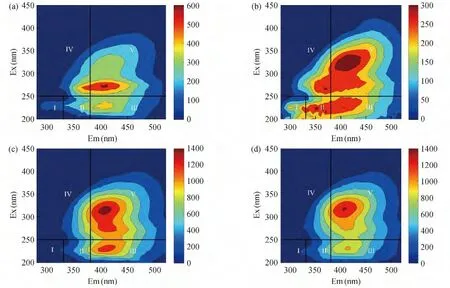
图3 堆肥不同阶段HyI 还原Fe3+反应前后三维荧光光谱图Fig.3 Excitation-emission matrix spactra of HyI under different conditions
通过对比发现(见表3),在未腐熟样品S1 中,相比于未还原Fe3+时HyI 三维荧光光谱图的体积积分值,与Fe2(SO4)3反应后,Ⅲ、Ⅳ和Ⅴ区体积积分值分别从1.61 ×106,1.14 ×106和4.69 ×106下降为1.25 ×106,1.02 ×106和3.88 ×106au-nm2-[mg/L C],而Ⅰ区和Ⅱ区体积积分值增大。说明与Fe3+发生氧化还原反应过程中类富里酸物质、可溶性微生物降解产物和类胡敏酸物质被消耗,生成了类蛋白物质。进一步对比体积积分百分比发现,Ⅲ和Ⅴ区的体积积分百分比分别由19.9%和57.8%下降至17.8%和55.0%,表明类富里酸物质和类胡敏酸物质是HyI 与Fe3+发生氧化还原反应的主要组分,这与之前对腐熟前后的讨论结果相一致。

表3 亲水性组分三维荧光光谱区域体积积分定量分析Table 3 Regional volume integral analysis of excitation-emission matrix fluorescence spectra of the HyI samples
同样,腐熟阶段的样品S2,相比于原始未还原Fe3+时的HyI 三维荧光光谱图的体积积分值,与Fe2(SO4)3反应后仅有Ⅰ区体积积分值略有上升,从0.21 ×106上升至0.29 ×106au-nm2-[mg/L C]。Ⅱ,Ⅲ,Ⅳ和Ⅴ区均呈现下降趋势,分别从0.95 ×106,4.57 ×106,2.74 ×106和14.05 ×106下降至0.89 ×106,3.592 ×106,2.56 ×106和12.90 ×106au-nm2-[mg/L C]。与未腐熟阶段样品相比,腐熟阶段的类蛋白质也能参与氧化还原反应对Fe3+进行还原。通过对比氧化还原反应前后体积积分百分比,发现仅有Ⅲ区体积积分由反应前的20.3%下降至17.8%,其它区体积积分百分比均升高,说明腐熟阶段的类富里酸物质是影响HyI 还原容量的主要组成物质。
分析三维荧光图可知,未腐熟阶段的样品S1与Fe3+发生氧化还原反应后三维荧光图变化明显,说明物质结构改变程度高。相反,腐熟阶段的样品S2反应后荧光峰无明显变化,说明腐熟后的堆肥样品中的HyI 参与氧化还原反应结构和组成变化较小,电子穿梭特性保持稳定,电子循环能力强。对于进一步利用堆肥DOM 中的HyI 的氧化还原特性修复土壤中的污染物具有重要意义。
3.4 微生物对堆肥HyI的还原容量影响
参照文献[26],将DOM 还原容量分为本地还原容量(Native reducing capacity,NRC)和微生物还原容量(Microbial reducing capacity,MRC)。为研究加入微生物对HyI 还原容量影响,采用Fe(NO3)3作电子受体,分别测定以下3 种情况的RC:a.加入HyI(所测结果为NRC);b.加入MR-1;c.加入HyI 和MR-1 的混合液(所测结果为MRC)。结果表明,腐熟阶段筛分后的样品的NRC 要高于未腐熟阶段,这个结果与之前相同。同时还发现,堆肥腐熟前后样品的MRC 都要低于NRC,如图4 所示,对于未腐熟阶段样品 S1,仅加入 HyI 测得的 NRC 值为11.35 mmol e-/mol C,高于加入MR-1 和HyI 测得的MRC 值(9.51 mmol e-/mol C),也高于仅加入MR-1时的还原容量8.20 mmol e-/mol C ;对于腐熟筛分后的样品S2有同样的规律是,NRC 值为13.54 mmol e-/mol C,高于MRC 值(9.98 mmol e-/mol C),也高于仅加入MR-1 时的还原容量8.52 mmol e-/mol C。
文献[34]报道,DOM 具有电子穿梭特性,在微生物存在的条件下,一方面其可以作为电子受体,接受来自微生物分解有机物这一过程所产生的电子,另一方面又能作为电子供体,将所得的电子转移给Fe3+,如此反复,进而促进微生物对重金属的还原。而在本研究中MRC 却普遍要低于NRC,主要是由于HyI 结构和组成上的特殊性。与胡敏酸和富里酸不同,HyI 主要由低分子量的游离氨基酸、糖类、有机酸和蛋白质等物质组成,本身就是一种碳源,可以作为电子供体被微生物利用[35]。如图5 所示,微生物得到电子后,在进行有氧呼吸的过程中将一部分电子与氧气结合,同时由于微生物对HyI 的利用,破坏了HyI 本身结构,使其无法继续作为电子穿梭体促进微生物对Fe3+的还原,即使有部分电子没有与氧气结合,也无法通过HyI 的电子穿梭特性促进微生物对重金属的还原,减少了Fe3+结合电子的量。

图4 不同堆肥阶段微生物还原容量Fig.4 Microbial reducing capacity of HyI at different stage of composting

图5 微生物存在条件下HyI 还原容量测定机理示意图Fig.5 Sketch of the mechanism for determination of HyI reduction capacity with microorganism
通过对比亲水性组分的NRC 和MRC 可知,在复杂的堆肥体系中,在大量微生物存在的条件下,有氧和无氧交替存在的情况下,HyI 既可以作为电子穿梭体加快微生物对重金属的还原,也可以作为电子供体,向微生物和其它污染物提供电子。所以,控制氧气量可以有效提高堆肥产物修复受污染的土壤的利用效率。
4 结论
HyI 由小分子量的物质组成,可以作为电子供体被微生物利用。同时HyI 具有类腐殖质结构,含有醌基、半醌基和酚羟基等官能团,可以作为电子穿梭体促进微生物对重金属的还原。腐熟堆肥样品HyI芳香族和不饱和共轭双键结构增多,有机质的分子量增大,导致堆肥HyI 的还原容量增大;堆肥腐熟后HyI 中类富里酸和类胡敏酸物质的增多是促使HyI 还原容量增大的主要因素。腐熟堆肥产品HyI 的还原容量高于未腐熟阶段的样品,同时腐熟堆肥样品中的HyI 参与氧化还原反应后其结构和组成变化较小,电子穿梭特性稳定,电子循环能力强。上述特性对于利用堆肥HyI 的氧化还原特性修复土壤重金属及其它污染物具有重要意义。
1 Kalbitz K,Solinger S,Park J H,Michalzik B,Matzner A.Soil Sci.,2000,165(4):277 -304
2 Kappler A,Haderlein S B.Environ.Sci.Technol.,2003,37(12):2714 -2719
3 Dunnivant F M,Schwarzenbach R P,Macalady D L.Environ.Sci.Technol.,1992,26(11):2133 -2141
4 HA Xiao-Song,YU Jing,XI BAi-Dou,JIANG Yong-Hai,ZHANG Jin-Bao,LI Dan,PAN Hong-WAi,LIU Hong-Liang.Spectrosc.Spect.Anal.,2012,32(9):2528 -2533
何小松,于静,席北斗,姜永海,张进保,李丹,潘红卫,刘鸿亮.光谱学与光谱分析,2012,32(9):2528 -2533
5 Bauer M,Heitmann T,Macalady D L,Blodau C.Environ.Sci.Technol.,2007,41(1):139 -145
6 Lovley D R,Coates J D,Blunt-Harris A L,Phillips A J,Woodward J C.Nature,1996,382(6590):445 -448
7 Thurman A M,Malcolm R L.Environ.Sci.Technol.,1981,15(4):463 -466
8 Christensen J B,Jensen D L,Grøn C,Filip Z,Christensen T H.Water Res.,1998,32(1):125 -135
9 Andre C,Choppin G R.Radiochim.Acta,2000,88(9/11):613 -618
10 XU Li-Na,LI Zhong-Pei,CHA Yu-Ping.Environmental Science,2009,30(1):221 -226
徐丽娜,李忠佩,车玉萍.环境科学,2009,30(1):221 -226
11 Scott D T,McKnight D M,Blunt-Harris A L,Kolesar S A,Lovley D R.Anviron.Sci.Technol.,1998,32(19):2984 -2989
12 Struyk Z,Sposito G.Geoderma,2001,102(3):329 -346
13 Royer R A,Burgos W D,Fisher A S,Richard F U,DempsAy B A.Anviron.Sci.TAchnol.,2002,36(9):1939 -1946
14 Serudo R L,de Oliveira L C,Rocha J C,Paterlini W C,Rosa A H,da Silva H C,Botero W G.Geoderma,2007,138(3):229 -236
15 Chen J,Gu B,Royer R A,Burgos W D.Sci.Total Environ.,2003,307(1):167 -178
16 FANG Fang,LIU Guo-Qiang,GUO Jin-Song,LIU Zhi-Ping.Environm.Ental.Science,2009,30(3):834 -839
方芳,刘国强,郭劲松,刘智萍.环境科学,2009,30(3):834 -839
17 Determination Methods for Examination of Water and Wastewater.Chinese Environment Science Prass,2002:368 -370
水和废水监测分析方法.中国环境科学出版社,2002:368 -370
18 LI Ming-Xiao,HE Xiao-Song,LIU Jun,XI Bei-Dou,ZHAO Yue,WEI Zi-Min,JIANG Yong-Hai,SU Jing,HU Chun-Ming.Spectrosc.Spect.Anal.,2010,(11):3081 -3085
李鸣晓,何小松,刘骏,席北斗,赵越,魏自民,姜永海,苏婧,胡春明.光谱学与光谱分析,2010,(11):3081 -3085
19 Chen W,Westerhoff P,Leenheer J A,Booksh K.Environ.Sci.Technol.,2003,37(24):5701 -5710
20 Peretyazhko T,Sposito G.Geoderma,2006,137(1):140 -146
21 Allard B,Arsenie I.Water Air Soil Poll.,1991,56(1):457 -464
22 Yang Y,Liang L,Wang D.J.Environ.Sci.,2008,20(9):1097 -1102
23 Gu B,Bian Y,Miller C L,Dong W,Jiang X,Liang L Y.P.Natl.Acad.Sci.,2011,108(4):1479 -1483
24 Rocha J C,Sargentini Jr ÉZara L F,Rosa A H,dos Santos A,Burba P.Talanta,2003,61(5):699 -707
25 Österberg R,Wei S,Shirshova L.Acta Chem.Scand.,1999,53:72 -80
26 WANG Qiang,WEI Shi-Qiang.J.Environ.Sci.-China,2006,26(1):118 -123王强,魏世强.环境科学学报,2006,26(1):118 -123
27 Peuravuori J,Pihlaja K.Environ.Int.,1997,23(4):441 -451
28 Chin Y P,AikAn G,O′Loughlin A.Environ.Sci.Technol.,1994,28(11):1853 -1858
29 Albrecht R,Le Petit J,Terrom G,Périssol C.Bioresource Technol.,2011,102(6):4495 -4500
30 Hernandez M A,Newman D K.Cmls-Cell Mol.Life Sci.,2001,58(11):1562 -1571
31 Gorby Y A,Yanina S,McLAan J S,Rosso K M,Moyles D,Dohnalkova A,Beveridhe T J,Chang I S,Kim B H,Kim K S,Culley D A,Reed S B,Romine M F,Saferini D A,Hill A A,Shi L,Alias D A,Kennedy D W,Pinchuk G,Watanabe K,Ishii S,Logan B,Nealson K H,Fredrickson J K.P.Natl.Acad.Sci.,2006,103(30):11358 -11363
