利塞膦酸对硅酸钙骨水泥材料性能影响及体外释放机理的研究
2015-06-19巩天星张延陈亚东马贺崔笑宇邹云鹏
巩天星 张延 陈亚东 马贺 崔笑宇邹云鹏
论著·实验研究
利塞膦酸对硅酸钙骨水泥材料性能影响及体外释放机理的研究
巩天星 张延 陈亚东 马贺 崔笑宇邹云鹏
目的 探讨利塞膦酸对硅酸钙骨水泥材料性能的影响及其体外缓释的机理。方法 将不同浓度的利塞膦酸(0.1%、0.5%和1.0%)与硅酸钙骨水泥粉末混合后进行水化反应,观察骨水泥固化时间及3天和7天后的抗压强度,并利用X射线衍射仪和Rietveld数字模拟精修方法定性与定量分析水化后骨水泥的相组成。同时,将固化后载药骨水泥样本放入磷酸盐缓冲液中,利用高效液相色谱仪检测利塞膦酸28天内的释放曲线。结果 固化速度及3天和7天后力学强度均受到利塞膦酸的影响,且随着利塞膦酸含量的增加,固化速度减慢,力学性能下降。X射线衍射的定性分析与Rietveld定量分析表明,利塞膦酸强有力附着在硅酸钙水化后产物硅酸钙水凝胶表面,阻碍水化反应进一步发生,从而延长固化时间并减少骨水泥的力学强度。体外药物释放曲线表明,利塞膦酸在浸泡后2周内达到释放峰值,在其后的14天中,并无明显释放,证明硅酸钙骨水泥作为利塞膦酸载药系统具有缓释及控释的效果。吸附与脱附实验及Higuchi方程分析表明,利塞膦酸在水化时形成不溶性钙盐,因此药物释放速度受到制约。结论硅酸钙骨水泥作为利塞膦酸缓释系统具有缓释和控释的效果,有利于合并骨质疏松症患者的骨折修复与重铸。
硅酸钙骨水泥;利塞膦酸;骨质疏松;药物缓释;
引言
硅酸钙骨水泥(calcium silicate cement,CSC)作为一种齿科修复材料已经得到较广泛的临床应用,其生物活性主要源于可释放的硅离子促进成骨细胞增殖、分化,并影响与其相关的基因表达[1,2]。若将其作为可降解骨修复材料,CSC良好的生物相容性和生物活性将会加速破损骨的修复过程,并在整个修复过程中提供足够的力学支撑。对于老年合并骨质疏松症的骨折患者,应用CSC修复骨折时在其中加入适量的利塞膦酸(Risedronate),则能够有效地抑制破骨细胞的活性,减少骨质疏松对骨的破坏,从而增强骨水泥对破损骨骼的修复能力[3]。本文研究了不同含量的利塞膦酸对CSC材料性能的影响以及利塞膦酸在CSC中的缓释机理,现报告如下。
1 材料和方法
1.1 加载利塞膦酸CSC的制备及其材料性能分析
1.1.1 CSC骨水泥的制备
将质量百分比为0.1%、0.5%、1.0%的利塞膦酸钠(Beta Pharma Inc.,Branford,USA)与硅酸钙粉末均匀混合,分别编号为R01CSC、R05CSC和R10CSC。无添加利塞膦酸钠的骨水泥为参照(CSC)。硅酸钙骨水泥粉末主要由硅酸二钙与硅酸三钙按质量比1:1配比组成。骨水泥水化反应按水泥与水比例2:1均匀混合。
1.1.2 固化时间与抗压强度的测试
将均匀混合的骨水泥膏体注入17mm×2mm(直径×高度)的模具中后,将整个模具放置37℃、相对湿度100%的环境中静置30分钟。骨水泥固化时间按照ASTM标准测定。将直径为1mm、重7.8g的探针静置在固化后骨水泥样品上表面,约1~2秒钟后将探针移除。如果上表面无明显压痕,则可认为水泥已固化完成。每个实验样本重复4次。在抗压强度的测试中,将均匀混合的骨水泥膏体注入6mm×12mm的模具中,再将整个模具置于37℃、相对湿度100%的环境中3天和7天。抗压强度测试由INSTRON 3369(GroveCity,PA,USA)完成。每个实验样本重复10次。
1.1.3 骨水泥晶体结构分析
由于CSC水化过程中产生硅酸钙水凝胶与氢氧化钙,X射线衍射仪(MultiFlex,Rigaku,Japan;source Cu-Ka,40 kV,20 mA)用于定性分析固化后骨水泥中氢氧化钙的相对含量,从而间接判断CSC水化反应程度。X射线以每分钟2度的速度在10~60°的范围内扫描。每个实验样本重复4次。Rietveld数字精修用于定量分析固化后骨水泥中各个成分的相对含量。将样本研磨至10 m以下,并以递进式的扫描方式在3~80°的范围内扫描。扫描结果通过国际衍射中心数据库(PDF -4)及西门子Search-Match软件分析,并由Topas 4.2完成精修过程。
1.2 利塞膦酸体外释放机理
1.2.1 利塞膦酸释放曲线的检测
将每一固化3小时后的骨水泥样本浸泡在10m l磷酸盐缓冲溶液中 (pH值=7.4),分别在12小时、1、3、7、14、21及28天时,将原缓冲液与骨水泥样本分离并在容器中更换缓冲液,通过高效液相色谱仪测定原缓冲液中利塞膦酸的含量。流动相由磷酸盐缓冲液和甲醇按体积比88:12配比而成,流速为1m L/m in,紫外检测波长为262nm,柱温控制在25℃。
1.2.2 利塞膦酸在硅酸钙骨水泥中释放的动力学研究
将9g固化后的CSC样本均匀研磨并等分在3个20m L利塞膦酸饱和溶液中,在25℃环境下持续搅拌24、48和72小时后,高速离心3分钟,分离上清液。通过高效液相色谱仪测定上清液中利塞膦酸的含量。将分离粉末重新浸泡在10m L不含利塞膦酸的纯水中,分别持续搅拌24、48和72小时后,分离上清液并再次测定上清液中利塞膦酸含量。利塞膦酸的释放曲线可以通过3D Higuchi公式来解释:
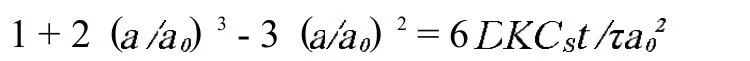
式中, 为释放时间,D为利塞膦酸在磷酸盐缓冲液中的扩散率,为固化后硅酸钙骨水泥微气孔的曲折率,CS为利塞膦酸在磷酸盐缓冲液中的溶解度,a为固化后硅酸钙柱体半径,a0为剩余药物在柱体中所占半径,利塞膦酸比重K约等于0.535 cm3/g。()3代表柱体中剩余药物百分比 (1-%药物释放量)。利塞膦酸在磷酸盐缓冲液中的扩散率 (D)可以从Stokes-Einstein方程计算得出为2.2×10-6cm2/s。微气孔曲折率 ()可由公式 1/=1-2/3[(1+)(1-)2/3]计算得出,在硅酸钙骨水泥体系中可以近似等于3。
1.3 统计分析
IBM SPSS Statistical software v.19.0(SPSS,Chicago, IL,USA)在本实验用来统计数据分析。所有数据结果以平均值±标准差(±S)的形式给出。单向方差分析 (one-way ANOVA)用来比较各组数据之间的统计学差异)。
2 结果
2.1 利塞膦酸对硅酸钙骨水泥材料性能的影响
如表1所示,骨水泥固化时间和抗压强度均受到利塞膦酸的影响,当利塞膦酸含量高于0.5%时,影响尤其显著。
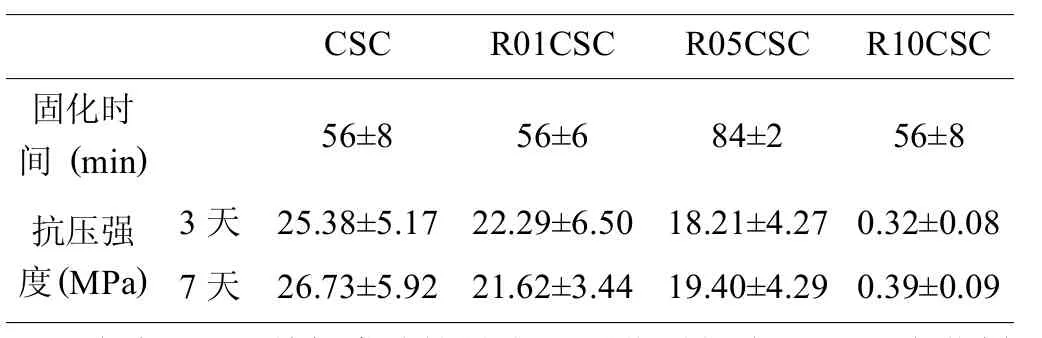
表1 骨水泥固化时间与固化3天及7天后抗压强度
含有1.0%利塞膦酸的骨水泥固化时间大约是不含药样品的两倍,而其抗压强度显著低于不含药样本 (<1MPa)。0.1%的利塞膦酸对骨水泥的影响可以忽略不计。由此可见,利塞膦酸对骨水泥固化和强度的影响与利塞膦酸浓度存在一定的关系,浓度越高,影响越明显。X射线衍射分析(图1)和Rietveld数字精修 (表2)进一步揭示了利塞膦酸对硅酸钙骨水泥固化及性能的影响。硅酸钙水化反应产生硅酸钙水凝胶 (CSH-gel)和氢氧化钙 (Ca(OH)2)。氢氧化钙的晶体结构相对于硅酸钙水凝胶的晶体结构更单一,因此更容易出现在X射线衍射图谱中。如表2所示,氢氧化钙含量随着利塞膦酸含量的增加而降低,表明利塞膦酸阻碍硅酸钙水凝胶的形成。而硅酸钙骨水泥固化与其力学性能主要由结晶后的硅酸钙水凝胶提供。Rietveld数字精修进一步证明,在高利塞膦酸含量的水泥样本中,硅酸钙水凝胶的形成被明显阻碍。

图1 水化7天后,4种样本X光衍射图谱

表2 Rietveld数字精修固化后骨水泥中各晶相含量百分比
2.2 药物释放动力学的研究
前期实验证明利塞膦酸在硅酸钙骨水泥固化过程中,与钙离子紧密结合,形成不溶性的钙盐[4]。因此,真正在骨水泥中释放的不是利塞膦酸,而是结合二价钙离子后的不溶性钙盐。这些盐类的溶解度明显低于利塞膦酸的溶解度,因此过低的溶解度减慢了利塞膦酸从骨水泥中的释放,达到了一种缓释、控释的效果。为了使用Higuchi方程来分析释放曲线,我们通过高效液相色谱测得钙盐的溶解度仅为2.3×10-4g/m L等于7.165×10-4M。如图2所示,利塞膦酸的释放主要集中在浸泡的前7天,在第7天时可以近似累积释放达到峰值,而后至28天时释放速度明显减慢,可以忽略不计。而通过Higuchi方程计算得到的释放曲线表明,释放伴随着时间而增加,在一个月后仍有利塞膦酸从骨水泥中释放。在表3中可以发现,利塞膦酸对硅酸钙骨水泥有很强的吸附作用,一旦利塞膦酸结合钙离子,所形成的钙盐不会轻易溶解。

图2 含有利塞膦酸骨水泥样本在磷酸盐缓冲液中释放28天释放曲线

表3 固化后骨水泥粉末在利塞膦酸饱和溶液0、24、48及72小时后,液体中利塞膦酸含量
3 讨论
固化时间和抗压强度的实验数据表明,由于利塞膦酸能够强有力结合钙离子并显著影响硅酸钙骨水泥的水化机理。然而,通过我们的观察发现,在低浓度时 (比如0.1%),利塞膦酸的影响并不明显;而当浓度高于0.5%时,影响显著加强。X射线衍射及Rietveld数字精修结果表明,利塞膦酸阻碍硅酸钙水凝胶的合成,从而延长了固化时间,并降低了骨水泥的力学性能。吸附与脱附实验证明,硅酸钙与利塞膦酸根发生化学反应,结合成不溶性的钙盐(Ca2C7H9NO7P2)[5,6]。在24小时之内,饱和溶液中的利塞膦酸根完全与浸泡在溶液中的硅酸钙水凝胶结合,形成利塞膦酸钙。
高效液相色谱检测利塞膦酸钙的释放曲线与先前其他研究数据类似[7,8]。由于骨质疏松症是一种慢性疾病,需要长期治疗,这种缓释特征有利于在长时间保持治疗效果并加速新生骨骼的生长。在本研究中,硅酸钙水泥的微气孔曲折率可以近似等于3。将曲折率、溶解度和扩散率带入 Higuchi方程中,会得到一条理论释放曲线。而这条曲线表明利塞膦酸钙的释放随着时间而增加,这与实验结果相悖。Higuchi方程假定药物数量充足并可以连续溶解,但实际上利塞膦酸钙的溶解度仅为2.3×10-4g/m L,意味着利塞膦酸钙的释放受到其溶解度的制约。吸附与脱附实验表明,利塞膦酸钙在硅酸钙水凝胶表面形成稳定的化合键,而这种化合键的破裂可以解释为缓冲液中磷酸根离子与利塞膦酸钙中双膦酸根发生替换反应,从而促使在表面的利塞膦酸钙溶解在缓冲液中。从图2中看出,药物累积释放量在7天后达到峰值,说明绝大多数利塞膦酸由于骨水泥包裹,无法发生离子替换从而溶解[9]。因此,Higuchi方程在7天之内可以准确预测利塞膦酸在硅酸钙骨水泥中的释放过程,而后利塞膦酸的释放曲线将受到硅酸钙骨水泥体内降解速率的控制。由于硅酸钙骨水泥的生物降解比较缓慢(0.5~1年),因此这种药物释放系统非常有利于修复合并骨质疏松的骨折与缺损(如高龄股骨粗隆间骨折、桡骨远端骨折等)[10]。
利塞膦酸对硅酸钙骨水泥的固化时间和抗压强度均有影响,而且随着利塞膦酸浓度的提高而加强。这主要是由于利塞膦酸与硅酸钙水凝胶中的钙相结合,从而阻止硅酸钙水化反应的进一步发生。所生成的不溶性利塞膦酸钙强有力的附着在水凝胶的表面,从而减慢了利塞膦酸由硅酸钙骨水泥中的释放。从长期效果的角度来看,与传统的CPC相比,这种缓释效果更有利于合并骨质疏松症患者的治疗,能够长期提供足够的力学支持,从而改善患者的临床预后。其作为生物医学骨组织修复材料具有较好的应用价值。
[1]Hochmuth K,Proschek D,Schwarz W,Mack M,Kurth AA,Vogl TJ.Percutaneous vertebroplasty in the therapy of osteoporotic vertebral compression fractures:A critical review.Eur Radiol,2006, 16:998-1004.
[2] NiS,Chang J,Chou L,Zhai W.Comparison of osteoblast-like cell responses to calcium silicate and tricalcium phosphate ceramics in vitro.J Biomed Mater Res B Appl Biomater,2007,80:174-183.
[3] Rogers M J,Crockett JC,Coxon FP,Monkkonen J.Biochemical and molecular mechanisms of action of bisphosphonates.Bone, 2011,49:34-41.
[4] Gong T,Wang Z,Zhang Y,Sun C,Yang Q,Troczynski T,et al. Preparation,characterization,release kinetics,and in vitro cytotoxicity of calcium silicate cement as a risedronate delivery system.J Biomed Mater Res A,2014,102:2295-2304.
[5] Boanini E,Torricelli P,Gazzano M,Fini M,Bigi A.The effect of zoledronate-hydroxyapatite nanocomposites on osteoclasts and osteoblast-like cells in vitro.Biomaterials,2012,33:722-730.
[6]Hayakawa T,Furuya N,Yasuoka S,Katoh T,Fukushima T.Computational analysis of bisphosphonates and bisphosphonate/calcium complexes.J Oral Tissue Eng,2010,8:107-114.
[7]Kim CW,Yun YP,Lee HJ,Hwang YS,Kwon IK,Lee SC.In situ fabrication of alendronate-loaded calcium phosphate microspheres:Controlled release for inhibition of osteoclastogenesis.J Control Release,2010,147:45-53.
[8] Sorensen TC,Arnoldi J,Procter P,Robioneck B,Steckel H.Bone substitute materials delivering zoledronic acid:Physicochemical characterization,drug load,and release properties.J Biomater Appl,2013,27:727-738.
[9] Queffelec C,Petit M,Janvier P,Knight DA,Bujoli B.Surface modification using phosphonic acids and esters.Chem Rev,2012, 112:3777-3807.
[10]Delmas PD.Treatment of postmenopausal osteoporosis.The Lancet,2002,359:2018-2026.
Effects of risedronate on calcium silicate cement material properties and its in vitro drug release mechanism
Gong Tianxing,Zhang Yan,Chen Yadong,et al.Northeastern University Sino-Dutch Biomedical and Information Engineering School,Shenyang Liaoning,110169,China
Objective The effects of risedronate on calcium silicate cement(CSC)material properties and in vitro drug release mechanism were investigated.Methods CSC mixed with 0.1%,0.5%and 1.0%of risedronate was allowed to hydrate.Setting time,3-day and 7-day compressive strength of the CSC was tested.X-ray diffraction and Rietveld refinement were performed to analyze compositional difference in both qualitative and quantitative ways.In addition,High performance liquid chromatography was used to analyze risedronate release profiles up to 28 days in phosphate buffer solution.Results Both setting time and compressive strength were affected by risedronate in a concentration-dependent manner.X-ray diffraction and Rietveld refinement revealed that risedronate was progressively adsorbed onto CSH gel,preventing further hydration of calcium silicate.Drug release profiles demonstrated that there was a burst in release concentration within the first2weeks,and,in the following 14 days,drug release reached a pseudo-steady state,implying that CSC as a potential drug delivery system of risedronate is controllable and sustainable.It was also found that risedronate release from CSC was degradation-controlled instead of diffusion-controlled.Conclusion CSC as a risedronate drug delivery system is controllable and beneficial to bone fractured patients caused by osteoporosis.
Bone cement;Risedronate;Bone fracture;Drug delivery;Biodegradation;In vitro test
R3I8.08
A
巩天星(1985-)男,博士,副教授。研究方向:生物骨材料开发与应用。应用3D打印技术,快速实现CAI/CAD/CAM个性定制化人造骨骼替代物,并实现产品向临床应用上的转化。(
2014-11-19)
10.3969/j.issn.1672-5972.2015.02.001
swgk2014-11-0216
东北大学中荷生物医学与信息工程学院,辽宁沈阳110169
